

所属成套资源:2023高考化学精讲+精练+小测[全国]
- 【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题09 化学反应速率与化学平衡(练)(原卷版+解析版) 试卷 1 次下载
- 【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题10 化学反应机理与历程(测)(原卷版+解析版) 试卷 0 次下载
- 【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题10 化学反应机理与历程(讲)(原卷版+解析版) 试卷 0 次下载
- 【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题11 水溶液中离子反应(练)(原卷版+解析版) 试卷 1 次下载
- 【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题11 水溶液中离子反应(讲)(原卷版+解析版) 试卷 0 次下载
【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题10 化学反应机理与历程(练)(原卷版+解析版)
展开
这是一份【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题10 化学反应机理与历程(练)(原卷版+解析版),文件包含专题10化学反应机理与历程练解析版docx、专题10化学反应机理与历程练原卷版docx等2份试卷配套教学资源,其中试卷共101页, 欢迎下载使用。
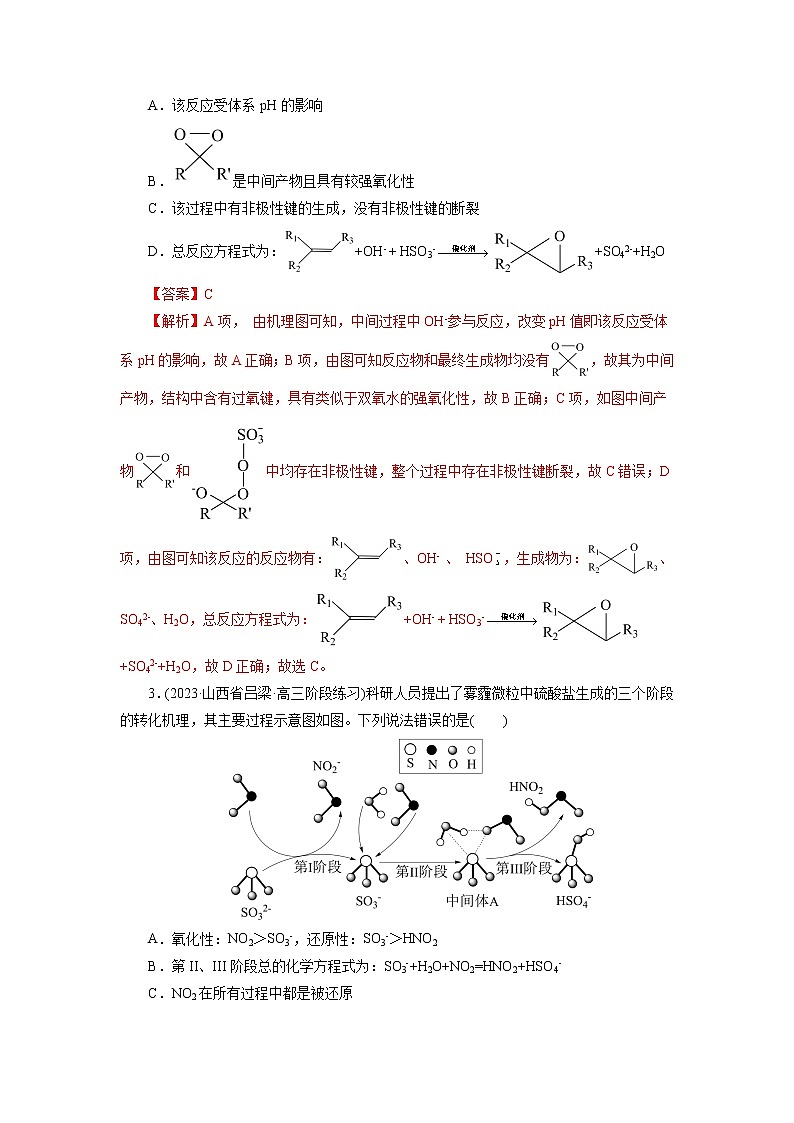
专题10 化学反应机理与历程
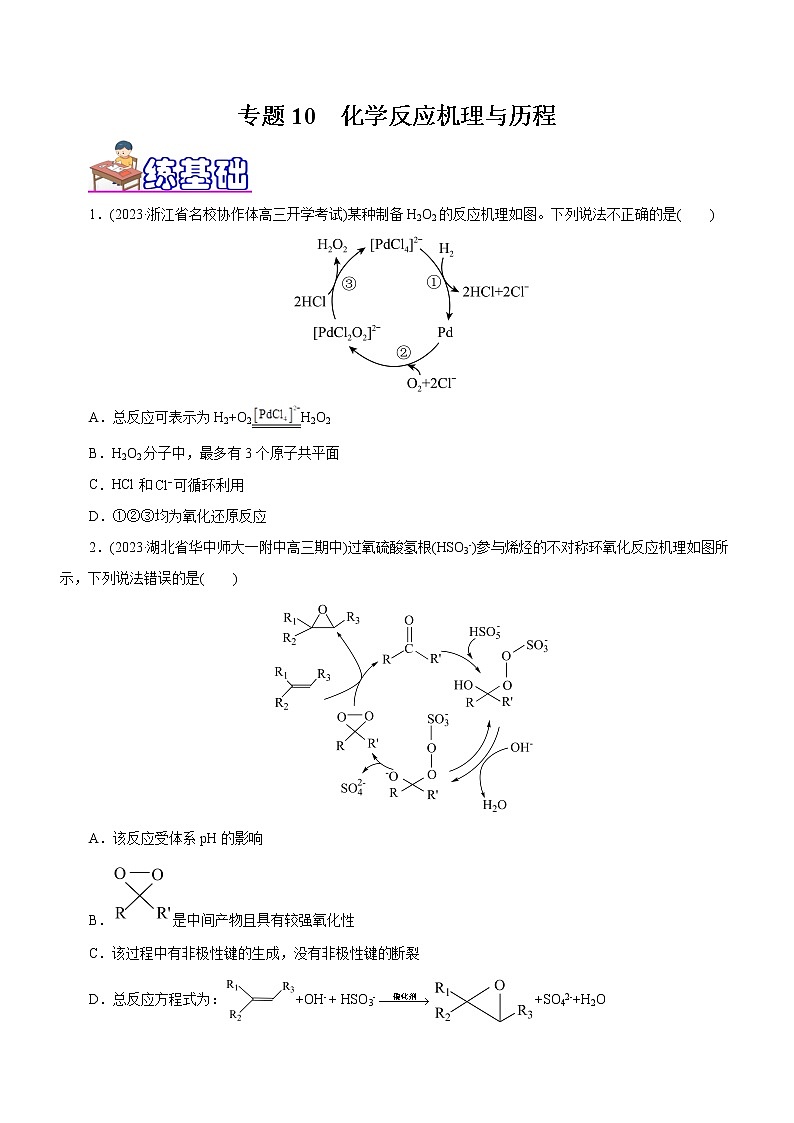
1.(2023·浙江省名校协作体高三开学考试)某种制备H2O2的反应机理如图。下列说法不正确的是( )
A.总反应可表示为H2+O2H2O2
B.H2O2分子中,最多有3个原子共平面
C.HCl和可循环利用
D.①②③均为氧化还原反应
【答案】D
【解析】A项,由反应机理可知,氢气和氧气在[PdCl4]2-的作用下生成过氧化氢,反应的化学方程式为:H2+O2H2O2,A项正确;B项,H2O2的分子结构为:,最多有3个原子共平面,B项正确;C项,依据过程图可知,HCl和Cl-可循环利用,C项正确;D项,①、②均为氧化还原反应,③不是氧化还原反应,D项错误;故选D。
2.(2023·湖北省华中师大一附中高三期中)过氧硫酸氢根(HSO3-)参与烯烃的不对称环氧化反应机理如图所示,下列说法错误的是( )
A.该反应受体系pH的影响
B.是中间产物且具有较强氧化性
C.该过程中有非极性键的生成,没有非极性键的断裂
D.总反应方程式为:+OH- + HSO3-+SO42-+H2O
【答案】C
【解析】A项, 由机理图可知,中间过程中OH-参与反应,改变pH值即该反应受体系pH的影响,故A正确;B项,由图可知反应物和最终生成物均没有,故其为中间产物,结构中含有过氧键,具有类似于双氧水的强氧化性,故B正确;C项,如图中间产物和中均存在非极性键,整个过程中存在非极性键断裂,故C错误;D项,由图可知该反应的反应物有:、OH- 、 HSO,生成物为:、SO42-、H2O,总反应方程式为:+OH- + HSO3-+SO42-+H2O,故D正确;故选C。
3.(2023·山西省吕梁·高三阶段练习)科研人员提出了雾霾微粒中硫酸盐生成的三个阶段的转化机理,其主要过程示意图如图。下列说法错误的是( )
A.氧化性:NO2>SO3-,还原性:SO3->HNO2
B.第II、III阶段总的化学方程式为:SO3-+H2O+NO2=HNO2+HSO4-
C.NO2在所有过程中都是被还原
D.上述反应过程中,S的成键数目保持不变
【答案】D
【解析】A项,根据第Ⅰ阶段的方程式NO2+SO32-=NO2-+SO3-,NO2为氧化剂,SO3-是氧化产物,所以氧化性NO2>SO3-;第Ⅱ、Ш阶段总的方程式SO3-+H2O+NO2=HNO2+HSO4-可得还原性:SO3->HNO2,A正确;B项,根据图示可知:在第Ⅱ阶段,SO3-、NO2在H2O存在条件反应产生中间体A。在第Ⅲ阶段,中间体A转化为HSO4-和HNO2,故第Ⅱ、Ⅲ阶段总的化学方程式为:SO3-+H2O+NO2=HNO2+HSO4-,B正确;C项,根据图示的转化过程知该过程中NO2→NO2-,NO2→HNO2,NO2化合价均降低被还原C正确;D项,由题图可知由,SO32-最终生成HSO4-,S的成健数目由3变为4,D错误。故选D。
4.(2023·河南省部分学校高三期中)阿特拉津(ATZ)是农业中使用广泛且难以降解的除草剂,某科学组织研究发现,以FeSx@MoS2为催化剂(呈花束状)催化活化过一硫酸盐(PMS)降解阿特拉津(ATZ)取得了良好的效果,其反应机理如图所示:
下列说法错误的是( )
A.PMS对应的酸为H2SO5,该酸含有过氧键
B.生成SO4·−的途径之一为2SO5·−=2SO4·−+1O2
C.流程中直接氧化ATZ的微粒只有1O2
D.S2-、S22-以及Fe0可以促进Fe2+再生
【答案】C
【解析】A项,由图可知,过一硫酸根离子为HSO3-,对应的酸为H2SO5,该酸可以看成是H-O-O-H中一个氢原子被-SO3H代替的产物,A正确;B项,图示有两种途径生成SO4·−,其中一种为2SO5·−=2SO4·−+1O2,B正确;C项,据图可知,流程中直接氧化ATZ的微粒还有SO4·−、·OH,C错误;D项,S2-、S22-以及Fe0具有还原性,可以还原Fe3+促进Fe2+再生,D正确;故选C。
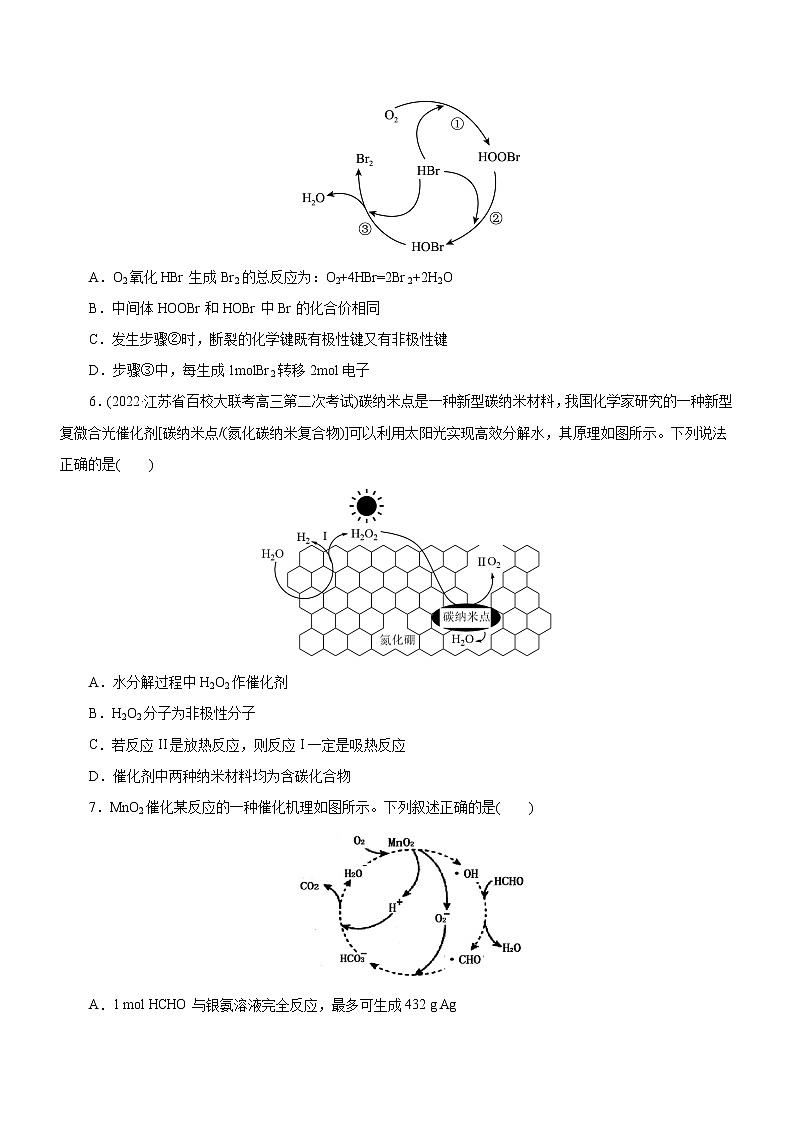
5.(2023·陕西省汉中市龙岗学校高三第一次模拟)据文献报道,我国学者提出O2氧化HBr生成Br2反应历程如图所示。下列有关该历程的说法错误的是( )
A.O2氧化HBr生成Br2的总反应为:O2+4HBr=2Br2+2H2O
B.中间体HOOBr和HOBr中Br的化合价相同
C.发生步骤②时,断裂的化学键既有极性键又有非极性键
D.步骤③中,每生成1molBr2转移2mol电子
【答案】D
【解析】A项,反应①为HBr+O2=HOOBr;反应②为HOOBr+HBr=2HOBr;反应③为HBr+HOBr=H2O+Br2,根据盖斯定律,将①+②+③×2,整理可得总反应方程式为:O2+4HBr=2Br2+2H2O,A正确;B项,中间体HOOBr和HOBr中Br的化合价均为+1价,相同,B正确;C项,步骤②反应为HOOBr+HBr=2HOBr,在该反应过程中有断裂的化学键有极性键H-Br、H-O、Br-O键的断裂,也有非极性键O-O的断裂,C正确;D项,步骤③反应为HBr+HOBr=H2O+Br2,在该反应中Br元素化合价由HBr中的-1价,HOBr中的+1价变为反应后Br2的0价,每生成1 mol Br2转移1 mol电子,D错误;故选D。
6.(2022·江苏省百校大联考高三第二次考试)碳纳米点是一种新型碳纳米材料,我国化学家研究的一种新型复微合光催化剂[碳纳米点/(氮化碳纳米复合物)]可以利用太阳光实现高效分解水,其原理如图所示。下列说法正确的是( )
A.水分解过程中H2O2作催化剂
B.H2O2分子为非极性分子
C.若反应II是放热反应,则反应I一定是吸热反应
D.催化剂中两种纳米材料均为含碳化合物
【答案】C
【解析】A项,H2O2是水分解过程中中间产物而不是催化剂,A错误;B项,H2O2分子结构是不对称的,为极性分子,B错误;C项,水分解的总反应是吸热反应,根据盖斯定律,若反应Ⅱ是放热反应,则反应I一定是吸热反应,C正确;D项,碳纳米点是单质,D错误。故选C。
7.MnO2催化某反应的一种催化机理如图所示。下列叙述正确的是( )
A.1 mol HCHO与银氨溶液完全反应,最多可生成432 g Ag
B.该反应可以消耗温室气体CO2
C.催化过程中,所发生的反应均为氧化还原反应
D.O2-为中间产物之一,该微粒与Na2O2中所含阴离子种类相同
【答案】A
【解析】A项,1molHCHO中存在2mol的醛基结构,故与银氨溶液完全反应,最多可生成4molAg,即432gAg,故A项正确;B项,该反应产生CO2,故B项错误;C项,催化机理存在一步HCO3-与H+反应生成CO2的过程,这一步不是氧化还原反应,故C项错误;D项,Na2O2中的阴离子是O22-,与O2-种类不一样,故D项错误;故选A。
8.贵金属钯可催化乙醇羰基化,反应过程如图所示,下列说法错误的是( )
A.C-H键所处环境不同,稳定性也不同
B.贵金属钯也可将R2CHOH羰基化
C.反应物CH3CH2OH→产物CH3CHO,发生了氧化反应
D.反应过程中,Pd的成键数目保持不变
【答案】D
【解析】A项,C-H键所处环境不同,稳定性也不同,A正确;B项,R2CHOH中与-OH相连的C上有H,贵金属钯也可将R2CHOH羰基化,B正确;C项,反应物CH3CH2OH→产物CH3CHO,发生了氧化反应,C正确;D项,反应过程中,Pd与原子成键结构改变,成键数目改变,D错误。故选D。
9.利用镍(Ni)及其他过渡金属配合物催化 CH2=CH2 和 CO2 氧化偶联合成丙烯酸的催化机理如图:
下列说法错误的是( )
A.丙烯酸的分子式是 C3H4O2
B.该反应可消耗温室气体 CO2
C.该催化循环中 Ni 的成键数目未发生变化
D.总反应可表示为 CH2=CH2+CO2 CH2=CHCOOH
【答案】C
【解析】A项,丙烯酸的结构式为CH2=CHCOOH,所以分子式是 C3H4O2,故A正确;B项,由图可知,该反应可吸收温室气体 CO2参与反应,故B正确;C项,由图可知,该催化循环中 Ni 的成键数分别为2,3,成键数目发生变化,故C错误;D项,由图可知,总反应可表示为 CH2=CH2+CO2 CH2=CHCOOH,故D正确;故选C。
10.交叉偶联的反应机理如图,图中R为烃基,Ph为苯基。下列说法不正确的是( )
A.●CH2R是反应的中间体
B.循环产物Ni呈现的化合价有3种
C.反应过程中Ni的成键数目发生变化
D.交叉偶联的总反应为RCH2I+PhI+MnPhCH2R+MnI2
【答案】B
【解析】A项,根据交叉偶联的反应机理可知,●CH2R是反应的中间体,故A正确;B项,由图可知,Ni的化合价呈现0价、+1价、+2价、+3价四种,故B错误;C项,反应过程中Ni的成键数目有4、5、3、2,发生变化,故C正确;D项,根据交叉偶联的反应机理可知,交叉偶联的总反应为RCH2I+PhI+MnPhCH2R+MnI2。故D正确;故选B。
11.利用分子筛催化剂,NH3可脱除燃煤烟气中的NO和NO2,生成两种无毒物质,其反应历程如图所示,下列说法正确的是( )
A.X和Y均是N2
B.上述历程的总反应为:2NH3+NO+NO22N2+3H2O
C.阶段④中氮元素只被还原
D.NH3、NH4+、H2O中的质子数、电子数均相同
【答案】B
【解析】A项,图示反应可以生成X的反应[(NH4)2(NO2)]2++NO=[(NH4)(HNO2)]++X+H+,原子守恒判断X为N2和H2O,故A错误;B项,由反应历程图可知,氨气、二氧化氮和一氧化氮是反应物,氮气与水是生成物,所以总反应为:2NH3+NO+NO22N2+3H2O+3H2O,故B正确;C项,阶段④中氮元素由[(NH4)(HNO2)]+变成氮气,氮元素的化合价有升高有降低,氮元素既被氧化也被还原,故C错误;D项,NH3、NH4+、H2O中的质子数分别为10、11、10;NH3、NH4+、H2O中的电子数为:10、10、10,所以质子数不同,故D错误;故选B。
12.某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程示意图如下(图中只画出了HAP的部分结构)。下列说法错误的是( )
A.过渡态是该历程中能量最高的状态
B.HCHO在反应过程中,C-H键全部断裂
C.CO2分子中的氧原子全部来自O2
D.该反应可表示为:HCHO+O2CO2+H2O
【答案】C
【解析】A项,过渡态是指反应物体系转变成产物体系过程中,经过的能量最高状态,则过渡态是该历程中能量最高的状态,故A正确;B项,由图示可知,HCHO在反应过程中,甲醛分子中的两个C-H键全部断裂,故B正确;C项,根据图知,CO2分子中的氧原子一部分来自O2,另一部分还来自于甲醛,故 C错误;D项,该反应中反应物是甲醛和氧气,生成物是二氧化碳和水,HAP为催化剂,反应方程式为:HCHO+O2CO2+H2O,故D正确;故选C。
13.磺酸树脂催化下的烯烃二羟化反应历程的示意图如下:
(R1、R2、R3、R4均表示烃基或H原子。)
下列说法不正确的是( )
A.过程①中,H2O2作氧化剂 B.过程②中,有碳碳键、碳氢键断裂
C.过程③中反应的原子利用率为100% D.在反应历程中,有水参与反应
【答案】B
【解析】A项,过程①中H2O2中的氧元素由-1价降低到-2价得电子发生还原反应生成H2O,H2O2作氧化剂,故A正确;B项,过程②中 和生成和,断裂的是中的碳碳键和中的硫氧键、氧氧键,故B错误;C项,过程③中只生成了 ,没有其他物质生成,原子利用率为100%,故C正确;D项,过程③中有水参与反应,故D正确。故选B。
14.已知烯烃和H2O2在磺酸树脂()作用下可以生成二元醇,其反应历程的示意图如下(R1、R2、R3、R4均表示烃基或H原子。下列说法错误的是( )
A.整个过程的总反应为H2O2+
B.是该反应的催化剂
C.操作时温度不能过高或过低
D.过程③中反应的原子利用率为100%
【答案】B
【解析】A项,从反应的起始和终止可以看出,整个过程的总反应为H2O2+,A正确;B项,才是该反应的催化剂,是该反应中的中间产物,最后又转为,B错误;C项,温度过高H2O2分解,温度过低反应速率慢,C正确;D项,过程③中产物为一种,没有其它物质生成,原料分子中的原子全部转化成所需要的产物,原子利用率为100%,D正确;故选B。
15.多相催化反应是在催化剂表面通过吸附、解吸过程进行的。我国学者发现T℃时(各物质均为气态),甲醇与水在铜催化剂上的反应机理和能量变化如图。
下列说法正确的是( )
A.反应过程只有C-H键断开
B.反应I的活化能为(c-a)kJmol−1
C.总反应的热化学方程式为:CH3OH(g)+H2O(g)= CO2(g)+3H2(g) ΔH4=(b-a)kJmol−1
D.反应历程中,反应Ⅱ决定整个反应进程的快慢
【答案】C
【解析】A项,据图可知反应过程中甲醇中的O-H键也发生断裂,故A错误;B项,反应I的活化能为反应物断键吸收的能量,即反应I过程中最大能量与a的差值,图中没有体现反应I过程中的最大能量,故B错误;C项,焓变=生成物的能量-反应物能量,据图可知总反应的热化学方程式为:CH3OH(g)+H2O(g)= CO2(g)+3H2(g) H4=(b-a)kJmol−1,故C正确;D项,据图可知反应I的活化能大于反应Ⅱ的活化能,活化能越大反应越慢,慢反应决定整个反应的反应速率,所以反应I决定整个反应进程的快慢,故D错误;故选C。
16.已知活性氧可以把SO2快速氧化为SO3,根据计算机模拟结果,在炭黑表面上O2转化为活化氧的反应历程与能量变化关系如图所示。下列说法正确的是( )
A.O2转化为活化氧与碳氧键生成无关
B.每活化1个O2分子最终吸收0.29 eV能量
C.该过程的最大能垒(活化能)E正= 0.73 eV
D.炭黑可加快SO2转化为SO3的反应速率
【答案】D
【解析】A项,从图中可以看出从氧气到活性氧,需经过炭黑与氧气结合再分开的过程,此时有碳氧键生成和氧氧键的断裂,A错误;B项,开始状态时炭黑和氧气为0 eV,结束后能量变为-0.29 eV,故放出0.29 eV的能量,B错误;C项,从图中可以看出,炭黑和氧气需要先吸收0.75 eV的能量,再释放一些能量,然后吸收能量到0.73 eV,故该过程中的最大能垒E正=0.75 eV,C错误;D项,反应体系中加入炭黑后,体系中的氧气变成活化氧,增加了体系中的活化分子百分数,增加了反应速率,D正确;故选D。
17.我国科学家成功地在铁掺杂W18O49纳米催化剂表面常温下获得较高的氨产量,反应历程如图所示(★表示被吸附在催化剂表面的物种)。下列说法错误的是( )
A.需要吸收能量的最大能垒(活化能)E=1.54eV
B.吸收能垒为1.29 eV步骤的反应为H5N2★=NH3+H2N★
C.选择镍掺杂W18O49纳米催化剂获得反应历程与上述不同
D.投料比[]越大,单位时间内合成氨的产量越高
【答案】D
【解析】A项,根据图示,反应过程中有两步吸收能量,吸收能量的能垒分别为-2.44 eV -(-3.73 eV)= 1.29 eV、-1.02 eV -(-2.56 eV)=1.54 eV,因此吸收能量的最大能垒为1.54 eV,故A正确;B项,吸收能垒为1.29 eV=-2.44 eV -(-3.73 eV),根据图示,该步骤的反应为H5N2★=NH3+H2N★,故B正确;C项,催化剂不同,反应的活化能不同,反应历程不同,因此选择不同的镍掺杂W18O49纳米催化剂获得的反应历程不同,故C正确;D项,氮气比氢气稳定,催化剂活化氮气和氢气,降低氮气、氢气断裂时所吸收的能量,且活化氮气对于反应速率的影响更大,如果通入H2的体积分数过大,氢气分子占据催化剂活性位点过多,必定会导致活化氮气的位点减少,单位时间内有效碰撞的概率降低,使得单位时间内合成氨的产量降低,故D错误;故选D。
18.我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示(吸附在金催化剂表面上的物种用·标注)。
下列说法正确的是( )
A.水煤气的变换反应是吸热反应
B.该历程中逆向的最大能垒(活化能)E逆=2.02eV
C.催化剂能够使物质的能量升高
D.反应历程中,生成过渡态I比过渡态II容易
【答案】D
【解析】A项,一个反应的反应热和反应的过程无关,只和反应物的总能量和生成物的总能量有关,从图中可知,生成的能量低于反应物,该反应是放热反应,A错误;B项,找出逆向最大的活化能,从图中的右侧看到左侧,物质能量增加最大的,能垒最大,即为CO2(g)+H2(g)+H2O·转化为COOH·+2H·+OH·,能垒为1.41-(-0.83)ev=2.24ev,B错误;C项,通过图像可知,催化剂吸附后能够降低反应物的能量,C错误;D项,形成过渡Ⅰ的能垒为1.91ev,形成过渡Ⅱ的能垒为2.02ev,能垒越低,越容易形成,过渡Ⅰ能容易生成,D正确。故选D。
19.水煤气变换反应为:CO(g)+H2O(g)=CO2(g)+H2(g)。我国学者结合实验与计算机模拟结果,研究了在金属催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用标注。下列说法正确的是( )
A.水煤气变换反应的ΔH>0 B.反应历程中,生成过渡态I比过渡态II难
C.该历程中最大能垒(活化能)E正=2.02eV D.步骤⑤只有非极性键H-H键形成
【答案】C
【解析】A项,由图可知,生成物的总能量低于反应总能量的反应,则水煤气变换反应为放热反应,△H<0,A错误;B项,在反应历程中,生成过渡态I的能垒(活化能)为E正=(1.59eV+0.32eV)=1.91eV,而过渡态II的能垒(活化能) E正=(1.86eV+0.16eV)=2.02eV,可见过渡态I比过渡态II容易,B错误;C项,该历程中最大能垒(活化能)即为步骤④,则E正=(1.86eV+0.16eV)=2.02eV,C正确;D项,由图可知步骤⑤生成了CO2(g)和H2(g),步骤⑤有非极性键H-H键、极性键C=O形成,D错误;故选C。
20.科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法错误的是( )
A.②中包含C﹣H键的断裂过程
B.历程中能垒(反应活化能)最小的是③
C.该历程中决定反应速率的方程式为:CH3O*+3H*→CO*+4H*
D.由此历程可知:CH3OH*→CO*+4H*为放热过程
【答案】C
【解析】A项,②中反应为CH3O*+H*=CH2O*+2H*,CH3O*→CH2O*,包含C﹣H键的断裂,故A正确;B项,活化能为反应物的总能量与过渡态能量之差,从图中可以看出,过渡态③发生的反应活化能最小,故B正确;C项,总反应速率由反应速率最慢的那步历程决定,由图可知,历程中能垒(反应活化能)最大的为①,所以制约反应速率的方程式为CH3OH*═CH3O*+H*,故C错误;D项,由图可知,CH3OH*具有的相对能量为﹣40kJ/mol,CO*+4H*具有的相对能量为﹣110kJ/mol,所以CH3OH*→CO*+4H*的△H=﹣70kJ/mol,为放热过程,故D正确;故选C。
21.我国学者结合实验与计算机模拟结果,研究了均相NO-CO的反应历程,反应路径中每一阶段内各驻点的能量均为相对于此阶段内反应物能量的能量之差,下列说法错误的是( )
A.2NO(g) + 2CO( g)N2(g) +2CO2(g) ΔH>0
B.均相NO—CO反应经历了三个过渡态和五个中间体
C.整个反应分为三个基元反应阶段,总反应速率由第一阶段反应决定
D.NO二聚体()比N2O分子更容易与CO发生反应
【答案】A
【分析】整个反应分为三个基元反应阶段,①NO(g) +NO(g) = ΔH=+199.2kJ·mol-1,②+CO(g) =CO2(g) +N2O(g) ΔH=-513.5kJ·mol-1,③CO2(g) +N2O(g) +CO(g) =2CO2(g) +N2(g) ΔH=-307.6kJ·mol-1。A项,①+②+③得:2NO(g) + 2CO( g) N2(g) +2CO2(g) ΔH=+199.2kJ·mol-1-513.5kJ·mol-1-307.6kJ·mol-1=-621.9kJ·mol-1,故A错误;B项,均相NO—CO反应经历了TS1、TS2、TS3三个过渡态,TM1、、TM2、N2O、TM3、五个中间体,故B正确;C项,整个反应分为三个基元反应阶段,①NO(g) +NO(g) = ΔH=199.2kJ·mol-1,②+CO(g) =CO2(g) +N2O(g) ΔH=-513.5kJ·mol-1,③CO2(g) +N2O(g) +CO(g) =2CO2(g) +N2(g) ΔH=-307.6kJ·mol-1,由于所需活化能最高,总反应速率由第一阶段反应决定,故C正确;D项,从②+CO(g) =CO2(g) +N2O(g) ΔH=-513.5kJ·mol-1,③CO2(g) +N2O(g) +CO(g) =2CO2(g) +N2(g) ΔH=-307.6kJ·mol-1,②反应放出的能量更多,生成物能量更低,NO二聚体()比N2O分子更容易与CO发生反应,故D正确;故选A。
22.科学家通过密度泛函理论研究甲醇与水蒸气重整制氢反应机理时,得到甲醇在Pd(Ⅲ)表面发生解离时四个路径与相对能量关系如图所示,其中附在Pd(Ⅲ)表面的物种用*标注。下列说法不正确的是( )
A.该历程中活化能最小的反应方程式 CH2O*+2H* CHO*+3H*
B.该历程中能垒(反应活化能)最大的是①
C.该历程中制约反应速率的方程式为CH3OH*═CH3O*+H*
D.由此历程可知: △H
相关试卷
这是一份【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题10 化学反应机理与历程(讲)(原卷版+解析版),文件包含专题10化学反应机理与历程讲教师版docx、专题10化学反应机理与历程讲学生版docx等2份试卷配套教学资源,其中试卷共35页, 欢迎下载使用。
这是一份【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题10 化学反应机理与历程(测)(原卷版+解析版),文件包含专题10化学反应机理与历程测解析版docx、专题10化学反应机理与历程测原卷版docx等2份试卷配套教学资源,其中试卷共56页, 欢迎下载使用。
这是一份【高考二轮复习】2023年高考化学精讲+精练+小测(全国通用)——专题09 化学反应速率与化学平衡(练)(原卷版+解析版),文件包含专题09化学反应速率与化学平衡练解析版docx、专题09化学反应速率与化学平衡练原卷版docx等2份试卷配套教学资源,其中试卷共104页, 欢迎下载使用。









