





2023届高三化学二轮专题复习 工艺流程题突破1 情景方程式的书写课件PPT
展开这是一份2023届高三化学二轮专题复习 工艺流程题突破1 情景方程式的书写课件PPT,共22页。PPT课件主要包含了思路分析,+H2O,过氧化钙的制备,CaOH2,CaCl2,H2O,Cu2++等内容,欢迎下载使用。
一、非氧化还原反应方程式的书写运用“证据→推理→符号”思路书写新情境方程式的基本过程如下:“读”取题目中的有效信息(证据),写出主要反应物和生成物的化学式(推理+表征),再依据质量守恒、电荷守恒(基本规律),即可轻松写出规范的方程式。
1.根据广义水解原理广义的水解观认为,无论是盐的水解还是非盐的水解,其最终结果都是参与反应的物质和水分别离解成两部分,再重新组合成新的物质。
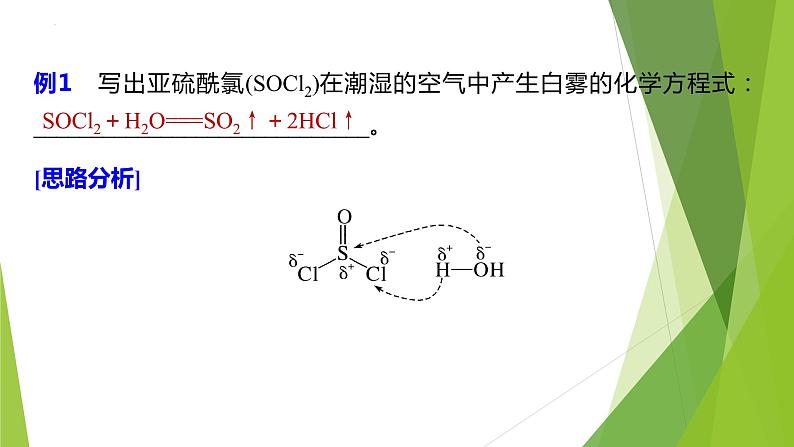
例1 写出亚硫酰氯(SOCl2)在潮湿的空气中产生白雾的化学方程式:_____________________________。
SOCl2+H2O===SO2↑+2HCl↑
例2 25 ℃,H2C2O4和HF两种酸的电离平衡常数如下:
[思路分析]判断三种酸(只看第一步电离)H2C2O4、HF、 电离出H+的能力,即酸性的强弱,运用强酸制弱酸即可写出离子方程式。
2.根据“中和”原理或“强酸制弱酸”原理书写方程式
则H2C2O4溶液和NaF溶液反应的离子方程式为__________________________。
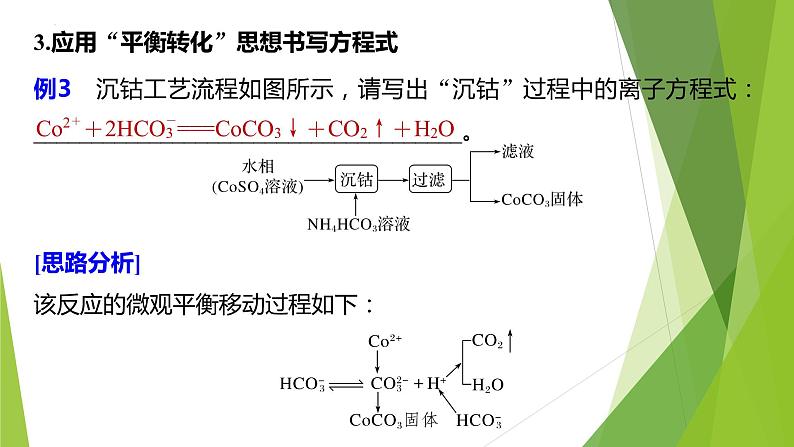
例3 沉钴工艺流程如图所示,请写出“沉钴”过程中的离子方程式:_____________________________________。
[思路分析]该反应的微观平衡移动过程如下:
3.应用“平衡转化”思想书写方程式
例4 “煅烧”偏钒酸铵(NH4VO3)可得到工业制硫酸的催化剂五氧化二钒(V2O5),写出该反应的化学方程式:_____________________________________。
[思路分析]联想铵盐的不稳定性,类比NH4HCO3的分解。
4.根据对热稳定性的理解书写方程式(类比同类物质的性质)
二、新情境下氧化还原反应方程式的书写技巧第一步:根据题干信息或流程图,判断氧化剂、还原剂、氧化产物、还原产物。第二步:按“氧化剂+还原剂―→氧化产物+还原产物”写出方程式,根据得失电子守恒对方程式进行配平。第三步:应用电荷守恒、原子守恒思想,配平未参与得失电子元素原子的守恒。
注意:离子方程式先电荷守恒,一般用H+、OH-调平电荷;补充“H+或OH-”的技巧,总的原则是酸性溶液中不能出现OH-,碱性溶液中不能出现H+,具体方法如下:
例5 含 的废水在酸性条件下能用Fe3O4处理得到含Cr3+的溶液,反应的离子方程式为____________________________________________。
[思路分析](1)根据题中信息可确定:氧化剂为 ,还原剂为Fe3O4,氧化产物为Fe3+,还原产物为Cr3+。(2)配平主物质的化学计量数:
(3)补充物质(H+和H2O)并配平。
步骤②中反应的化学方程式为__________________________________________________________________________________________________________。
CaCl2+2NH3·H2O+H2O2===CaO2↓+
2NH4Cl+2H2O(或CaCl2+2NH3·H2O+H2O2+6H2O===CaO2·8H2O↓+2NH4Cl)
2.以钛白酸废液(主要含有TiO2+、Fe2+、Ca2+、 等)为原料,获取磷酸钛(2TiO2·P2O5·H2O)的部分流程如图:反应Ⅰ中生成2TiO2·P2O5·H2O的离子方程式:________________________________________。
2TiO2++2H3PO4===2TiO2·
P2O5·H2O↓+4H+
3.黄血盐[亚铁氰化钾,K4Fe(CN)6]目前广泛用作食品添加剂(抗结剂)。 一种制备黄血盐的工艺如图: (1)步骤Ⅰ反应的化学方程式为______________________________________________________________。
+ FeSO4+ 6HCN===Ca2Fe(CN)6+
(2)步骤Ⅳ过滤所得的废液中含量较多的溶质为_______(填化学式)。(3)步骤Ⅴ的化学方程式为________________________________________。
CaSO4↓+6H2O
K2CaFe(CN)6+K2CO3===K4Fe(CN)6+CaCO3
石灰乳、FeSO4与HCN发生非氧化还原反应生成Ca2Fe(CN)6和CaSO4,过滤,除去CaSO4,步骤Ⅲ中Ca2Fe(CN)6与KCl反应生成K2CaFe(CN)6和CaCl2,故废液中含量较多的溶质为CaCl2,步骤Ⅴ中加入碳酸钾,脱钙生成K4Fe(CN)6再经过蒸发浓缩、冷却结晶,得到产品。
4.工业上利用氟碳铈矿(主要成分为CeCO3F)提取CeCl3的一种工艺流程如图。
请回答下列问题:(1)“氧化焙烧”的化学方程式为__________________________________________________。(2)“酸浸”的离子方程式为______________________________________。
4CeCO3F+O2+2Na2CO3 4CeO2
+4NaF+6CO2↑
2CeO2+6H++H2O2===2Ce3++4H2O+O2↑
5.NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如图所示:
(1)写出“反应”步骤中生成ClO2的化学方程式:__________________________________________。
2NaClO3+SO2+
H2SO4===2ClO2+2NaHSO4
结合图示可知,NaClO3与SO2在H2SO4作用下反应生成ClO2和NaHSO4。根据氧化还原反应配平的一般方法,即可顺利写出化学方程式。
(2)“尾气吸收”是吸收电解过程中排出的少量ClO2。写出此吸收反应的化学方程式:___________________________________________。
2ClO2+H2O2+2NaOH===2NaClO2+O2+2H2O
结合图示可知,尾气中的ClO2在反应中被还原为 ,则H2O2被氧化,氧化产物应为O2,即可写出化学方程式。
6.高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺流程如图:“平炉”中发生反应的化学方程式为_________________________________________。
2MnO2+4KOH +O2 2K2MnO4+
根据流程图可知,在“平炉”中MnO2、KOH、O2在加热时会反应生成K2MnO4,根据元素质量守恒可知,另外一种生成物是H2O,根据原子守恒、得失电子守恒可得发生反应的
化学方程式为2MnO2+O2+4KOH 2K2MnO4+2H2O。
7.镉(Cd)可用于制作某些光电子组件。一种以镉废渣(含CdO及少量ZnO、CuO、MnO、FeO杂质)为原料制备镉的工艺流程如图所示:
(1)溶解时,CdO参与反应的离子方程式为________________________。(2)调pH,加入石灰乳是为了除铜,写出除铜的离子方程式:___________________________________________。
CdO+2H+===Cd2++H2O
(3)“氧化”是为了除铁、除锰,KMnO4的还原产物是MnO2,该步骤中除铁、除锰的离子方程式为___________________________________________________________________________________________________。(4)置换生成海绵镉的离子方程式为______________________。(5)“熔炼”时,将海绵镉(含Cd和Zn)与NaOH溶液混合反应,反应的化学方程式是______________________________。
3Fe2+ +7H2O===3Fe(OH)3↓+MnO2↓
+5H+、3Mn2++ +2H2O===5MnO2↓+4H+
Cd2++Zn===Cd+Zn2+
相关课件
这是一份专题一 主观题突破 新情景下方程式的书写 2024年高考化学二轮复习课件+讲义,文件包含专题一主观题突破新情景下方程式的书写pptx、专题一主观题突破新情景下方程式的书写教师版docx、专题一主观题突破新情景下方程式的书写docx等3份课件配套教学资源,其中PPT共34页, 欢迎下载使用。
这是一份专题一化学用语与基本概念 主观题突破 新情景下方程式的书写课件-2024年高考化学二轮复习,共42页。PPT课件主要包含了核心精讲,书写方法,真题演练,N2↑,H2O,Fe2O3和SiO2,SiO2,Fe2SO43,+CO2↑,升高温度等等内容,欢迎下载使用。
这是一份新高考版高考化学二轮复习(新高考版) 第1部分 专题突破 专题5 题型专攻1 “陌生情景下”方程式的书写课件PPT,共30页。PPT课件主要包含了高考化学二轮复习策略,专题5,高考必备,书写方法,真题演练,CO2+8H2O,Na2CO3,考向预测,+2H2O,S↓+2H+等内容,欢迎下载使用。












