


2023届高三化学二轮专题复习 原理综合大题突破2 陌生电化学装置中电极方程式的书写课件
展开1.书写反应式主要包括电极反应和电池反应。2.书写反应式的技巧(与氧化还原反应方程式基本一致)(1)审题干及装置图,明确是原电池还是电解池;审要求,明确写哪个电极上的反应,是写电极反应还是电池反应。(2)仔细研究装置图中的物质变化或微粒变化,确定反应物和产物。(3)分析反应方向及化合价变化,根据得失电子守恒、电荷守恒、元素守恒以及电解质的酸碱性等,配平电极反应式。特别提醒 非水介质配平电极反应两端电荷时,不能用H+或OH-。
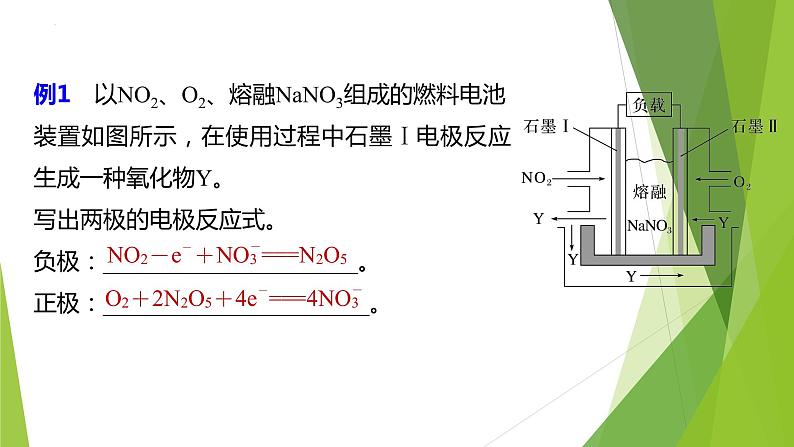
例1 以NO2、O2、熔融NaNO3组成的燃料电池装置如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y。写出两极的电极反应式。负极:______________________。正极:_______________________。
[思路分析](1)负极反应式的书写方法①配升降:根据信息,负极反应物为NO2(N为+4价),失去电子,化合价升高,得到对应的产物为Y,题目中Y为氧化物,结合氮元素最高化合价为+5价,可推断Y为N2O5,则对应物质关系:2NO2-2e-―→N2O5。
(2)正极反应式的书写方法(书写方法与负极反应式一致)。
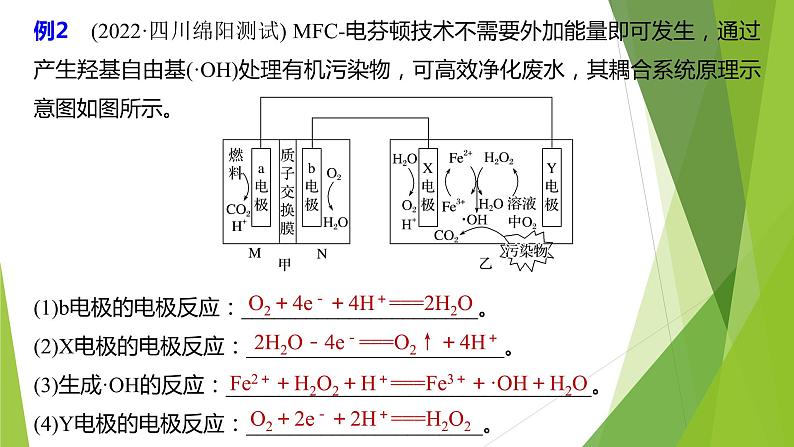
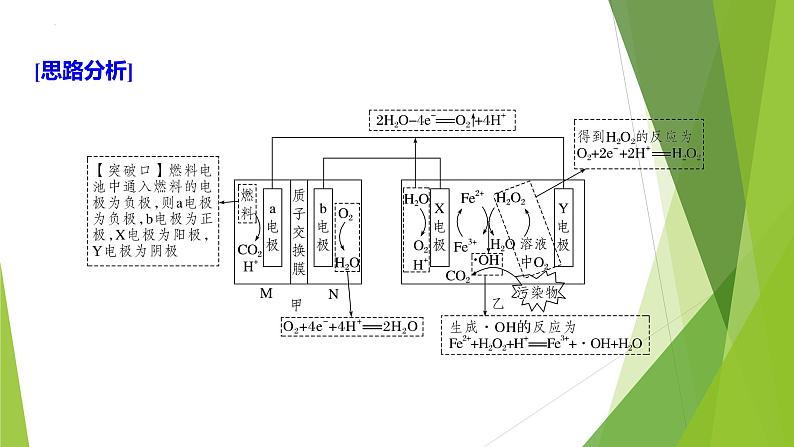
例2 (2022·四川绵阳测试) MFC-电芬顿技术不需要外加能量即可发生,通过产生羟基自由基(·OH)处理有机污染物,可高效净化废水,其耦合系统原理示意图如图所示。
(1)b电极的电极反应:______________________。(2)X电极的电极反应:________________________。(3)生成·OH的反应:__________________________________。(4)Y电极的电极反应:______________________。
O2+4e-+4H+===2H2O
2H2O-4e-===O2↑+4H+
Fe2++H2O2+H+===Fe3++·OH+H2O
O2+2e-+2H+===H2O2
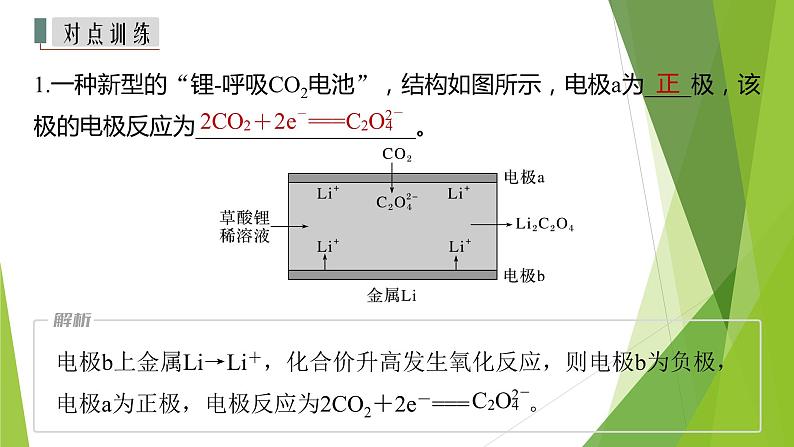
1.一种新型的“锂-呼吸CO2电池”,结构如图所示,电极a为____极,该极的电极反应为___________________。
电极b上金属Li→Li+,化合价升高发生氧化反应,则电极b为负极,电极a为正极,电极反应为2CO2+2e-=== 。
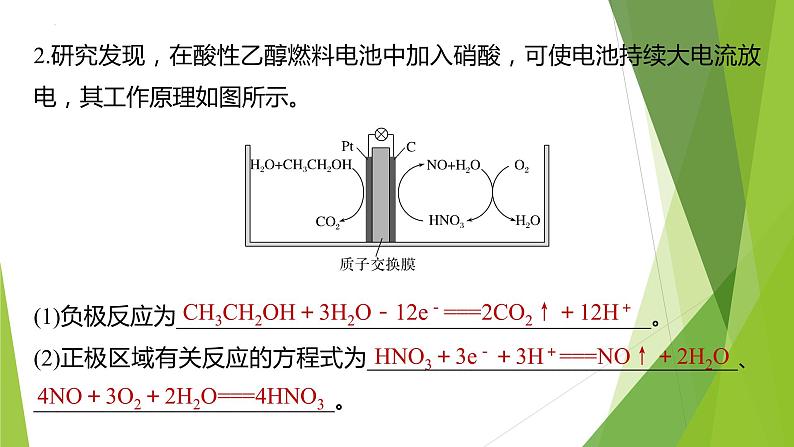
2.研究发现,在酸性乙醇燃料电池中加入硝酸,可使电池持续大电流放电,其工作原理如图所示。
(1)负极反应为_________________________________________。(2)正极区域有关反应的方程式为________________________________、__________________________。
CH3CH2OH+3H2O-12e-===2CO2↑+12H+
HNO3+3e-+3H+===NO↑+2H2O
4NO+3O2+2H2O===4HNO3
3.以铬酸钠(Na2CrO4)为原料,用电化学法可制备重铬酸钠(Na2Cr2O7),实验装置如图所示(已知: )。
(1)阳极的电极反应式为______________________________________________________。
2H2O-4e-===O2↑+4H+(或4OH--4e-===O2↑
阳极发生氧化反应,水中的氢氧根离子放电,电极反应式为2H2O-4e-===O2↑+4H+或4OH--4e-===O2↑+2H2O。
(2)电解一段时间后,测得阳极区溶液中Na+物质的量由a ml变为b ml,则生成重铬酸钠的物质的量为________ml。
4.电解精炼法提纯镓是工业上常用的方法。具体原理如图所示:
已知:镓化学性质与铝相似。(1)M为电源的____极,电解过程中阳极产生的离子迁移到达阴极并在阴极析出高纯镓。请写出电解过程中阴极的电极反应:___________________________________。
+3e-===Ga+4OH-
电解精炼法提纯镓,粗镓作阳极,高纯镓作阴极,则M为负极,N为正极;电解过程中阳极产生的离子迁移到达阴极并在阴极析出高纯镓。
(2)电解过程中需控制合适的电压,电压太高会导致阴极电解效率下降,其可能的原因是_______________________________________________。若外电路通过0.25 ml e-时,阴极得到3.5 g的镓。则该电解装置的电解效率η=_______(η= )。
氢离子在阴极得到电子转化成氢气导致电解效率降低
5.华盛顿大学的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示:上述电解反应在温度小于900 ℃时进行碳酸钙分解为CaO和CO2的反应,电解质为熔融碳酸钠,阳极的电极反应式为 -4e-===2CO2↑
+O2↑,则阴极的电极反应式为______________________。
根据图中信息阳极是熔融盐中的碳酸根离子得到电子生成氧气和二氧化碳,因此阳极的电极反应式为 -4e-===2CO2↑+O2↑,阴极是二氧化碳得到电子变为碳和碳酸根离子。
6.电解法可实现CO2资源化利用,电解CO2制HCOOH的原理示意图如图所示:(1)a、b表示CO2进气管,其中______(填“a”或“b”)管是不需要的。
根据电解CO2制HCOOH,说明二氧化碳中碳元素化合价降低,得到电子发生还原反应,即在电解池阴极,即b极通入二氧化碳气体,因此其中a管是不需要的。
(2)写出阴极的电极反应式:______________________________________________________________。
专题四 主观题突破 电极反应式书写及电化学计算 2024年高考化学二轮复习课件+讲义: 这是一份专题四 主观题突破 电极反应式书写及电化学计算 2024年高考化学二轮复习课件+讲义,文件包含专题四主观题突破电极反应式书写及电化学计算pptx、专题四主观题突破电极反应式书写及电化学计算教师版docx、专题四主观题突破电极反应式书写及电化学计算docx等3份课件配套教学资源,其中PPT共23页, 欢迎下载使用。
专题四 电化学 主观题突破 电极反应式书写及电化学计算课件-2024年高考化学二轮复习: 这是一份专题四 电化学 主观题突破 电极反应式书写及电化学计算课件-2024年高考化学二轮复习,共29页。PPT课件主要包含了真题演练,HCOO-+,H2SO4,从右往左,N2+6H2O,Na+,考向预测,×104mol,提高了电流效,O2和较浓的硫酸等内容,欢迎下载使用。
2024届高三化学第二轮复习: 陌生方程式的书写课件: 这是一份2024届高三化学第二轮复习: 陌生方程式的书写课件,共27页。PPT课件主要包含了高考考查题型及知识点,考察题型以及知识点,主要考查类型,基本解题思路等内容,欢迎下载使用。












