

江西省宜春市铜鼓县中2022-2023学年高二下学期第一次段考化学试卷(含答案)
展开
这是一份江西省宜春市铜鼓县中2022-2023学年高二下学期第一次段考化学试卷(含答案),共11页。试卷主要包含了 下列符号表征或说法正确的是等内容,欢迎下载使用。
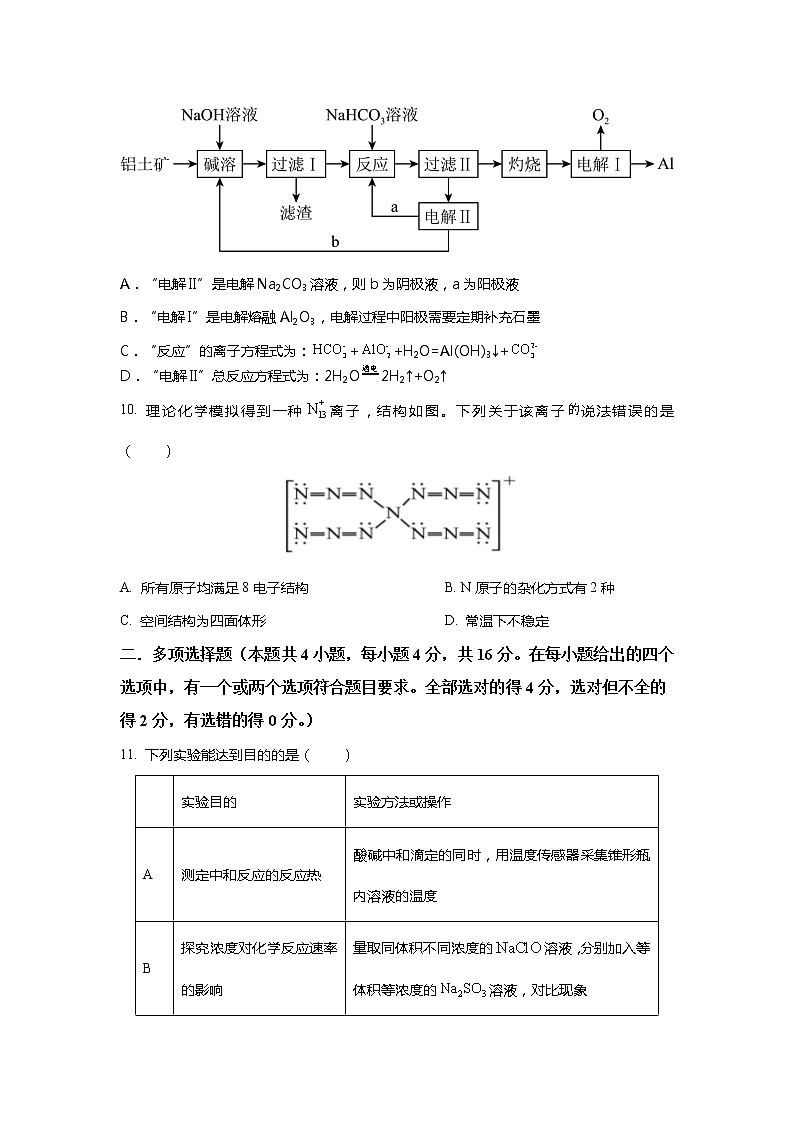
铜鼓县中2022-2023学年高二下学期第一次段考化学试题可能用到的相对原子质量:H:1 C:12 O:16 Na:23 S:32一.选择题(本题包括10小题,每小题只有一个选项符合题意,每小题3分,共30分。)1. 下列符号表征或说法正确的是( )A 电离:H2S=HS- + H+ B. 位于元素周期表p区C. 空间结构:平面三角形 D. 电子式:2. 为阿伏加德罗常数的值,下列说法正确的是( )A. 中含有个阳离子B. 分子中含有的键数目为C. 含有中子数D. 和于密闭容器中充分反应后,分子总数为3.已知某原子的结构示意图为,下列有关说法正确的是( )。A.结构示意图中x=4B.该原子的电子排布式为1s22s22p63s23p4C.该原子的轨道表示式为D.该原子结构中共有5个能级上填充电子4.下列说法正确的是( )。A.在100℃时,约为6的纯水呈酸性B.常温下,将盐酸稀释至,所得溶液的约为9C.常温下,当水电离出的为时,此溶液的可能为2或12D.常温下,将的盐酸和醋酸各分别稀释至,所得醋酸的略大5. 短周期元素X、Y、Z、W、Q原子序数依次增大。基态X、Z、Q原子均有两个单电子,W简单离子在同周期离子中半径最小,Q与Z同主族。下列说法错误的是( )A. X能与多种元素形成含有极性键的非极性分子 B. 简单氢化物沸点:C. 第一电离能: D. 电负性:6. 时,苯酚的,CH3COOH的ka=1.8X10-5下列说法正确的是( )A. 相同温度下,等的和溶液中,B. 将浓度均为的和溶液加热,两种溶液的均变大C. 时,溶液与溶液混合,测得,则此时溶液中D. 时,的溶液中加少量固体,水的电离程度变小7.下表列出了某短周期元素R的各级电离能数据(用、……表示,单位为)。关于元素R的下列判断中,错误的是( )。 ……R7401500770010500……A.R元素基态原子的电子排布式为B.R元素位于元素周期表中第ⅡA族C.R元素的最高正化合价为价D.R元素第一电离能高于同周期相邻元素8.美国化学家鲍林教授具有独特的化学想象力:只要给他物质的分子式,他就能大体上想象出这种物质的分子结构模型。多核离子所带电荷可以认为是中心原子得失电子所致,根据VSEPR模型,下列离子中所有原子都在同一平面上的一组是( )。A.和 B.和C.和 D.和9.铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,还含有SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下,SiO2在“碱溶”时转化为铝硅酸盐沉淀,下列说法错误的是( )A.“电解II”是电解Na2CO3溶液,则b为阴极液,a为阳极液B.“电解I”是电解熔融Al2O3,电解过程中阳极需要定期补充石墨C.“反应”的离子方程式为:++H2O=Al(OH)3↓+D.“电解II”总反应方程式为:2H2O2H2↑+O2↑10. 理论化学模拟得到一种离子,结构如图。下列关于该离子说法错误的是( )A. 所有原子均满足8电子结构 B. N原子的杂化方式有2种C. 空间结构为四面体形 D. 常温下不稳定二.多项选择题(本题共4小题,每小题4分,共16分。在每小题给出的四个选项中,有一个或两个选项符合题目要求。全部选对的得4分,选对但不全的得2分,有选错的得0分。)11. 下列实验能达到目的的是( ) 实验目的实验方法或操作A测定中和反应的反应热酸碱中和滴定的同时,用温度传感器采集锥形瓶内溶液的温度B探究浓度对化学反应速率的影响量取同体积不同浓度的溶液,分别加入等体积等浓度的溶液,对比现象C判断反应后是否沉淀完全将溶液与溶液混合,反应后静置,向上层清液中再加数滴溶液D检验淀粉是否发生了水解向淀粉水解液中加入碘水12. 常温下,向的NaA溶液中通入HF(g),溶液中(X代表A或F)的值和pH的关系如图所示,已知酸性:,忽略溶液体积的变化,下列叙述错误的是( )A. HA的电离常数B. 当时,混合溶液C. 通入0.01molHF时,D. 随着HF的通入,溶液导电性先增大后减小13.顺铂[Pt(NH3)2Cl2](Ⅰ)是具有抗癌活性的金属配合物;碳铂是1,1-环丁二羧酸二氨合铂(Ⅱ)的简称,属于第二代铂族抗癌药物,其毒副作用低于顺铂。下列说法正确的是( )。(已知1,1-环丁二羧酸的结构简式为) (Ⅰ) (Ⅱ)A.碳铂中所有碳原子在同一平面上B.顺铂分子中氮原子的杂化方式是sp2C.碳铂分子中sp3杂化的碳原子数与sp2杂化的碳原子数之比为2∶1D.1 mol 1,1-环丁二羧酸含有σ键的数目为12NA(设NA为阿伏加德罗常数的值) 14.已知某有机化合物A的红外光谱如图所示,下列说法中不正确的是( )。未知物A的红外光谱A.由红外光谱可知,该有机化合物分子中至少有三种不同的化学键B.由红外光谱可知,分子中碳原子一定有sp2、sp3两种杂化方式C.仅由红外光谱无法得知其相对分子质量D.若A的结构简式为,则1个分子中有10个σ键三.非选择题:本题共4大题,共54分。15.(14分)短周期主族元素X、Y、Z、R、W的原子序数逐渐增大,X原子的P轨道半充满,且X、Y、Z同周期,Y与R的价电子数相同。(1)在化合物中中心原子的VSEPR模型为_______________,X与Y的离子半径由小到大的顺序为_______________。(2)基态X原子的价层电子排布式为_______________________,X的一氢化物是一种火箭燃料的成分,分子中X原子轨道的杂化类型是__________,NH3分子中的N原子有一个孤电子对,能发生反应:NH3 +HCl=NH4Cl,试写出将上述液态氮氢化合物加入少量盐酸中时,发生反应的化学方程式:_____________________________________。(3)R、W两元素电负性较强的是(写元素符号)__________;写出证明这一结论的一个实验事实(用化学方程式表示):_____________________________________________。16.(12分) 某工厂采用辉铋矿(主要成分为,含有、杂质)与软锰矿(主要成分为)联合焙烧法制备和,工艺流程如下:已知:①焙烧时过量的分解为,转变为;②金属活动性:;③相关金属离子形成氢氧化物的范围如下: 开始沉淀完全沉淀6.58.31.62.88.110.1 回答下列问题:(1)为提高培烧效率,可采取的措施为___________。a.进一步粉碎矿石 b.鼓入适当过量的空气 c.降低焙烧温度(2)在空气中单独焙烧生成,反应的化学方程式为______________________ 。(3)“酸浸”中过量浓盐酸的作用为:①充分浸出和;②_______________________________。(4)滤渣的主要成分为___________(填化学式)。(5)生成气体A的离子方程式为___________________________________。(6)加入金属的目的是_______________________________。17.(12分)碳、硫和钒的相关化合物在药物化学及催化化学等领域应用广泛。回答下列问题:(1)基态钒原子核外电子排布式为 。 (2)VO43-的中心原子上的孤电子对数为 ,一个VO43-中含有 个σ键。 (3)2-巯基烟酸氧钒配合物(如图1)是副作用小且能有效调节血糖的新型药物。图1 ① 该药物中N原子的杂化方式是 。 ②已知:多原子分子中,若原子都在同一平面上且这些原子有相互平行的p轨道,则p电子可在多个原子间运动,形成大π键。大π键可用表示,其中m、n分别代表参与形成大π键的原子个数和电子数,如苯分子中的大π键表示为。下列粒子中存在大π键的是 (填字母)。 A.O3 B.S C.H2S D.N③CS2分子中大π键可以表示为 。 (4)偏钒酸铵加热分解生成五氧化二钒、氨、水。偏钒酸铵的阴离子呈如图2所示的无限链状结构,则偏钒酸铵的化学式为 。 图218. (16分)I.失水后可转为,与可联合制备铁粉精和。结构如图所示。(1)价层电子排布式为___________。(2)比较和分子中的键角大小并给出相应解释:________________________。(3)晶体中和之间的作用分别为___________。 II.KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。(1)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为__________,其中P采取________杂化方式。(2)与PO电子总数相同的等电子体(具有相同价电子数或电子数和相同原子数的分子或离子之间的互称)的分子式为__________________。(3)磷酸通过分子间脱水缩合形成多磷酸,如:如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为__________。(4)图甲表示碳、硅和磷元素的四级电离能变化趋势,其中表示磷元素的曲线是 (填序号)。 甲 铜鼓县中2022-2023学年高二下学期第一次段考化学参考答案12345678910CCDCBCACDB11121314 CCDCBD 15.(14分,每空2分)(1)四面体形 O2- < N3-(2) N2H4+HCl=N2H5Cl(3) 16. (12分,每空2分)(1)ab (2) (3)抑制金属离子水解 (4) (5) (6)将转化为17、(12分,除标注外每空2分)(1)1S22S22P63S23P63d34S2 (2)0 4(每空一分)(3)①sp2 ②AD ③ (4)NH4VO318.(16分,每空2分)(1)3d6 (2)键角:SO42- >H2O 原因:SO42- 和H2O的中心原子均采用SP3杂化,SO42- z中无孤电子对,H2O中有两对孤电子对,孤电子对对成键电子对的排斥力更大,使键角变小(3)氢键(2) sp3 (2)SiF4、SO2F2等 (3)PnO(4)b
相关试卷
这是一份江西省宜春市宜丰中学2022-2023学年高二下学期开学考试化学试卷(含答案),共23页。试卷主要包含了单选题,多选题,填空题等内容,欢迎下载使用。
这是一份江西省宜春市丰城市第九中学2022-2023学年高二下学期开学质量检测化学试卷(含答案),共18页。试卷主要包含了填空题等内容,欢迎下载使用。
这是一份江西省宜春市2022-2023学年高二下学期期末考试化学试卷(PDF版含答案),文件包含江西省宜春市2022-2023学年高二下学期期末考试化学试卷pdf、化学答案pdf等2份试卷配套教学资源,其中试卷共9页, 欢迎下载使用。








