
所属成套资源:2021-2022学年高中化学高一(下)月考化学试卷(含答案解析)真题合集
2021-2022学年湖北省宜昌一中、龙泉中学、荆州中学三校高一(下)段考化学试卷(3月份)(含答案解析)
展开
这是一份2021-2022学年湖北省宜昌一中、龙泉中学、荆州中学三校高一(下)段考化学试卷(3月份)(含答案解析),共18页。试卷主要包含了 下列叙述中正确的个数为等内容,欢迎下载使用。
2021-2022学年湖北省宜昌一中、龙泉中学、荆州中学三校高一(下)段考化学试卷(3月份)
1. 我国清代《本草纲目拾遗》中记叙无机药物335种,其中“强水”条目下写道:“性最烈,能蚀五金⋯其水甚强,五金八石皆能穿第,惟玻璃可盛。”这里的“强水”是指( )
A. 氨水 B. 硝酸 C. 醋 D. 卤水
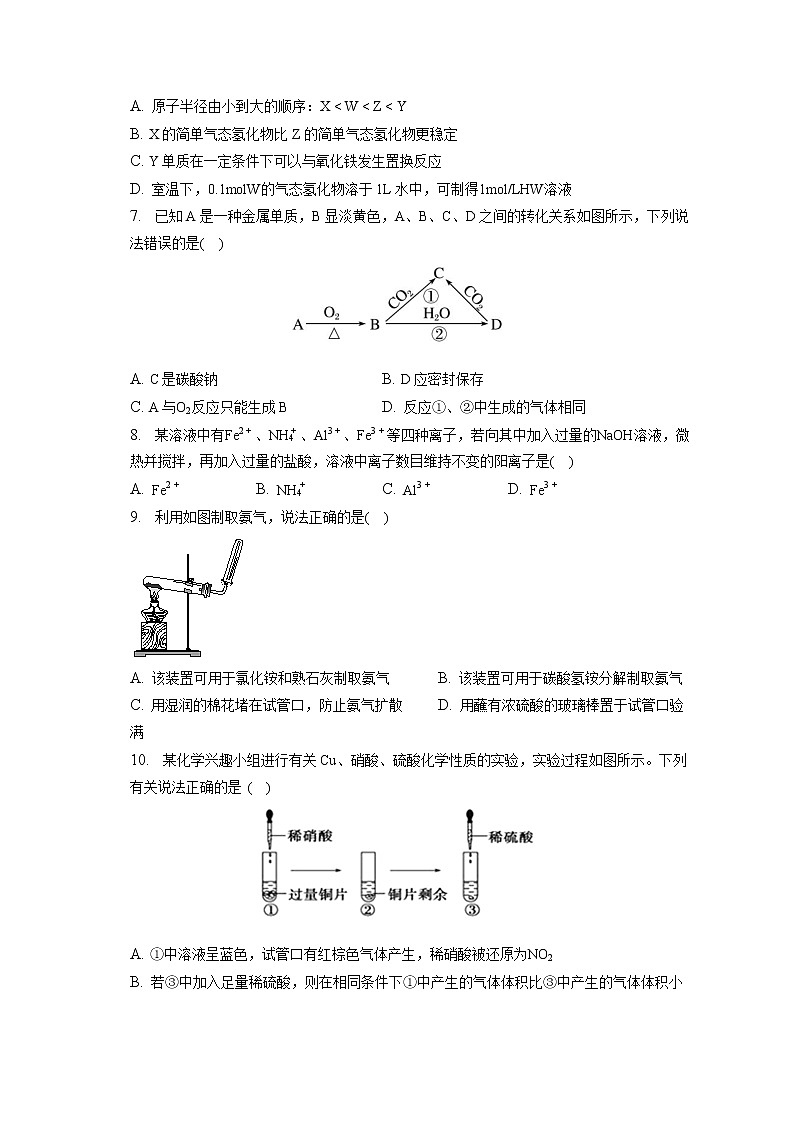
2. 硫和氮及其化合物对人类生存和社会发展意义重大,但硫氧化物和氮氧化物造成的环境问题也日益受到关注,下列说法正确的是( )
A. 汽车尾气中NO,主要来源于汽油、柴油的燃烧
B. 二氧化硫不仅可以漂白纸浆,还能杀菌消毒
C. 植物直接吸收利用空气中的NO和NO2作为肥料,实现氮的固定
D. 工业废气中的SO2和CO2均可采用石灰法进行脱除
3. 1869年俄国化学家门捷列夫制作出了第一张元素周期表,揭示了化学元素间的内在联系,成为化学发展史上重要里程碑之一。下列有关元素周期表的说法正确的是( )
A. 元素周期表有7个横行、18个纵行,即有7个周期、18个族
B. 在过渡元素中寻找半导体材料
C. 俄罗斯专家首次合成了178116X原子,116号元素位于元素周期表中第7周期VIA族
D. IA族的元素全部是金属元素
4. 欲区分两瓶无标签的稀硫酸和浓硫酸,现有铝片、白纸、蓝色石蕊试纸、胆矾晶体、铜片,常温下只用一种试剂就能区分的有多少种( )
A. 2种 B. 3种 C. 4种 D. 5种
5. 下列叙述中正确的个数为( )
①向某溶液中滴加NaOH溶液,没有产生使湿润的红色石蕊试纸变蓝的气体,则原溶液中一定没有NH4+
②硝酸见光分解,所以硝酸一般盛放在棕色试剂瓶中
③CO、NO、NO2都是大气污染气体,在空气中均能稳定存在
④常温下,可用铁制容器盛装浓硝酸,这是因为铁在常温下与浓硝酸不反应
⑤浓硫酸与蔗糖反应时,蔗糖变黑膨胀,体现浓硫酸的吸水性和强氧化性
⑥可以用CS2清洗残留硫粉的试管
A. 5个 B. 4个 C. 3个 D. 2个
6. X、Y、Z、W是分别位于第2、3周期的元素,原子序数依次递增。X与Z位于同一主族,Y元素的单质既能与盐酸反应也能与NaOH溶液反应,Z原子的最外层电子数是次外层电子数的一半,Y、Z、W原子的最外层电子数之和为14。下列说法错误的是( )
A. 原子半径由小到大的顺序:Xh1 B. h4>h1>h3>h2
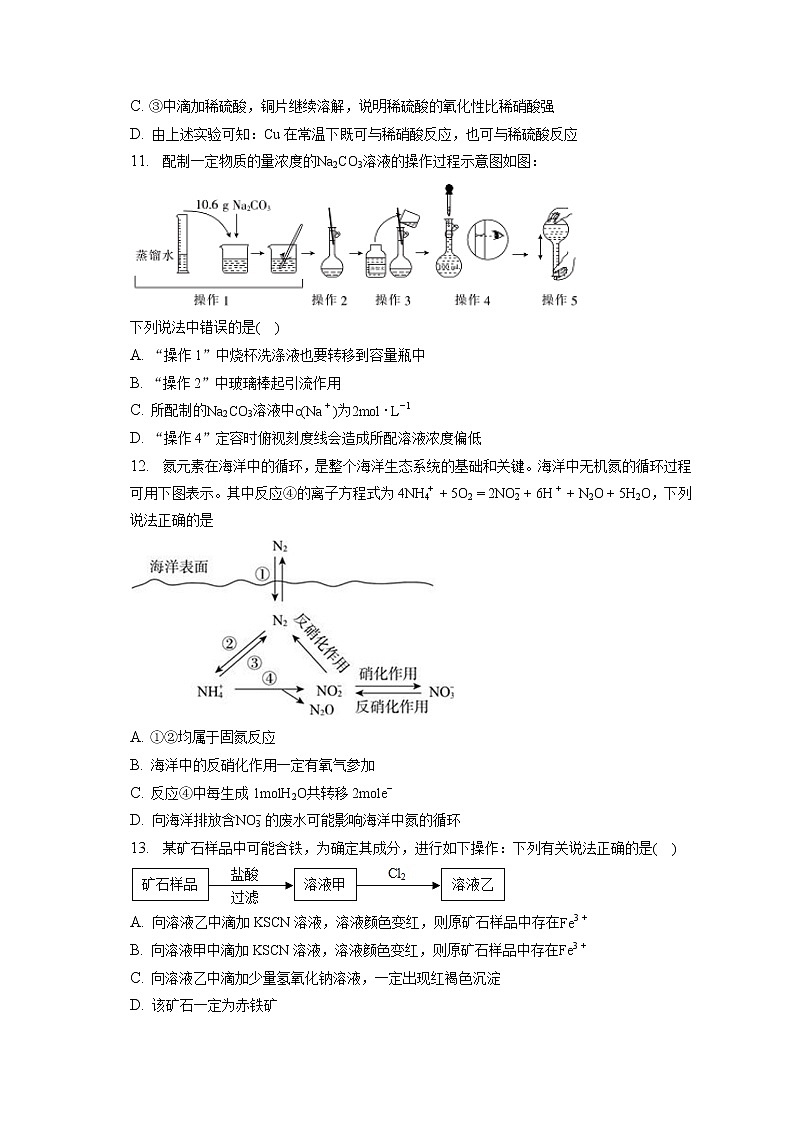
C. h2>h1>h3>h4 D. h3>h2>h1>h4
16. 氮元素的单质和常见化合物在工、农业生产中用途广泛。
(1)氮气的化学性质很稳定,可用作灯泡填充气。
从分子结构角度解释其原因是 ______。
(2)N2O是硝酸生产中氨催化氧化的副产物,用特种催化剂能使N2O分解。
NH3与O2在加热和催化剂作用下生成N2O的化学方程式 ______。
(3)NO和NO2可用NaOH溶液吸收主要反应为:
NO+NO2+2OH−=2NO2−+H2O
2OH−+2NO2=NO2−+NO3−+H2O
①下列措施可能提高尾气中NO和NO2去除率的有 ______(填字母)
A.加快通入尾气的速率.
B.采用气,液逆流的方式吸收尾气
C.吸收尾气过程中定期补加适量NaOH溶液
D.在尾气中同时通入氧气
②吸收后的溶液经浓缩,结晶,过滤,得到NaNO2晶体,该晶体的主要杂质 ______(填化学式)。
(4)铵盐大多在农业上用作化肥,实验室可用固体NH4Cl与固体Ca(OH)2加热反应来制备氨气,其化学方程式为 ______。欲吸收尾气中的NH3,下列装置不宜选用 ______填字母)。(已知氨气难溶于有机溶剂CCl4)
17. 近两年来无人驾驶汽车的大热使得激光雷达成为人们关注的焦点,激光雷达的核心部件需要一种氮化铝(AlN)导热陶瓷片。如图是从铝土矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程如图1:
(1)“溶解”时,已知溶液中的硅酸钠与偏铝酸钠可发生反应:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH。赤泥的主要成分除了生成的Na2Al2Si2O8还有 ______(写出化学式)
(2)“酸化”时通入CO2与NaAlO2反应生成Al(OH)3,写出该反应的离子方程式 ______。实验室过滤需用到的玻璃仪器有烧杯、______、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为 ______。
(4)某课题小组利用甲图所示装置测定样品中AlN的含量(杂质不反应)。已知:AlN+NaOH+H2O=NaAlO2+NH3↑。分液漏斗上方所连导气管的作用有 ______、______。反应完毕,应先 ______,再 ______,最后平视液面,记录b的读数。
(5)现取氮化铝样品5.0g(假设杂质只含有炭黑)加到100mL1.0mol/L的NaOH溶液中恰好反应完,则该样品中AlN的质量分数为 ______。
18. 实验室用Na2SO3和70%硫酸溶液反应制取SO2,某研究性学习小组设计如图实验,制取并探究SO2的性质。
(1)丁装置的作用是 ______。
(2)实验中若生成标准状况1.12LSO2,则至少需要 ______gNa2SO3。
(3)①若X是品红溶液,气体通过乙装置,观察到的现象是 ______。
②若X是酸性KMnO4溶液,气体通过乙装置,观察到溶液褪色,说明SO2具有 ______。
A.酸性
B.还原性
C.漂白性
③若X是FeCl3和BaCl2的混合溶液,气体通过乙装置,观察到溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生,白色沉淀化学式为 ______。
(4)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,A、B两位同学的连接方式为:
A同学:SO2气体从a导管通入集气瓶中。
B同学:SO2气体从b导管通入集气瓶中。
正确的收集装置是 ______(填“A”或“B”)同学的连接方式。
(5)若X是氢硫酸,气体通过乙装置,观察到的现象是 ______,发生的化学方程式为 ______。
19. 硫酸亚铁铵晶体[(NH4)2Fe(SO4)2⋅6H2O]俗称摩尔盐,用途十分广泛。实验室通常用如图所示装置制备FeSO4溶液后,再与等物质的量的(NH4)2SO4反应制备摩尔盐。
已知:硫酸亚铁铵晶体在空气中不易被氧化,易溶于水,不溶于乙醇。
(1)制备FeSO4
①用图示装置制备FeSO4。仪器a的名称是 ______。该实验不用明火加热的原因是 ______。将0.7g铁粉加入锥形瓶中,放入15mL1mol/LH2SO4溶液,保持温度在50∘C∼60∘C之间反应,待无明显气泡产生后停止加热,趁热过滤。
②如果加入的铁粉不纯,反应过程中会产生少量H2S、PH3气体。用CuSO4溶液吸收PH3时会生成H3PO4和Cu。
写出CuSO4溶液吸收PH3的化学方程式 ______。
(2)制备摩尔盐
①向滤液中加入适量(NH4)2SO4饱和溶液,70C∼80℃水浴加热,保持溶液pH为1∼2,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果用玻璃棒搅拌,可能导致溶液变黄,其原因是 ______。选用乙醇洗涤晶体的目的是 ______。
②过滤出产品的母液中,可以大量共存的离子有 ______(填序号)
A.NO3−
B.A13+
C.SO32−
D.AlO2−
E.Ba2+
F.Cu2+
答案和解析
1.【答案】B
【解析】
【分析】
本题考查元素化合物知识,为高频考点,明确物质的性质是解本题关键,知道硝酸的强氧化性,题目难度不大。“强水”“性最烈,能蚀五金…其水甚强,五金八石皆能穿第,惟玻璃可盛。”说明“强水”腐蚀性很强,能腐蚀多数金属及岩石,但不能腐蚀玻璃,即和玻璃中成分不反应,据此分析解答。
【解答】
A.氨水属于弱碱,和金属不反应,不符合条件,故A错误;
B.硝酸具有强氧化性、强酸性,能腐蚀大多数金属,也能和岩石中的CaCO3发生反应,但不能和玻璃反应,所以符合条件,故B正确;
C.醋酸是弱电解质,能腐蚀较活泼金属,但不能腐蚀较不活泼金属,如Cu等金属,不符合条件,故C错误;
D.卤水其主要成分为氯化镁、氯化钠和一些金属阳离子,和大多数金属不反应,不符合条件,故D错误;
故选:B。
2.【答案】B
【解析】解:A.汽车尾气中NO,主要来源于汽车气缸中氮气和氧气在高温下反应生成的,与汽油、柴油的燃烧无关,故A错误;
B.二氧化硫具有漂白性和弱氧化性,不仅可以漂白纸浆,也能杀菌消毒,故B正确;
C.植物直接吸收利用的是铵盐和硝酸盐可作为肥料,不能吸收空气中的NO和NO2,氮的固定为氮气转化为含氮化合物的过程,故C错误;
D.生石灰的主要成分是CaO,能与SO2反应生成CaSO3,再被氧化为硫酸钙,则工业废气中的SO2可采用石灰法进行脱除,但CO2不可采用石灰法进行脱除,故D错误;
故选:B。
A.汽车尾气中NO主要来源于汽车气缸中氮气和氧气在高温下反应生成的;
B.二氧化硫具有漂白性和弱氧化性;
C.植物直接吸收利用的是铵盐和硝酸盐可作为肥料;
D.CO2不可采用石灰法进行脱除。
本题主要考查氮的氧化物、SO2的性质,同时考查氮的固定的概念等,属于基本知识的考查,难度不大。
3.【答案】C
【解析】解:A.元素周期表有7个横行,即有7个周期,有18个纵行,即有7个主族、7个副族、1个零族、1个第VIII族(为8、9、10三列),共有16个族,故A错误;
B.在金属与非金属交界处寻找半导体材料,在过渡元素寻找耐腐蚀、耐高温及新型催化剂材料,故B错误;
C.X元素的原子序数为116,稀有气体第七周期元素原子序数为118号元素,二者同周期且X处于第16列,即116号元素位于元素周期表中第7周期VIA族,故C正确;
D.IA族包括H元素与碱金属元素,碱金属元素全部是金属元素,H是非金属元素,故D错误。
故选:C。
A.周期表有18列,但有16个族;
B.金属与非金属交界处的元素具有一定的金属性与非金属性;
C.X元素的原子序数为116,稀有气体第七周期元素原子序数为118号元素,故X处于第七周期第16列;
D.IA族包括H元素与碱金属元素。
本题考查元素周期表的结构及应用,把握周期表的横行、纵列与周期、族的关系,注意短周期为1、2、3周期,掌握利用原子序数确定元素在周期表中位置方法。
4.【答案】C
【解析】解:铝片与稀硫酸反应生成气体,浓硫酸与Al发生钝化,可鉴别;
浓硫酸可使白纸变黑,稀硫酸不能,可鉴别;
浓硫酸可使蓝色石蕊试纸先变红后脱水变成黑色,稀硫酸使其变红,可鉴别;
浓硫酸可使胆矾晶体变为白色,稀硫酸不能使胆矾变白色,可鉴别;
常温下铜片与稀硫酸、浓硫酸均不反应,不能鉴别;
根据分析可知,常温下只用一种试剂就能区分的有4种,
故选:C。
浓硫酸具有脱水性、强氧化性,常压下使铝发生钝化现象,但Cu与浓硫酸反应需要加热,Cu与稀硫酸不反应,以此来解答。
本题考查物质的鉴别,为高频考点,把握物质的性质、反应与现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大。
5.【答案】D
【解析】解:①稀的氢氧化钠溶液与铵根离子反应生成一水合氨,没有加热时不产生氨气,故①错误;
②硝酸在光照条件下分解成二氧化氮、水、氧气,所以硝酸一般盛放在棕色试剂瓶中,故②正确;
③NO和O2迅速反应生成NO2,在空气中不能稳定存在,CO、NO2 在空气中均能稳定存在,故③错误;
④常温下,可以用铁制容器盛装浓硝酸,是因为浓硝酸将铁氧化而“钝化”,故④错误;
⑤蔗糖属于有机物,浓硫酸有脱水性,使蔗糖脱水变为碳(变黑),同时放热,浓硫酸将碳氧化为二氧化碳,因此会膨胀,体现了浓硫酸的脱水性、强氧化性,故⑤错误;
⑥S易溶于CS2,因此可以用CS2清洗残留硫粉的试管,故⑥正确;
综上所述:正确的是②⑥,
故选:D。
①一水合氨受热分解;
②见光易分解的物质一般盛放在棕色试剂瓶中;
③NO和O2迅速反应生成NO2;
④“钝化”属于化学变化;
⑤浓硫酸可以使蔗糖碳化脱水;
⑥S易溶于CS2。
本题主要考查铵根离子的检验,同时考查硝酸的不稳定性,NO、浓硫酸、蔗糖、S的化学性质,属于高频考点,需要学生的积累,难度不大。
6.【答案】D
【解析】解:根据分析可知,X为C,Y为Al,Z为Si,W为Cl元素,
A.主族元素同周期从左到右元素的原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径由小到大的顺序为:Ch2,
故选:B。
①根据反应4NO2+O2+2H2O=4HNO3可知,剩余氧气的量为气体总量的38,则水面上升的高度为气体总体积的58;
②根据反应3NO2+H2O=2HNO3+NO,剩余气体的量为气体总量的23,则水面上升的高度为气体总体积的13;
③HCl气体完全溶于水,N2不溶于水,剩余气体的量为气体总量的一半,则水面上升的高度为气体总体积的一半;
④根据反应Cl2+SO2+2H2O=2HCl+H2SO4可知,Cl2和SO2恰好反应,剩余气体的量为0,则液体充满试管,
据此分析作答即可。
本题主要考查氮的氧化物与水反应、Cl2与SO2与水反应的有关计算,掌握反应原理是解决本题的关键,对学生的思维能力要求较高,难度中等。
16.【答案】氮分子内两个氮原子间以共价三键结合,断开该化合键需要较多的能量 2NH3+2O2−催化剂△N2O+3H2OBCDNaNO3 2NH4Cl+Ca(OH)2−△CaCl2+2H2O+2NH3↑B
【解析】解:(1)由于氮分子内两个氮原子间以共价三键结合,断开该化合键需要较多的能量,所以氮气化学性质稳定,可用作灯泡填充气,
故答案为:氮分子内两个氮原子间以共价三键结合,断开该化合键需要较多的能量;
(2)NH3与O2在加热和催化剂作用下生成N2O,同时生成水,反应方程式为2NH3+2O2 −催化剂△N2O+3H2O,
故答案为:2NH3+2O2 −催化剂△N2O+3H2O;
(3)①A.加快通入尾气的速率,尾气和溶液接触时间缩短,尾气不能和溶液充分反应,去除率降低,故A错误;
B.采用气、液逆流的方式吸收尾气,可增长尾气和溶液接触面积,使其充分反应,提高去除率,故B正确;
C.尾气吸收过程中定期补加适量NaOH溶液,使NaOH浓度增大,相同时间内吸收尾气的量增多,去除率提高,故C正确;
D.在溶液中氧气将氮的氧化物氧化为硝酸,可能提高尾气中NO和NO2去除率,故D正确,
故答案为:BCD;
②吸收后的溶液经浓缩,结晶,过滤,得到NaNO2晶体,由于亚硝酸钠易被氧化生成硝酸钠,故该晶体的主要杂质为NaNO3,
故答案为:NaNO3;
(4)NH4Cl与固体Ca(OH)2加热反应生成氯化钙、氨气和水,反应方程式为2NH4Cl+Ca(OH)2 −△CaCl2+2H2O+2NH3↑;氨气极易溶于水,需要防止倒吸,A、D装置液面上部容器容积比较大,可以起防倒吸,C中氨气从出来后经过四氯化碳再被水吸收,也可以防倒吸,B直接插入水中,会发生倒吸,不宜选取B装置吸收,
故答案为:2NH4Cl+Ca(OH)2 −△CaCl2+2H2O+2NH3↑;B。
(1)氮气分子中原子之间形成三键;
(2)NH3与O2在加热和催化剂作用下生成N2O,同时生成水;
(3)①A.加快通入尾气的速率,尾气不能和溶液充分反应;
B.采用气,液逆流的方式吸收尾气,可增长尾气和溶液接触面积;
C.NaOH浓度增大,有利于吸收尾气;
D.在溶液中氧气将氮的氧化物氧化为硝酸;
②NaNO2易被氧化生成硝酸钠;
(4)NH4Cl与固体Ca(OH)2加热反应生成氯化钙、氨气和水;氨气极易溶于水,需要防止倒吸。
本题考查比较综合,涉及氮元素单质及其化合物性质、方程式的书写、实验装置的选取、化学反应原理应用等,需要学生基本扎实的基础与灵活运用的能力。
17.【答案】Fe2O3 AlO2−+CO2+2H2O=Al(OH)3↓+HCO3− 漏斗 Al2O3+N2+3C−高温2AlN+3CO平衡气压 使溶液能够顺利滴下 减小滴加NaOH溶液产生排气量的实验误差 使装置恢复至室温,使a、b液面相平 82%
【解析】解:(1)氧化铁与氢氧化钠不反应,则赤泥的主要成分为Fe2O3,
故答案为:Fe2O3;
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,反应的离子方程式为AlO2−+CO2+2H2O=Al(OH)3↓+HCO3−,实验室过滤需用到的玻璃仪器有烧杯、漏斗、玻璃棒,
故答案为:AlO2−+CO2+2H2O=Al(OH)3↓+HCO3−;漏斗;
(3)氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,反应的化学方程式为Al2O3+N2+3C−高温2AlN+3CO,
故答案为:Al2O3+N2+3C−高温2AlN+3CO;
(4)分液漏斗上方所连导气管可以起到恒压滴液漏斗的作用,其作用为平衡气压,使溶液能够顺利滴下,反应完毕,应先减小滴加NaOH溶液产生排气量的实验误差,再使装置恢复至室温,使a、b液面相平,最后平视液面,记录b的读数,
故答案为:平衡气压,使溶液能够顺利滴下;减小滴加NaOH溶液产生排气量的实验误差;使装置恢复至室温,使a、b液面相平;
(5)加到100mL1.0mol⋅L−1的NaOH溶液中恰好反应完,则n(NaOH)=0.1L×1.0mol/L=0.10mol,根据反应AlN+NaOH+H2O=NaAlO2+NH3↑可知,n(AlN)=n(NaOH)=0.10mol,所以AlN的质量分数为0.1×415×100%=82%,
故答案为:82%。
铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质),铝士矿中加入氢氧化钠溶液,SiO2和Al2O3溶于氢氧化钠溶液,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,氧化铁不溶于氢氧化钠溶液,所以过滤得赤泥为Fe2O3、Na2Al2Si2O8,滤液主要为偏铝酸钠溶液,偏铝酸钠溶液中通入过量的二氧化碳酸化得沉淀为氢氧化铝,过滤得滤液主要为NaHCO3溶液,氢氧化铝燃烧得氧化铝,氧化铝、碳、氮气在高温下生成氮化铝,同时碳被氧化为CO,以此解答该题。
本题考查物质的制备实验方案设计,为高考常见题型和高频考点,侧重考查学生知识综合应用、根据实验目的及物质的性质进行分析、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取与使用,难度中等。
18.【答案】吸收二氧化硫,防止污染空气 6.3品红溶液褪色或品红红色褪去 BBaSO4 B 有黄色沉淀生成 2H2S+SO2=3S↓+2H2O
【解析】解:(1)丁装置的作用是吸收二氧化硫,防止污染空气,
故答案为:吸收二氧化硫,防止污染空气;
(2)根据Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,实验中若生成标准状况1.12LSO2,其物质的量为1.12L22.4L/mol=0.05mol,根据化学计量数需要Na2SO3为0.05mol,则至少需要0.05mol×126g/mol=6.3g,
故答案为:6.3;
(3)①若X是品红溶液,SO2具有漂白性,气体通过乙装置,观察到的现象是品红溶液褪色或品红红色褪去,
故答案为:品红溶液褪色或品红红色褪去;
②若X是酸性KMnO4溶液,酸性高锰酸钾溶液具有强氧化性,当气体通过乙装置时酸性高锰酸钾溶液褪色,说明SO2被氧化,二氧化硫表现出了还原性,
故答案为:B;
③若X是FeCl3和BaCl2的混合溶液,SO2气体通过乙装置,和铁离子发生氧化还原反应,反应为SO2+2Fe3++2H2O=2Fe2++SO42−+4H+,观察到溶液颜色由棕黄色变成浅绿色,同时有白色沉淀产生,硫酸根离子和钡离子反应生成硫酸钡沉淀,白色沉淀化学式为BaSO4,
故答案为:BaSO4;
(4)若X是浓硫酸,用于干燥SO2气体,在丙处选用如图戊所示的收集装置,SO2密度大于空气A,进气管应该长进短出,SO2气体从b导管通入集气瓶中,
故答案为:B;
(5)若X是氢硫酸,SO2气体通过乙装置,两者发生反应2H2S+SO2=3S↓+2H2O,则观察到的现象是有黄色沉淀生成,
故答案为:有黄色沉淀生成;2H2S+SO2=3S↓+2H2O。
甲装置Na2SO3和70%硫酸溶液反应制取SO2,乙装置可以进行SO2的检测或者干燥,C为收集装置,导气管应该长进短出,丁为尾气吸收装置,据此结合选项解答。
本题考查了二氧化硫的制备方法及性质,题目难度中等,明确二氧化硫的制备原理及化学性质为解答关键,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学实验能力。
19.【答案】分液漏斗 产生的氢气易燃易爆 4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓Fe2+被空气中的O2氧化为Fe3+ 减少洗涤晶体时的溶解损失,使晶体易于干燥 BF
【解析】解:(1)①分析可知,用图示装置制备FeSO4,仪器a的名称是分液漏斗,该实验不用明火加热的原因是反应有氢气产生,产生的氢气易燃易爆,
故答案为:分液漏斗;产生的氢气易燃易爆;
②PH3的具有强还原性,与硫酸铜溶液发生氧化还原反应,结合提示用CuSO4溶液吸收PH3时会生成H3PO4和Cu,故对应的化学方程式为4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓,
故答案为:4CuSO4+PH3+4H2O=H3PO4+4H2SO4+4Cu↓;
(2)①向滤液中加入适量(NH4)2SO4饱和溶液,70℃∼80℃水浴加热,保持溶液pH为1∼2,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,黄色为三价铁离子的颜色,故其原因是Fe2+被空气中的O2氧化为Fe3+,结合溶解度分析可知,选用乙醇洗涤晶体的目的是减少洗涤晶体时的溶解损失,使晶体易于干燥,
故答案为:Fe2+被空气中的O2氧化为Fe3+;减少洗涤晶体时的溶解损失,使晶体易于干燥;
②过滤的母液结合提示,显强酸性,故C(SO32−)、D(AlO2−)不共存,由于含有硫酸根离子,故E(Ba2+)不共存,溶液显强酸性,且含有亚铁离子,故A(NO3−)不共存,
故答案为:BF。
(1)①分析可知,用图示装置制备FeSO4,仪器a的名称是分液漏斗,该实验不用明火加热的原因是反应有氢气产生;
②PH3的具有强还原性,与硫酸铜溶液发生氧化还原反应,结合提示用CuSO4溶液吸收PH3时会生成H3PO4和Cu;
(2)①向滤液中加入适量(NH4)2SO4饱和溶液,70℃∼80℃水浴加热,保持溶液pH为1∼2,蒸发浓缩至溶液表面出现晶膜,冷却至室温即得晶体,减压过滤,用乙醇洗涤晶体。蒸发浓缩时,如果溶液pH太高或用玻璃棒搅拌,均可能导致溶液变黄,黄色为三价铁离子的颜色,故其原因是Fe2+被空气中的O2氧化为Fe3+,结合溶解度分析可知,选用乙醇洗涤晶体的目的是减少洗涤晶体时的溶解损失;
②过滤的母液结合提示,显强酸性,含有硫酸根离子,亚铁离子,据此判断离子共存问题。
本题考查物质的制备实验方案设计,为高考常见题型和高频考点,侧重考查学生知识综合应用、根据实验目的及物质的性质进行分析、实验基本操作能力及实验方案设计能力,综合性较强,注意把握物质性质以及对题目信息的获取与使用,难度中等。
相关试卷
这是一份2022届湖北省龙泉中学、宜昌一中、荆州中学等四校高三下学期模拟联考(一) 化学 PDF版,共13页。
这是一份湖北省荆门市龙泉中学、荆州中学、宜昌一中三校2023届高三下学期5月联考化学试卷(含答案),共14页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
这是一份2021-2022学年湖北省宜昌一中、荆州中学、龙泉中学三校高二(下)段考化学试卷(含答案解析),共20页。试卷主要包含了 下列化学用语表示正确的是, 下列说法不正确的是等内容,欢迎下载使用。









