









- 《化学反应的调控》课件PPT+教学设计 课件 23 次下载
- 《实验活动1:探究影响化学平衡移动的因素》课件PPT+教学设计 课件 20 次下载
- 《电离平衡》第二课时课件PPT+教学设计 课件 33 次下载
- 《电离平衡》第三课时课件PPT+教学设计 课件 31 次下载
- 《水的电离和溶液的PH》第一课时课件PPT+教学设计 课件 30 次下载
人教版 (2019)第一节 电离平衡评优课教学ppt课件
展开(人教版高中化学选择性必修1)
《电离平衡》第二课时 教学设计
课题名 | 《电离平衡》第二课时 |
教材分析 | 在必修第二册学习过电解质、非电解质的概念,本节课在此基础上学习强弱电解质、电离过程、电离方程式的书写,对于后续学习有重要辅助作用。 |
教学目标 | 宏观辨识与微观探析:能从电离的角度理解强电解质、弱电解质的概念。能用化学用语正确表示水溶液中的电离平衡,会正确书写电离方程式。 证据推理与模型认知:结合真实情境中的应用实例,认识电解质在水溶液中存在电离平衡,建立平衡移动模型认知。 科学探究与创新意识:通过探究盐酸和醋酸的电离程度实验培养小组合作意识,提升实验探究能力。 |
教学重点 | 理解强电解质、弱电解质的概念,能正确书写电离方程式。 |
教学难点 | 理解强电解质、弱电解质的概念,能正确书写电离方程式。 |
教学方法 | 讲解、实验 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
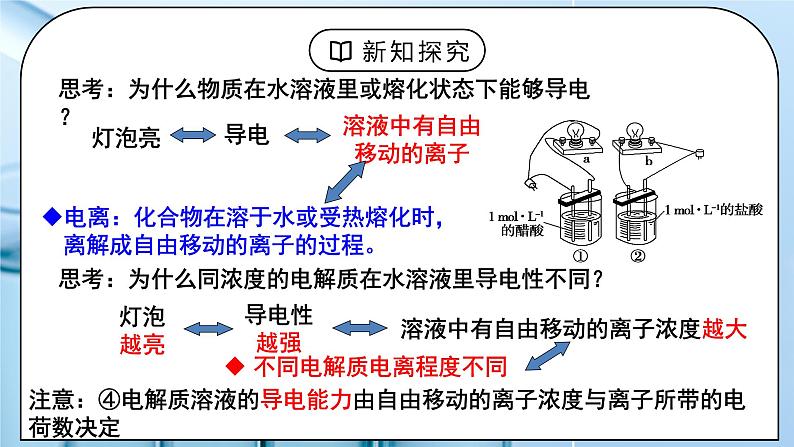
教学过程 | 一、新课导入 1.生活中的化学 教师:威猛先生主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)? 为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)。 学生:思考得出酸性强弱会影响物质用途的结论。 [设计意图]从生活现象引入新课激发学生学习兴趣。 二、探究新知 1.一、电解质与非电解质 教师:讨论:以下几种说法是否正确,并说明原因。 1.铜能导电,所以是电解质。 2.盐酸能导电,所以盐酸是电解质。 3.由于BaSO4不溶于水,所以不是电解质 4.SO2、NH3溶于水可导电,所以均为电解质。 注意:①化合物:电解质和非电解质都是化合物,单质和混合物既不是电解质也不是非电解质 ②或:水溶液或熔融任一条件下导电 ③本身电离:在水溶液或熔融状态时,化合物自身电离出自由移动的离子导电时,才是电解质,如NH3、CO2等是非电解质 电解质不一定导电,导电物质不一定是电解质 思考:为什么物质在水溶液里或熔化状态下能够导电? 电离:化合物在溶于水或受热熔化时,离解成自由移动的离子的过程。 思考:为什么同浓度的电解质在水溶液里导电性不同? 注意:④电解质溶液的导电能力由自由移动的离子浓度与离子所带的电荷数决定 学生:课堂练习:现有下列物质: ①金属铜 ②固态NaCl ③CO2 ④H2SO4 ⑤碳棒 ⑥酒精 ⑦KOH晶体 ⑧熔融状态的KNO3 ⑨葡萄糖 ⑩氨气 以上指定物质中, 属于电解质的是: 属于非电解质的是: 能导电的物质有: [设计意图]复习电解质和非电解质的概念为学习强弱电解质打基础。 2.二、强电解质和弱电解质 教师:【实验3-1】探究盐酸和醋酸的电离程度 取体积相同,0.1mol/L的盐酸和醋酸,(1)比较它们PH的大小,(2)测试其导电能力, (3)并分别与等量镁条反应,观察现象。观察实验现象,完成下表。 思考:盐酸、醋酸中主要有哪些溶质微粒? 强电解质:在水溶液里能全部电离成离子的电解质 强酸:HCl、H2SO4、HNO3、HClO4、HBr、HI 强碱:NaOH、KOH、Ca(OH)2 、Ba(OH)2 大部分的盐(包括难溶盐):NaCl、NH4Cl、Fe(NO3)3、BaSO4等; 活泼金属氧化物:Na2O、 MgO等 弱电解质:在水溶液里只能部分电离成离子的电解质 弱酸:CH3COOH、H2CO3、H2SO3、H3PO4、H2S、 HClO、HF、H2SiO3 弱碱:NH3·H2O及大部分难溶碱:Fe(OH)3、Al(OH)3等。 少数盐:(CH3COO)2Pb、 Fe(SCN)3 、HgCl2 、Hg2Cl2等; H2O:极弱电解质。 小结:物质的分类 讨论:判断下列说法是否正确,并说明理由。 ① CH3COOH易溶于水,所以为强电解质;BaSO4在水中的溶解度很小,所以为弱电解质。 ② 盐酸的导电能力一定比醋酸溶液的导电能力强。 注意: ①电解质的强弱与溶液的导电能力没有必然的联系 ②电解质溶液的强弱与溶解度无关 ③区分共价化合物和离子化合物:熔融状态下能否导电 课堂练习:现有以下物质:①硫酸铜晶体②AlCl3 ③冰醋酸④硫化氢 ⑤三氧化硫⑥金属⑦石墨⑧亚硫酸钠 ⑨氨水 ⑩熟石灰固体。 (1)属于强电解质的是①②⑧⑩ (填序号,下同)。 (2)属于弱电解质的是③④。 (3)属于非电解质的是⑤。 (4)既不是电解质,又不是非电解质的是⑥⑦⑨。 (5)能导电的是⑥⑦⑨。 三、电离方程式书写: 强电解质: 完全电离,书写时用 “ = ”号 弱电解质:部分电离,书时用 “ ” 号 学生:课堂练习:写出下列物质在水中的电离方程式: (1) NH3·H2O :___________ (2) H2SO3 :___________ (3)CH3COONH4:___________ (4) Fe(OH)3 :___________ (5) NaHS :___________ (6) NaHSO4 :___________ (7) Ba(OH)2 :___________ (8) H3PO4 :___________ 练习1、下图是在一定温度下向不同电解质溶液中加入新物质时溶液的导电性能发生变化,其电流(I)随新物质加入量(m)的变化曲线,以下三个导电性实验,其中与A图变化趋势一致的是_______,与B图变化趋势一致的是________,与C图变化趋势一致的是_______。 (1)Ba(OH)2溶液中滴入H2SO4溶液至过量 (2)醋酸溶液中滴入NH3·H2O至过量 (3)澄清的石灰水中通入CO2至过量 (4)NH4Cl溶液中逐渐加入适量NaOH固体 练习2.判断正误(正确的打“√”,错误的打“×”) (1)氯化钾溶液在电流作用下电离成钾离子和氯离子。 ( ) (2)二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质。 ( ) (3)碳酸钡难溶于水,所以碳酸钡属于弱电解质。 ( ) (4)纯净的强电解质在液态时,有的导电有的不导电。 ( ) 2.下列关于强、弱电解质的叙述中正确的是 ( ) A.强电解质都是离子化合物,弱电解质都是共价化合物; B.强电解质都是可溶性化合物,弱电解质都是难溶性化合物; C.强电解质的水溶液中无溶质分子,弱电解质的水溶液中有溶质分子; D.强电解质的导电能力强,弱电解质的导电能力弱。 练习3.下列物质能导电的是______,属于强电解质的是______,属于弱电解质的是________,属于非电解质的是_______. a.铜丝 b.金刚石 c.石墨 d.NaCl e.盐酸 f.蔗糖 g.CO2 h.Na2O i.硬脂酸 j.醋酸 k.碳酸 l.碳酸氢铵 m.氢氧化铝 n.氯气 o. BaSO4 [设计意图]学习强弱电解质的概念和种类,会书写电离方程式。 |
板书设计 | 一、电解质与非电解质 二、强电解质和弱电解质 三、电离方程式书写 |
课后作业 |
练习册上相关习题 |
教学反思 | 亮点:复习电解质和非电解质概念和注意事项,详细讲解强弱电解质概念、种类,并配置相关习题帮助学生理解新知识。 课堂教学建议:本节课概念多,教师应抓住概念易错点,举例讲解透彻。采取讲练结合的方式,学生更能把握住重难点。 |
高中化学第四节 沉淀溶解平衡教学课件ppt: 这是一份高中化学第四节 沉淀溶解平衡教学课件ppt,文件包含《沉淀溶解平衡》第二课时课件pptx、《沉淀溶解平衡》第二课时教学设计docx等2份课件配套教学资源,其中PPT共29页, 欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡教学课件ppt: 这是一份人教版 (2019)选择性必修1第二节 化学平衡教学课件ppt,文件包含《化学平衡》第五课时课件pptx、《化学平衡》第五课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。
人教版 (2019)选择性必修1第二节 化学平衡一等奖教学ppt课件: 这是一份人教版 (2019)选择性必修1第二节 化学平衡一等奖教学ppt课件,文件包含《化学平衡》第四课时课件pptx、《化学平衡》第四课时教学设计docx等2份课件配套教学资源,其中PPT共26页, 欢迎下载使用。














