






中考化学一轮复习精讲课件专题06 金属的化学性质 (含详解)
展开
这是一份中考化学一轮复习精讲课件专题06 金属的化学性质 (含详解),共33页。PPT课件主要包含了聚焦中考复习目标,复习目标,聚焦中考命题解读,命题解读,聚焦中考考点梳理,红色铜逐渐变成黑色,火星四射,生产黑色物质,发出耀眼的白光,生成白色固体等内容,欢迎下载使用。
1、认识铁、铜、铝等常见金属与氧气的反应;2、认识常见的金属与(稀)盐酸、(稀)硫酸的反应;3、认识常见的金属与盐溶液的反应;4、掌握金属活动性顺序,并能灵活运用金属的活动性顺序解释与日常生活有关的一些化学问题。
1、金属与酸反应的曲线图题本考点常以选择题的形式进行考查,考查的命题点有:金属与酸反应的相关判断、金属与盐反应的相关判断等。以文字或文字结合坐标曲线的形式呈现。2、金属活动性顺序的应用(滤液、滤渣的判断)本考点常以选择题和填空与简答题的形式进行考查,考查的命题点有:判断置换反应后金属的组成和溶液中溶质(或离子)的存在。常以文字的形式出现。
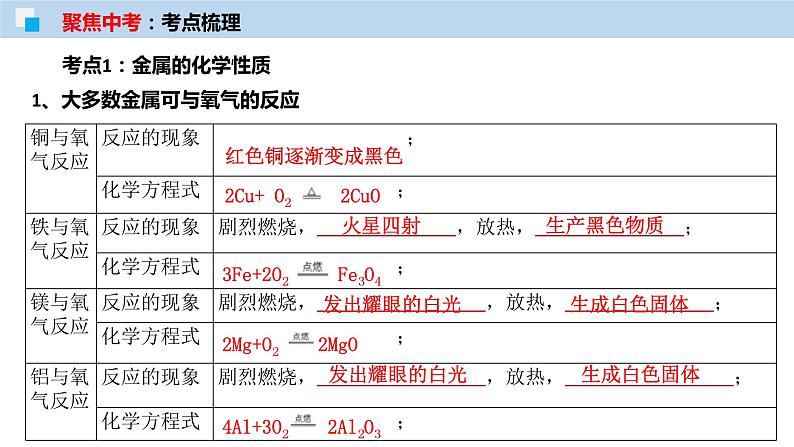
考点1:金属的化学性质
1、大多数金属可与氧气的反应
2、金属 + 酸 → 盐 + H2↑
Fe+2HCl=FeCl2+ H2↑
Mg+2HCl=MgCl2+ H2↑
(“湿法冶金”原理)铁与硫酸铜溶液反应的化学方程式: ;反应的现象铁的表面覆盖着 ,溶液由 ;铜与硝酸银溶液反应 ;反应的现象铜的表面覆盖着 ,溶液由 ;金属与盐发生置换反应的条件: ① 三种金属除外;②盐必须为 ; ③在活动性中只能在 。
Fe+CuSO4=Cu+FeSO4
Cu+2AgNO3= Cu(NO3)2+2 Ag
3、金属 + 盐 → 另一金属 + 另一盐(条件:“前换后,盐可溶”)
前面的金属置换后面的金属
考点2:常见金属活动性顺序
判断金属活动性的方法之一: 根据金属与氧气反应的难易程度或者反应现象的剧烈程度判断
判断金属活动性的方法之二:金属是否与酸反应及反应的剧烈程度判断金属的活动性强弱
常用的探究金属活动性顺序的方法:方法3:利用金属与金属化合物溶液的反应。依 据反应能否发生判断:能反应说明置换的金属比被置换金属活动性强。不能反应说明置换的金属比被置换金属活动性弱。
在金属活动性顺序里:(1)金属的位置越靠前,它的 。(2)位于 的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)(3)位于前面的金属能把位于后面的 从它们的 中置换出来。(除K、Ca、Na)(4)越活泼的,开发利用的 。
聚焦中考:解题方法指导
金属与酸反应产生氢气质量的分析
例如:a g金属M(其相对原子质量为 m,在化合物中显示的化合价为 n)与足量稀盐酸反应,生成氢气的质量为x ,求算过程如下。 M + 2nHCl == 2MCln + H2↑ m n a g x
金属的质量和化合价均相同时,金属的相对原子质量越大,生成氢气的质量越小。如:相同质量的Mg、Zn、Fe分别与足量的稀硫酸反应,生成氢气的质量关系为:Mg>Fe>Zn。
相同质量的金属与足量酸反应生成氢气的质量不同。
2、酸不足时:
金属与等质量同浓度的同种酸反应时,生成氢气的质量相等。
如:足量的Mg、Zn、Fe分别与等质量等质量分数的稀硫酸反应,生成氢气的质量关系为:Mg=Fe=Zn。
2、金属活动性顺序的应用(滤液、滤渣的判断)金属与盐的混合溶液反应后滤渣、滤液成分的判断方法例如:将铁粉不断加入硝酸铜、硝酸银、硝酸锌的混合溶液中。I、由于锌比铁活泼,故铁不与硝酸锌反应(依据:金属与盐反应的规律),因此滤液中一定含有硝酸锌,滤渣中一定不含锌。II、根据“优先反应”规律(即远距离先置换),铁首先与硝酸银溶液反应;(1)硝酸银反应一部分:滤渣(银);滤液(硝酸锌、硝酸亚铁、硝酸银、硝酸铜)(2)硝酸银恰好完全反应完:滤渣(银);滤液(硝酸锌、硝酸亚铁、硝酸铜)III、硝酸银反应完后,若铁粉有剩余,铁才与硝酸铜反应。(3)硝酸铜反应一部分:滤渣(银、铜);滤液(硝酸锌、硝酸亚铁、硝酸铜)(4)硝酸铜恰好完全反应完:滤渣(银、铜);滤液(硝酸锌、硝酸亚铁)(5)硝酸铜反应完、铁还有剩余:滤渣(银、铜、铁);滤液(硝酸锌、硝酸亚铁)
聚焦中考:题型典例聚焦
【题型一 金属活动性顺序应用】
【2021湖南长沙】金属活动性顺序在工农业生产和科学研究中有重要作用。下列金属中活动性最强的是( )A.镁(Mg)B.铝(Al)C.铁(Fe)D.铜(Cu)
常见金属活动性顺序为K、Ca、Na、Mg、Al、Zn、Fe、Sn、Pb、(H)、Cu、Hg、Ag、Pt、Au;在金属活动性顺序中,金属的位置越靠前,金属的活动性就越强,选项提供的四种金属中镁的位置最靠前,故四种金属中金属活动性最强的是镁。
【2021广西北海】有X、Y、Z三种金属,如果把X和Y分别放入硫酸中,X溶解并产生气泡,Y不反应;如果把Y和Z分别放入硝酸银溶液中,在Y表面有银白色物质析出,而Z没有变化。根据以上实验事实,判断这三种金属的活动性由强到弱的顺序为( )A.X、Z、YB.X、Y、ZC.Y、X、ZD.Z、Y、X
有X、Y、Z三种金属,如果把X和Y分别放入稀硫酸中,X溶解并产生气泡,Y不反应,说明X的金属活动性比氢强,Y的金属活动性比氢弱,即动性X>H>Y;如果把Y和Z分别放入硝酸银溶液中,在Y表面有银白色物质析出,而Z没有变化,说明Y的金属活动性比银强,Z的金属活动性比银弱,即动性Y>Ag>Z。由上述分析可知,X、Y、Z三种金属的活动性由强到弱的顺序是:X>Y>Z。
2、【2021江苏宿迁】将X、Z两种金属分别放入Y(NO3)2的溶液中,仅X的表面有Y单质析出,则X、Y、Z三种金属的活动性顺序是( )A. Z>X>YB. X>Y>ZC. X>Z>YD. Y>X>Z
1、【2020北京】下列不能与稀盐酸反应的金属是()A.Cu B.Zn C.Al D.Mg
将X、Z两种金属分别放入Y(NO3)2的溶液中,仅X的表面有Y单质析出,说明X能将Y从其盐溶液中置换出来,X比Y活泼,Z与Y(NO3)2不反应,说明Y比Z活泼,故三种金属的活动性顺序是:X>Y>Z
金属活动顺序表中,H后金属不能与稀酸发生置换反应产生氢气。铜属于H 后金属,不能和稀盐酸发生反应。
3、【2021湖南株洲】经过实验探究,人们总结出了金属活动性顺序规律,下列有关说法正确的是( )A. 金属铝比铁更耐腐蚀,是因为铁更活泼B. 工业上可以利用单质铁回收硫酸锌溶液中的金属锌C. 铜、银单质分别与稀盐酸混合,铜置换出氢气更快D. 金属活动性顺序可作为金属能否在溶液中发生置换反应的一种判断依据
在金属活动性顺序中,铁排在锌后面,单质铁不能把锌从硫酸锌溶液中置换出来
金属铝比铁更耐腐蚀,是因为铝在空气中与氧气反应,其表面生成一层致密的氧化铝薄膜,从而阻止铝进一步氧化。铁在空气中生锈后,铁锈很疏松,不能阻止里层的铁继续与氧气、水等反应,因此铁不耐腐蚀。事实上铝比铁活泼
在金属活动性顺序中,铜和银都排在氢后面,不能把稀盐酸中的氢置换出来
在金属活动性顺序里,金属的位置越靠前,它的活动性就越强,因此金属活动性顺序可作为金属能否在溶液中发生置换反应的一种判断依据
4、【2021山东威海】下列事实能用金属活动性解释的是( )①铝制品比铁制品耐腐蚀②用硫酸铜溶液和铁制取铜③用稀盐酸除铁锈④金属铜不能与稀硫酸反应A.①②B.①②③C.②④D.①②④
①铝制品比铁制品耐腐蚀,原因是铝易与氧气反应生成了一层致密的氧化铝薄膜,阻止了反应的进一步进行,不能说明铁的活动性比铝强,不能用金属活动性解释性质
②用硫酸铜溶液和铁制取铜,是由于铁比铜活泼,铁能将铜置换出来,能用金属活动性解释
③用稀盐酸除铁锈,是酸与金属氧化物反应,不能用金属活动性解释
④金属铜不能与稀硫酸反应,是由于铜位于氢的后面,能用金属活动性解释
【题型二 探究金属活动性】
【2021湖南永州】某研究性学习小组对铁、铜的金属活动性及实验后的废液进行探究,设计下列实验。Ⅰ.铁、铜金属活动性比较结论:通过上面实验,可知Fe的金属活动性比Cu_______(填“强”或“弱”)。Ⅱ.将上面①、②、③实验后的液体收集在一烧杯中,对该烧杯中的废液进行分析。(1)甲同学观察到废液呈现蓝色,认为废液中一定含有 (填化学式)。
Fe+H2SO4=FeSO4+ H2↑
CuSO4、FeSO4
结论:(2)乙同学用玻璃棒蘸取废液滴到pH试纸上,把试纸显示的颜色与 比较,测得废液pH甲>乙 B.生成氢气的质量:甲>乙>丙C.相对原子质量:乙>丙>甲 D.消耗硫酸的质量:甲>乙>丙
【解析】A、由题意甲、乙、丙三种金属分别与三份溶质质量分数相同的足量稀硫酸反应,金属完全反应,根据生成氢气的质量与反应时间的关系图可知,金属乙反应的氢气质量最先达到最大值,其次是金属甲,最后是金属丙,即金属乙最先反应完,其次是金属甲,金属丙最后反应完,因此完全反应所需时间的关系为丙>甲>乙,A选项说法正确,不符合题意;B、如图所示曲线平行于x轴时,生成的氢气质量达到最大值,三种金属生成氢气的质量甲最大,其次是乙,最小的是丙,即生成氢气的质量甲>乙>丙,B选项说法正确,不符合题意;C、由题意已知甲、乙、丙在生成物中均显+2价,若金属元素的符号为M,与稀硫酸反应的通式为M+H2SO4=MSO4+ H2↑,设金属的相对原子质量为x,金属的质量为m金属,生成氢气的质量为m氢气,根据方程式可知x/2=m金/m氢气属,则有x=2m金/m氢气属,已知甲、乙、丙三种金属的质量相等,则金属的相对原子质量x与生成氢气的质量成反比,如图所示生成氢气的质量关系为甲>乙>丙,三种金属的相对原子质量关系为甲<乙<丙,C选项说法错误,符合题意;D、由题意已知甲、乙、丙在生成物中均显+2价,若金属元素的符号为M,与稀硫酸反应的通式为M+H2SO4=MSO4+ H2↑,由方程式可知生成的氢气中的氢元素全部来自于硫酸,根据质量守恒定律元素守恒,生成的氢气质量越大,消耗的硫酸质量越大,如图所示生成氢气的质量关系为甲>乙>丙,消耗硫酸的质量关系为甲>乙>丙,D选项说法正确,不符合题意。故选C。
2、【2020山东济宁】在两只烧杯中分别放入相同质量的镁、锌两种金属,然后向两只烧杯中分别倒入相同质量、相同质量分数的稀硫酸,反应产生氢气的质量与消耗硫酸的质量关系如图。综合以上信息得到以下结论,合理的是( )A.从图象可以看出,金属镁比金属锌的活动性强B.若两种金属都有剩余,二者得到的氢气质量相同C.若硫酸有剩余,二者得到氢气的质量相同D.若两种金属完全溶解,二者消耗硫酸的质量相同
相关课件
这是一份中考化学一轮复习精品课件第06讲 碱 (含解析),共56页。PPT课件主要包含了图10-3-2,图10-3-3,某些非金属氧化物,+3H2O,Na2CO3,实验探究,无明显现象,稀硫酸,图10-3-5,气球膨胀等内容,欢迎下载使用。
这是一份中考化学一轮复习金属的化学性质课件PPT,共19页。PPT课件主要包含了②作照明弹,④真金不怕火炼,差异性,设计该实验的依据,Cu>Ag,Al>Cu,Fe>H,H>Cu,Fe>Cu,两金夹一盐两盐夹一金等内容,欢迎下载使用。
这是一份中考化学一轮复习考点讲练课件 金属的化学性质 (含答案),共34页。PPT课件主要包含了金即使在高温时也不与,氧气反应,铝>铁>铜>金,化合物,另一种单质,另一种化合物等内容,欢迎下载使用。








