

2021-2022学年河南省中原名校高二(下)第一次联考化学试卷(含答案解析)
展开
这是一份2021-2022学年河南省中原名校高二(下)第一次联考化学试卷(含答案解析),共20页。试卷主要包含了 下列说法不正确的是, 下列物质属于共价化合物的是等内容,欢迎下载使用。
2021-2022学年河南省中原名校高二(下)第一次联考化学试卷
1. 下列说法不正确的是( )
A. 自嗨锅的发热包主要成分是生石灰,其与水反应放热从而使食材加热
B. 抗坏血酸(即维生素C)是水果罐头中常用的抗氧化剂,是因为其具有较强的氧化性
C. 在食品包装袋内放入铁系保鲜剂可以防止食品因氧化而变质
D. 臭氧是饮用水的理想消毒剂之一,因为它杀菌能力强且不影响水质
2. NA代表阿伏加德罗常数,下列说法正确的是( )
A. 标准状况下,22.4LCCl4所含氯原子数为4NA
B. 56g铁与足量稀盐酸反应转移的电子数为3NA
C. 在密闭容器中将2molSO2和1molO2 混合反应后,体系中的原子数为8NA
D. 将10mL0.1mol/LFeCl3溶液滴入沸水中,得到Fe(OH)3胶粒的个数为0.001NA
3. 下列物质属于共价化合物的是( )
A. HCl B. H2 C. NaOH D. NH4Cl
4. 某同学用下列装置进行有关Cl2的实验。下列说法不正确的是( )
A. Ⅰ图中:实验现象证明氯气无漂白作用,氯水有漂白作用
B. Ⅱ图中:闻Cl2的气味
C. Ⅲ图中:生成棕黄色的烟
D. Ⅳ图中:若气球干瘪,证明Cl2可与NaOH反应
5. 电池的发展是化学对人类的一项重大贡献。下列有关化学电源的叙述中正确的是( )
A. 锌锰干电池工作一段时间后石墨棒变细
B. 太阳能电池的主要材料是高纯度的二氧化硅
C. 手机上用的锂离子电池属于二次电池
D. 氢氧燃料电池可将热能直接转变为电能
6. 下列关于化学反应速率的说法正确的是( )
A. 化学反应速率既有正值,又有负值
B. 化学反应速率表示的是化学反应进行的程度
C. 化学反应速率是某时刻的瞬时速率
D. 对于同一化学反应,选用不同的物质表示化学反应速率时,其数值可能不同
7. X、Y、Z、W、R是原子序数依次增大的5种短周期主族元素。5种元素中只有W为金属;X和W的最外层电子数相等;Y的某种核素常用来测定一些文物的年代;Z、R同主族,且Z与W可形成一种淡黄色的固体化合物。下列说法正确的是( )
A. 由X、Z、W、R四种元素形成的化合物一定是WXRZ4
B. Z的氢化物的沸点比Y的氢化物的沸点高
C. X与Z形成的化合物X2Z2中既含极性键又含非极性键
D. X与其他元素形成的化合物中X的化合价都是+1价
8. 下列事实不能用元素周期律解释的是( )
A. 非金属性:SNH3
C. 酸性:HCl>HF D. 金属单质的还原性:K>Na
9. 已知下列反应的热化学方程式为
(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=−870.3kJ⋅mol−1
(2)C(s)+O2(g)=CO2(g)△H2=−393.5kJ⋅mol−1
(3)H2(g)+12O2(g)=H2O(l)△H3=−285.8kJ⋅mol−1
则反应2C(s)+2H2(g)+O2(g)=CH3COOH(l)的△H为( )
A. −488.3kJ⋅mol−1 B. −191kJ⋅mol−1
C. −476.8kJ⋅mol−1 D. −1549.6kJ⋅mol−1
10. 如图所示装置中,U形管内为红墨水,a、b试管内分别盛有浓氯化铵溶液和食盐水,各加入一生铁块,放置一段时间。下列有关描述错误的是( )
A. 生铁块中的碳是原电池的正极
B. 两支试管中的铁都发生氧化反应
C. 一段时间后,U形管内红墨水两边的液面变为左高右低
D. a试管中主要发生了析氢腐蚀,b试管中主要发生了吸氧腐蚀
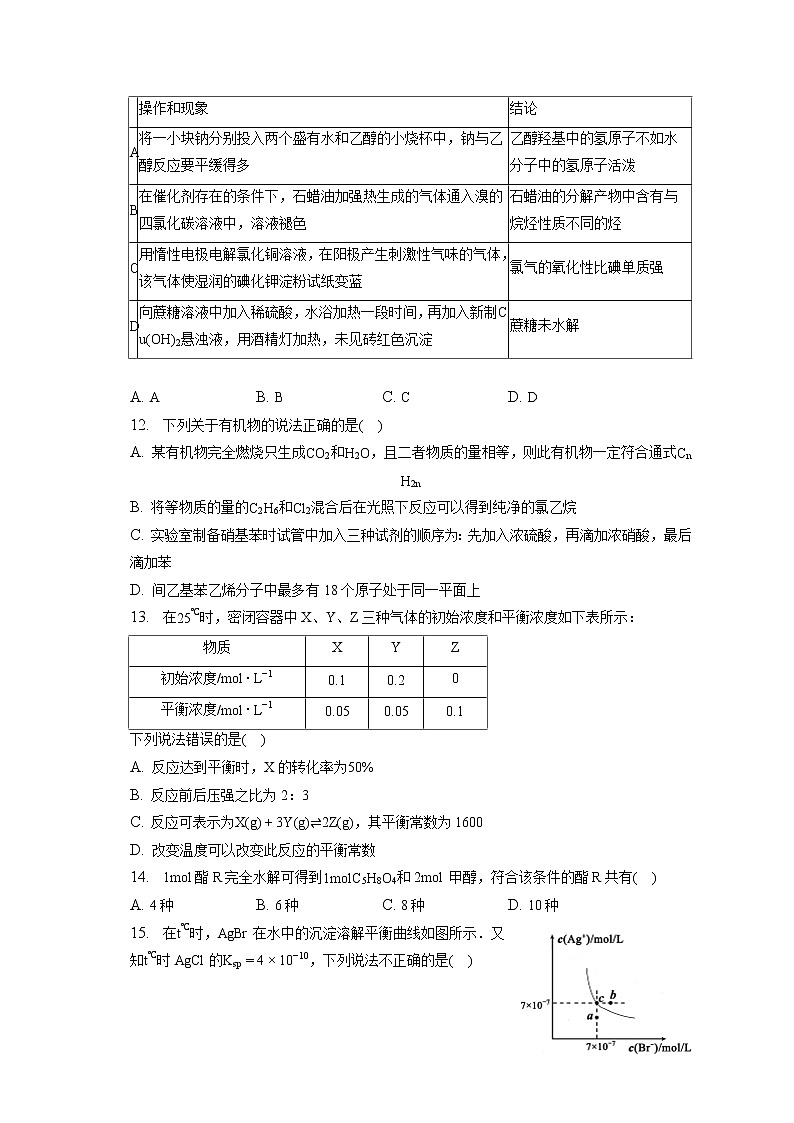
11. 下列实验操作和现象与结论的关系不相符的是( )
操作和现象
结论
A
将一小块钠分别投入两个盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多
乙醇羟基中的氢原子不如水分子中的氢原子活泼
B
在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色
石蜡油的分解产物中含有与烷烃性质不同的烃
C
用惰性电极电解氯化铜溶液,在阳极产生刺激性气味的气体,该气体使湿润的碘化钾淀粉试纸变蓝
氯气的氧化性比碘单质强
D
向蔗糖溶液中加入稀硫酸,水浴加热一段时间,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀
蔗糖未水解
A. A B. B C. C D. D
12. 下列关于有机物的说法正确的是( )
A. 某有机物完全燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物一定符合通式CnH2n
B. 将等物质的量的C2H6和Cl2混合后在光照下反应可以得到纯净的氯乙烷
C. 实验室制备硝基苯时试管中加入三种试剂的顺序为:先加入浓硫酸,再滴加浓硝酸,最后滴加苯
D. 间乙基苯乙烯分子中最多有18个原子处于同一平面上
13. 在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表所示:
物质
X
Y
Z
初始浓度/mol⋅L−1
0.1
0.2
0
平衡浓度/mol⋅L−1
0.05
0.05
0.1
下列说法错误的是( )
A. 反应达到平衡时,X的转化率为50%
B. 反应前后压强之比为2:3
C. 反应可表示为X(g)+3Y(g)⇌2Z(g),其平衡常数为1600
D. 改变温度可以改变此反应的平衡常数
14. 1mol酯R完全水解可得到1molC5H8O4和2mol 甲醇,符合该条件的酯R共有( )
A. 4种 B. 6种 C. 8种 D. 10种
15. 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示.又知t℃时AgCl的Ksp=4×10−10,下列说法不正确的是( )
A. 在t℃时,AgBr的Ksp为4.9×l0−13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br−(aq)⇌AgBr(s)+Cl−(aq)平衡常数K≈816
16. 以酚酞为指示剂,用0.1000mol⋅L−1的NaOH溶液滴定20.00mL未知浓度的二元酸H2A溶液。溶液中,pH、分布系数δ随滴加NaOH溶液体积VNaOH的变化关系如图所示。[比如A2−的分布系数:δ(A2−)=c(A2−)c(H2A)+c(HA−)+c(A2−)]
下列叙述正确的是( )
A. 曲线①代表δ(H2A),曲线②代表δ(HA−)
B. H2A溶液的浓度为0.2000mol⋅L−1
C. HA−的电离常数Ka=1.0×10−2
D. 滴定终点时,溶液中c(Na+)c(CN−),下列关系正确的是______。
a.c(H+)>c(OH−)
b.c(H+)+c(HCN)=c(OH−)
c.c(HCN)+c(CN−)=0.01mol/L
18. 请用有关电解质溶液的知识回答下列问题:
(1)某温度下纯水的c(H+)=4.0×10−7mol/L,若温度不变,滴入稀盐酸,使c(H+)=2.0×10−4mol/L,则此溶液中由水电离产生的c(H+)=______。
(2)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)⇌Cu2+(aq)+2OH−(aq),常温下其Ksp=c(Cu2+)⋅c2(OH−)=2×10−20。某硫酸铜溶液里c(Cu2+)=0.02mol⋅L−1,如要生成Cu(OH)2沉淀,应调整溶液使之pH>______
(3)在工业废水处理过程中,依据沉淀转化原理,可用FeS作为沉淀剂除去废水中的Hg2+,写出相应的离子方程式 ______。(Ksp(FeS)=6.3×10−18,Ksp(HgS)=6.4×10−53)
19. 为探究Na2SO3溶液和铬(Ⅵ)盐溶液的反应规律,某同学进行实验如下:
已知:Cr2O72−(橙色)+H2O⇌2CrO42−(黄色)+2H+
(1)进行实验i和ii:
序号
操作
现象
i
向2mLpH=2的0.05mol⋅L−1K2Cr2O7橙色溶液中滴加饱和Na2SO3溶液(pH约为9)3滴
溶液变绿色(含Cr3+)
ii
向2mLpH=8的0.1mol⋅L−1K2Cr2O4黄色溶液中滴加饱和Na2SO3溶液3滴
溶液没有明显变化
①用离子方程式表示饱和Na2SO3溶液pH约为9的原因: ______ 。
②用离子方程式解释i中现象: ______ 。
(2)继续进行实验iii:
序号
操作
现象
iii
向饱和Na2SO3溶液中滴加pH=2的0.05mol⋅L−1K2Cr2O7橙色溶液3滴
溶液变黄色
为了说明产生上述现象的原因,补充实验iv:
向2mL蒸馏水中滴加pH=2的0.05mol⋅L−1K2Cr2O7橙色溶液3滴,溶液变成浅橙色。
①补充实验ⅳ的目的是 ______ 。
②用化学平衡移动原理解释iii中现象: ______ 。
③根据实验i∼iii,可推测:Na2SO3溶液和铬(Ⅵ)盐溶液的反应与溶液酸碱性有关。
a.碱性条件下,Na2SO3溶液和铬(Ⅵ)盐溶液不发生氧化还原反应;
b.______ 。
④向实验iii所得黄色溶液中继续滴加硫酸,产生的现象证实了上述推测。该现象是 ______ .
20. 工业上由黄铜矿(主要成分CuFeS2)冶炼铜的主要流程如图:
(1)气体A中的大气污染物可选用下列试剂中的 ______吸收。
a.浓H2SO4
b.稀HNO3
c.NaOH溶液
d.氨水
(2)用稀H2SO4浸泡熔渣B,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在 ______(填离子符号),检验溶液中还存在Fe2+的方法是 ______(注明试剂、现象)。
(3)已知:Ksp[Fe(OH)3]=1.0×10−38,若所得溶液中只含Fe3+,在溶液中加入一定量的石灰水,调节溶液的pH使Fe3+沉淀完全,此时溶液pH为 ______。(保留一位小数)
(4)由泡铜冶炼粗铜的化学反应方程式 ______。
(5)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是 ______。
a.电能全部转化为化学能
b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动
d.利用阳极泥可回收Ag、Pt、Au等金属
e.阳极减少的质量与阴极增加的质量相等
(6)利用下列原电池装置可制备CuSO4,其正极电极反应式为 ______。
21. 电解质水溶液中存在电离平衡、水解平衡、溶解平衡,请回答下列问题。
(1)已知部分弱酸的电离常数如表所示:
弱酸
HCOOH
HCN
H2CO3
电离常数(25℃)
Ka=1.77×10−4
Ka=4.3×l0−10
Ka1=5.0×l0−7
Ka2=5.6×l0−11
①0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,c(CN−)______c(HCO3−)(填“>”、“NH3,可以用元素周期律解释,故B正确;
C.HCl、HF是无氧酸,不能用元素周期律解释,故C错误;
D.K、Na为同主族金属元素,金属单质的还原性:K>Na,故D正确;
故选:C。
A.同主族从上到下,非金属性减弱;
B.非金属性越强,简单气态氢化物的稳定性越强;
C.非金属性越强,最高价含氧酸的酸性越强;
D.K、Na为同主族金属元素,同主族从上到下,金属性增强,失电子能力增强,还原性增强。
本题考查元素周期律的应用,主要涉及金属性及非金属性的比较,明确物质性质、元素周期律的内容为解答关键,试题侧重考查学生灵活应用基础知识的能力,题目难度不大。
9.【答案】A
【解析】解:已知(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=−870.3kJ⋅mol−1
(2)C(s)+O2(g)=CO2(g)△H2=−393.5kJ⋅mol−1
(3)H2(g)+12O2(g)=H2O(l)△H3=−285.8kJ⋅mol−1
据盖斯定律,(2)×2+(3)×2−(1)得:2C(s)+2H2(g)+O2(g)=CH3COOH(l)△H=−488.3KJ/mol,
故选:A。
①CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l)△H1=−870.3kJ⋅mol−1
②C(s)+O2(g)=CO2(g)△H2=−393.5kJ⋅mol−1
③H2(g)+12O2(g)=H2O(l)△H3=−285.8kJ⋅mol−1
据盖斯定律,(2)×2+(3)×2−(1)进行计算.
本题考查化学反应与能量,侧重于盖斯定律的运用,注意把握盖斯定律的原理以及计算方法,题目难度不大.
10.【答案】C
【解析】解:A.铁发生吸氧腐蚀和析氢腐蚀时,铁易失电子作负极,则碳都作正极,故A正确;
B.生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,发生氧化反应Fe−2e−=Fe2+,故B正确;
C.氯化铵为强酸弱碱盐,水解呈酸性,左边试管a中浓氯化铵是酸性溶液,发生析氢腐蚀,2H++2e−=H2↑,右边试管b中是中性溶液,发生吸氧腐蚀,氧气得到电子发生还原反应,反应式为:O2+4e−+2H2O=4OH−,转移等电子时,左边试管内生成氢气,气体的压强增大,右边试管内气体的氧气减小,压强减小,导致U型管内红墨水左低右高,故C错误;
D.试管a中是酸性溶液发生析氢腐蚀,试管b中是中性溶液,发生吸氧腐蚀,故D正确;
故选:C。
生铁中含有铁和碳,铁、碳和电解质溶液构成了原电池,较活泼的金属铁作负极,碳作正极,负极上失电子发生氧化反应,正极上得电子发生还原反应,试管a中是酸性溶液发生析氢腐蚀,试管b中是中性溶液,发生吸氧腐蚀。
本题考查了金属的腐蚀与防护,明确生铁发生吸氧腐蚀和析氢腐蚀的环境是解本题关键,题目难度不大。
11.【答案】D
【解析】解:A.钠与水反应比与乙醇反应剧烈,可知乙醇羟基中的氢原子不如水分子中的氢原子活泼,故A正确;
B.石蜡油加强热分解生成不饱和烃,与溴发生加成反应,使溶液褪色,可知石蜡油的分解产物中含有与烷烃性质不同的烃,故B正确;
C.惰性电极电解氯化铜溶液,阳极上氯离子失去电子生成氯气,使湿润的碘化钾淀粉试纸变蓝,可知氯气的氧化性比碘单质强,故C正确;
D.蔗糖水解后,在碱性溶液中检验葡萄糖,水解后没有先加碱至碱性,由操作和现象不能证明蔗糖未水解,故D错误;
故选:D。
A.钠与水反应比与乙醇反应剧烈;
B.石蜡油加强热分解生成不饱和烃;
C.惰性电极电解氯化铜溶液,阳极上氯离子失去电子生成氯气;
D.蔗糖水解后,在碱性溶液中检验葡萄糖。
本题考查化学实验方案的评价,题目难度不大,明确物质的性质、反应与现象、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析。
12.【答案】D
【解析】解:A.烃及含氧衍生物完全燃烧均只生成CO2和H2O,则某有机物完全燃烧只生成CO2和H2O,且二者物质的量相等,此有机物符合通式CnH2n或CnH2nOm,故A错误;
B.光照下发生的取代反应链锁式反应,产物复杂,不能制备纯净的氯乙烷,故B错误;
C.应将浓硫酸注入浓硝酸中,冷却后加苯,则制备硝基苯时加入试剂的顺序不合理,故C错误;
D.苯环、双键为平面结构,苯环与双键共面,且与乙基中2个C、1个H共面时,共面原子最多,则间乙基苯乙烯分子中最多有18个原子(10个C、8个H)处于同一平面上,故D正确;
故选:D。
A.烃及含氧衍生物完全燃烧均只生成CO2和H2O;
B.光照下发生的取代反应链锁式反应,产物复杂;
C.应将浓硫酸注入浓硝酸中,冷却后加苯;
D.苯环、双键为平面结构,苯环与双键共面,且与乙基中2个C、2个H共面时,共面原子最多。
本题考查有机物的结构与性质,题目难度不大,明确有机物的官能团、有机反应、原子共面为解答的关键,侧重分析与应用能力的考查,注意选项D为解答的难点。
13.【答案】B
【解析】解:A.反应达到平衡时,X的转化率为0.1mol/L−0.05mol/L0.1mol/L×100%=50%,故A正确;
B.反应前后压强之比为0.1+0.20.05+0.05+0.1=3:2,故B错误;
C.反应为X(g)+3Y(g)⇌2Z(g),其平衡常数K=c2(Z)c(X)⋅c3(Y)=(0.1)20.05×(0.05)3=1600,故C正确;
D.K与温度有关,则改变温度可以改变此反应的平衡常数,故D正确;
故选:B。
由表中数据可知,X减少0.05mol/L,Y减少0.15mol/L,Z增加0.1mol/L,由浓度变化量之比等于化学计量数之比,可知反应为X(g)+3Y(g)⇌2Z(g),
A.结合转化率=转化的量开始的量×100%计算;
B.温度、体积不变时,反应物前后的物质的量之比等于压强之比;
C.K=c2(Z)c(X)⋅c3(Y),结合平衡浓度计算;
D.K与温度有关。
本题考查化学平衡的计算,题目难度不大,明确表中数据的应用、K的计算、转化率及压强比的计算为解答的关键,侧重分析与计算能力的考查,注意选项B为解答的难点。
14.【答案】A
【解析】解:1mol该酯完全水解可得到lmolC5H8O4和2mol甲醇,则说明酯中含有2个酯基,设酯R为M,则反应的方程式为M+2H2O=C5H8O4+2CH3OH,由质量守恒可知M的分子式为C7H12O4,其中只含二个−COOCH3基团,可以看成丙烷的二元取代产物,含两个−COOCH3基团的R的同分异构体共有4种:CH3CH2CH(COOCH3)2,CH3OOCCH2CH(CH3)CH2COOCH3,CH3OOCCH2CH2CH2COOCH3,,
故选:A。
1mol该酯完全水解可得到lmolC5H8O4和2mol甲醇,则说明酯中含有2个酯基,结合酯的水解特点以及质量守恒定律判断酯R分子式,含二个−COOCH3基团,可以看成丙烷的二元取代产物,据此书写分子结构。
本题考查有机物的推断,为高频考点,侧重分析与应用能力的考查,把握酯化反应中碳原子个数变化、官能团的变化为推断的关系,侧重酯的性质的考查,题目难度不大。
15.【答案】B
【解析】
【分析】
本题考查了沉淀溶解平衡曲线,曲线为饱和溶液,曲线以上为过饱和溶液,以下为不饱和溶液;要掌握Ksp及简单计算。
【解答】
A.根据图中c点的c(Ag+)和c(Br−)可得该温度下AgBr的Ksp为4.9×10−13,故A正确;
B.在AgBr饱和溶液中加入NaBr固体后,c(Br−)增大,沉淀溶解平衡逆向移动,c(Ag+)减小,故B错误;
C.在a点时Qcc(H+),溶液中的电荷守恒,c(H+)+c(Na+)=2c(A2−)+c(OH−)+c(HA−),则c(Na+)>2c(A2−)+c(HA−),故D错误;
故选C。
17.【答案】H2CO3⇌H++HCO3− ②>①>③ CN−+CO2+H2O=HCO3−+HCNac
【解析】解:(1)碳酸为二元弱酸水溶液中分步电离,碳酸的第一步电离方程式为:H2CO3⇌H++HCO3−,
故答案为:H2CO3⇌H++HCO3−;
(2)依据图表数据分析,醋酸电离常数大于氰酸大于碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度等浓度的Na2CO3溶液>NaCN溶液>CH3COONa溶液,溶液pH为Na2CO3溶液的>NaCN溶液的>CH3COONa溶液的,
故答案为:②>①>③;
(3)向NaCN溶液中通入少量CO2,H2CO3酸性大于HCN大于HCO3−,所以反应生成氰酸和碳酸氢钠,不能生成二氧化碳,反应的化学方程式为:NaCN+H2O+CO2=HCN+NaHCO3,反应的离子方程式为:CN−+CO2+H2O=HCO3−+HCN,
故答案为:CN−+CO2+H2O=HCO3 −+HCN;
(4)将0.02mol/L的HCN与0.01mol/L的NaOH溶液等体积混合,溶液中的溶质是物质的量浓度都为0.005mol⋅L−1的NaCN、HCN,测得c(Na+)>c(CN−),根据电荷守恒可知:c(H+)HCO3−,所以反应生成氰酸和碳酸氢钠;
(4)将0.02mol/L的HCN与0.01mol/L的NaOH溶液等体积混合,溶液中的溶质是等物质的量浓度的NaCN、HCN,已知混合溶液中c(CN−)HCN>HCO3−,0.1m水解平衡常数Kh=c(HCOOH)c(OH−)c(HCOO−)=KwKa,0.1moI/LNaCN溶液和0.1mol/LNaHCO3溶液中,HCO3−离子水解程度小,则溶液中离子浓度c(CN−)HCO3−,则将少量CO2通入NaCN溶液中,发生反应的化学方程式:CO2+H2O+NaCN=NaHCO3+HCN,
故答案为:CO2+H2O+NaCN=NaHCO3+HCN;
④HCOONa溶液pH=9,HCOOH为弱酸,则HCOONa溶液水解呈碱性,水解的离子方程式为HCOO−+H2O⇌HCOOH+OH−,水解平衡常数Kh=c(HCOOH)c(OH−)c(HCOO−)=KwKa,则溶液中c(HCOO−)c(HCOOH)=c(OH−)×KwKa=10−1410−9×1.77×10−410−14=1.77×105,
故答案为:HCOO−+H2O⇌HCOOH+OH−;1.77×105;
(2)①等体积混合后溶液中碳酸根的浓度为2×l0−4mol/L×12=1×l0−4mol/L,要生成BaCO3沉淀需要钡离子浓度为2.6×10−91×10−4mol/L=2.6×l0−5mol/L,故需要BaCl2溶液的最小浓度为2.6×l0−5mol/L×2=5.2×l0−5mol/L,
故答案为:5.2×10−5;
②Ksp(BaSO4)=c(Ba2+)(SO42−)=1.1×10−10;Ksp(BaCO3)=c(Ba2+)c(CO32−)=2.6×10−9,
所以c(CO32−)c(SO42−)=Ksp(BaCO3)Ksp(BaSO4)=2.6×10−91.1×10−10=23.6,
故答案为:23.6。
(1)①电离平衡常数分析可知酸性HCOOH>H2CO3>HCN>HCO3−,酸越弱对应盐的水解程度越强;
②电离平衡常数分析可知酸性HCOOH>H2CO3>HCN>HCO3−,对应盐的水解程度HCOO−
相关试卷
这是一份2021-2022学年河南省豫西名校高二(下)联考化学试卷(3月份)(含答案解析),共19页。试卷主要包含了 设NA为阿伏加德罗常数的值,1mlI2转移的电子数为0, 已知等内容,欢迎下载使用。
这是一份2021-2022学年河南省部分名校大联考高二(上)期末化学试卷(含答案解析),共23页。试卷主要包含了0kJ⋅ml−1,8kJ,4∘C,8kJ⋅ml−1、−890,2kJ的热量,【答案】A,【答案】C等内容,欢迎下载使用。
这是一份2023河南省中原名校高二上学期第二次联考化学试卷PDF版含答案,共16页。









