

2021-2022学年湖南省衡阳市第一中学高二(下)月考化学试卷(5月)(含答案解析)
展开
这是一份2021-2022学年湖南省衡阳市第一中学高二(下)月考化学试卷(5月)(含答案解析),共20页。试卷主要包含了 下列离子方程式正确的是等内容,欢迎下载使用。
2021-2022学年湖南省衡阳市第一中学高二(下)月考化学试卷(5月)
1. 化学与生产、生活密切相关,下列说法正确的是
A. 金属在潮湿的空气中生锈,主要发生析氢腐蚀
B. 工业废水中的Ag+、Hg2+等重金属离子可通过加适量Na2S除去
C. 皮肤被昆虫叮咬后会产生红疹,主要是由于昆虫分泌出来的液体中含有乙酸
D. 明矾和漂白粉常用于自来水的净化和杀菌消毒,均利用了其氧化性
2. 设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.2mol/L的磷酸钠水溶液(仅溶解了磷酸钠)中含有的Na+总数为0.6NA
B. 14.5g正丁烷和29g异丁烷的混合物中非极性共价键总数为2.25NA
C. 标准状况下,11.2L HF中含有的分子总数约为0.5NA
D. 将0.1mol SO2和0.05molO2充入恒容密闭容器中充分反应,生成的SO3分子总数为0.1NA
3. 对于反应3A(g)+B(g)⇌4C(g)+2D(g),测得4种条件下的反应速率分别为①v(A)=0.9mol⋅L−1⋅s−1、②v(B)=24mol⋅L−1⋅min−1③v(C)=1.6mol⋅L−1⋅s−1④v(D)=1.8mol⋅L−1⋅min−1,则上述4种条件下的反应速率大小关系正确的是
A. ②>④>③>① B. ②>①>④>③ C. ②=③>①>④ D. ②=③>④=①
4. 下列关于物质结构的说法错误的是
A. I3AsF6晶体中存在I 3+,I 3+的几何构型为V形
B. CH4和NH 4+都是正四面体结构键角均为109∘28′
C. 氨基氰(NH2CN)分子内σ键与π键数目之比为2:1
D. 甲醛(HCHO)的键角约为120∘,分子之间存在氢键
5. 一定温度下,在某恒容密闭容器中,对于可逆反应aN(g)+bM(g)cR(g)的下列叙述中,能作为判断该反应达到平衡状态标志的是
A. n(N):n(M):n(R)=a:b:c
B. 混合气体的密度不再随时间而改变
C. 单位时间内,每消耗a mol N的同时生成b mol M
D. 混合气体的总质量不再随时间而改变
6. CH4和CO2都是比较稳定的分子,科学家利用电化学装置实现两种分子的耦合转化,其原理如图所示,两电极均为惰性电极,下列说法正确的是
A. 电池工作时,O2-往电极R移动
B. M为电源的负极
C. 电极R上发生的电极反应为CO2-2e-=CO+O2-
D. 相同条件下,若生成的C2H4和C2H6的体积比为4:3,则消耗的CH4和CO2的体积比为14:11
7. 下列离子方程式正确的是
A. 铝粉与NaOH溶液反应:2Al+2OH-+2H2O=2AlO2-+3H2↑
B. 铜溶于稀硝酸:Cu+2H++NO3-=Cu2++NO2↑+H2O
C. 用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
D. 大理石溶于醋酸:CaCO3+2H+=Ca2++H2O+CO2↑
8. 关于化学式为[TiCl(H2O)5]Cl2⋅H2O的配合物,下列说法中正确的是
A. 配体是Cl−和H2O,配位数是9
B. 中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C. 内界和外界中Cl−的数目比是1:2
D. 加入足量AgNO3溶液,所有Cl−均被完全沉淀
9. W、X,Y,Z为原子序数依次增大的短周期主族元素,四种元素的核外电子总数满足X+Y=W+Z,化合物XW3与WZ相遇会产生白烟。下列说法错误的是
A. 最简单氢化物的沸点:Z>X
B. 仅含W和X两种元素的化合物也有可能是离子化合物
C. 由Y和Z两种元素所形成的化合物YZ,可用作食品的防腐剂
D. 由W、X,Z三种元素所形成的化合物中,可能既含离子键又含共价键
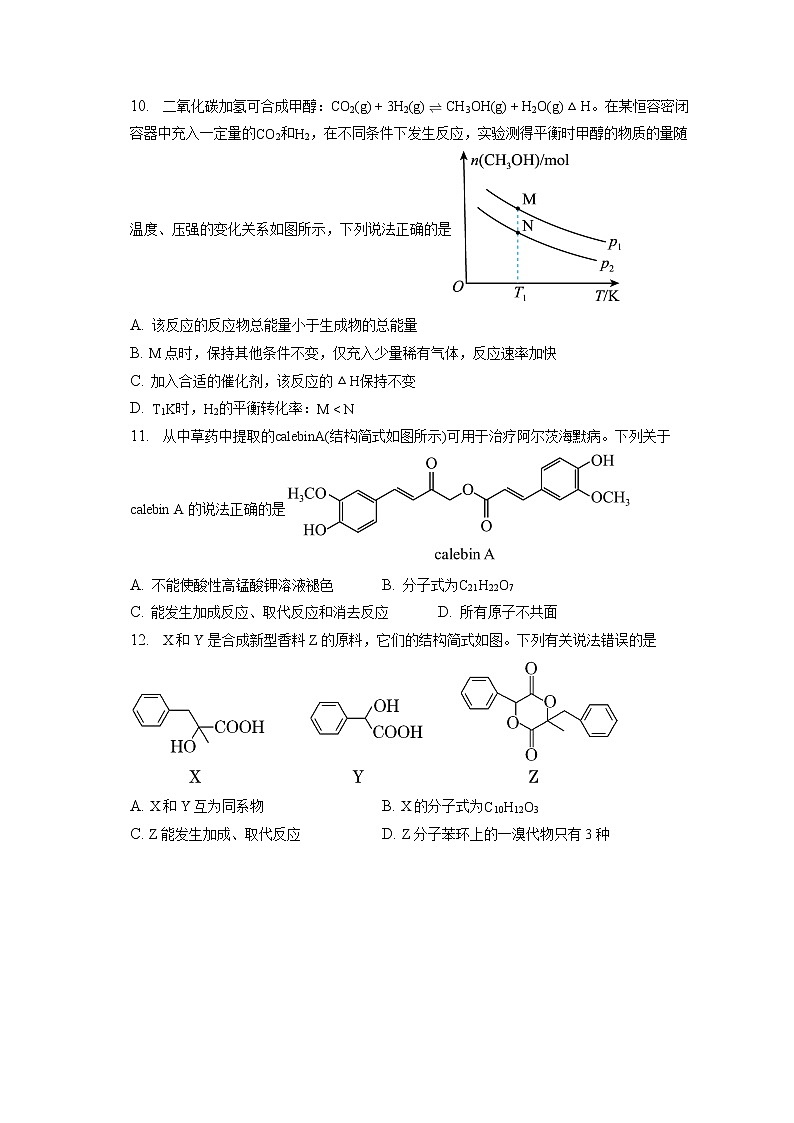
10. 二氧化碳加氢可合成甲醇:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H。在某恒容密闭容器中充入一定量的CO2和H2,在不同条件下发生反应,实验测得平衡时甲醇的物质的量随温度、压强的变化关系如图所示,下列说法正确的是
A. 该反应的反应物总能量小于生成物的总能量
B. M点时,保持其他条件不变,仅充入少量稀有气体,反应速率加快
C. 加入合适的催化剂,该反应的△H保持不变
D. T1K时,H2的平衡转化率:MZ,A错误;
B.由分析可知,W为H,X为N,仅含W和X两种元素的化合物也有可能是离子化合物如NH5即NH4H,B正确;
C.由分析可知,Y为Na,Z为Cl,则由Y和Z两种元素所形成的化合物YZ即NaCl,可用作食品的防腐剂,C正确;
D.由分析可知,W为H,X为N,Z为Cl,则由W、X,Z三种元素所形成的化合物即NH4Cl中,可能既含铵根离子和氯离子键的离子键,铵根离子内部又含共价键,D正确;
故答案为:A。
10.【答案】C
【解析】
【分析】温度升高甲醇物质的量减少,说明反应放热,升温平衡逆向移动,据此分析解题。
【详解】A.反应放热,该反应的反应物总能量高于生成物的总能量,A错误;
B.恒容密闭容器,M点时,保持其他条件不变,仅充入少量稀有气体,反应物浓度不变,反应速率不变,B错误;
C.加入合适的催化剂,该反应的△H保持不变,因为催化剂不会影响焓变值,C正确;
D.T1K时,甲醇的物质的量M>N,则M消耗的氢气大于N,H2的平衡转化率:M>N,D错误;
答案选C。
11.【答案】D
【解析】
【分析】有机物含有酚羟基、羰基、碳碳双键、酯基,具有酚类、酮、烯烃和酯类的性质,结合苯环、碳碳双键的结构特点解答该题。
【详解】A.含有酚羟基、碳碳双键,都可被酸性高锰酸钾溶液氧化,则能使酸性高锰酸钾溶液褪色,A项错误;
B.根据结构简式和价键原理可得,calebin A的分子式为C21H20O7,B项错误;
C.酚羟基、酯基能发生取代反应,碳碳双键和酚羟基能发生氧化反应,碳碳双键和苯环、羰基能发生加成反应,不能发生消去反应,C项错误;
D.由结构可知,该有机物含有饱和碳原子,饱和碳原子采用sp3杂化,不能使所有原子共面,D项正确;
故答案选:D。
12.【答案】D
【解析】A.X和Y组成和结构相似,相差两个“CH2”基团,互为同系物,A正确;
B.从X的结构简式可知,X的分子式为C10H12O3,B正确;
C.Z的结构中存在苯环可发生加成反应,酯基可发生取代反应,C正确;
D.Z分子中两个苯环不是对称结构,苯环上的一溴代物有6种,D错误;
故选D。
13.【答案】C
【解析】A.电负性一定是O>N>C>H,也可以从各物质之间形成的化合物,谁显负价谁电负性大来判断,A项正确;
B.氮原子有成单键的也有成双键的,因此氮的杂化方式有sp2和sp3两种,B项正确;
C.非金属元素之间存在共价键,阴阳离子之间存在离子键,含有孤电子对和含有空轨道的原子之间存在配位键,由图可知M中含有2个氢键,则该配对电子中含有的化学键有共价键、配位键,不含有离子键,氢键不属于化学键,C项错误;
D.由图可知M中非金属元素原子间形成的σ键有24个π键有4个,因此σ和π的数目比为6:1,D项正确;
答案选C。
14.【答案】D
【解析】A.实验①根据三段式法可知:
K1=c(M)×c(N)c(X)×c(Y)=0.009×0.0090.031×0.001≈2.6
同理实验②根据三段式法可知:
K2=c(M)×c(N)c(X)×c(Y)=0.008×0.0080.002×0.032=1,对比实验①和实验②发现升高温度,K减小,平衡逆向移动,所以逆向为吸热反应,正向为放热反应,即反应物的总能量大于生成物的总能量,A项正确;
B.根据题意建立如下三段式:
该时刻Y的物质的量分数=n(Y)n(X)+n(Y)+n(M)+n(N)×100%=0.060.36+0.06+0.04+0.04×100%=12%,B项正确;
C.实验②和③,温度相同,平衡常数相同,根据A项中已求常数可得实验①和③中,反应均达到平衡时,平衡常数之比为K①K③=8131,C项正确;
D.实验②和③,温度相同,平衡常数相同,通过三段式可得a=0.12
K=a×a(0.2-a)×(0.3-a)=1所以a=0.12,Y的转化率为40%,若④的温度为800℃,恒容体系中,气体体积不变的反应,实验④与③为等效平衡,平衡时Y的转化率为40%,但④的实际温度为900℃,相比较800℃,平衡逆向移动,则Y的转化率T1,且升高温度平衡逆向移动,平衡常数减小,则Kb=Kd>Ka=Kc,B错误;
C.由A项分析可知,T2>T1,温度越高,反应速率越快,即υ(d)H2S>CH4
(3)①.sp2 ②.NO 3−
(4)甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多
(5)①.N、O、Cl ②.6
(6)①.sp3 ②.NH3含有一对孤对电子,而H2O含有两对孤对电子,H2O中的孤对电子对成键电子对的排斥作用较大
【解析】【小问1详解】
Si原子核外有14个电子,根据构造原理可知其基态原子的电子排布式为1s22s22p63s23p2,则Si原子的价电子层的电子排布式为3s23p2。SiCl4分子中Si原子形成4个σ键,没有孤电子对,杂化轨道数为4,Si原子采取sp3杂化。根据题给机理图可知,SiCl4水解的中间体SiCl4(H2O)中Si形成了5个杂化轨道,则中间体SiCl4(H2O)中Si采取sp3d杂化,即②符合题意。故答案为:3s23p2;sp3;②;
【小问2详解】
根据元素周期律,同一周期从左到右第一电离能依次增强,特殊情况是同周期IIA族和VA族元素第一电离能大于相邻元素,C是第IVA族,O是第VIA族,不涉及特殊情况,所以第一电离能的大小:C小于O。H2O分子间有氢键,沸点最高,H2S的相对分子质量大于CH4,故沸点由高到低顺序为H2O>H2S>CH4,故答案为:小于;H2O>H2S>CH4;
【小问3详解】
CO 32−的中心原子C原子的价层电子对数=3+4+2−3×22=3,C原子采取sp2杂化,无孤对电子,空间构型为平面三角形,与其有相同空间结构的−1价无机酸根离子应符合阴离子中心原子价层电子对数为3,孤电子对数为0,带电荷量为−1,代入孤电子对公式可解得其中心原子价电子数为5,符合的化学式可以为NO 3−;故答案为:sp2;NO 3−;
【小问4详解】
水和甲醇均能形成分子间氢键,沸点较高,且1molH2O能形成2mol氢键,1molCH3OH只能形成1mol氢键,物质的量相等时,水比甲醇的氢键多,故水的沸点比甲醇的高,甲硫醇不能形成分子间氢键,其沸点较低,因此甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,故答案为:甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多;
【小问5详解】
[Cr(NH3)3(H2O)2Cl]2+的中心离子为Cr3+,配体为NH3、H2O、Cl−,NH3中N原子提供孤对电子,H2O中O原子提供孤对电子,Cl−中Cl原子提供孤对电子,Cr3+提供空轨道,故提供电子对形成配位键的原子是N、O、Cl;[Cr(NH3)3(H2O)2Cl]2+中含3个NH3,2个H2O,1个Cl−,故中心离子Cr3+的配位数为3+2+1=6,故答案为:N、O、Cl;6;
【小问6详解】
由PH3的空间结构图可知,P与H形成3个共价键,且有1个孤电子对,故价层电子对数为4,故PH3中P的杂化类型是sp3;由NH3和H2O的空间结构图可知,H2O分子中有2个孤电子对,NH3分子中有1个孤电子对,孤电子对数越多,对成键电子对的排斥力越大,键角越小,故H2O的键角小于NH3的,故答案为:sp3;NH3含有一对孤对电子,而H2O含有两对孤对电子,H2O中的孤对电子对成键电子对的排斥作用较大。
19.【答案】(1)①.碳酸二甲酯 ②.聚合反应
(2)羟基
(3)CH3COCH2COOH
(4)CH2=CH3C−CCH3=CH2+C2H2
(5)①.7②.(CH3)2C=CHOOCH
(6)①.HOOC(CH2)4COOH②.CH2OHCH2OH③.
【解析】
【分析】A为乙炔,乙炔与M生成B,B→C发生氧化反应,根据信息③可知B为 ,B氧化为C,C为CH3COCH2COOH,C→D发生羰基与氢气的加成, D→E发生醇的消去,D为CH3CH(OH)CH2COOH,根据有机树脂玻璃的结构简式可知F为CH3CH=CHCOOCH3,E为CH3CH=CHCOOH,由信息反应可知I为 ,结合信息④可知乙为HOCH2CH=CHCH2OH,据此分析解题。
【小问1详解】
的化学名称为碳酸二甲酯,根据题干反应过程可知F→G发生聚合反应;
【小问2详解】
I的结构简式 ,I具有的官能团名称为羟基;
【小问3详解】
据分析可知C的结构简式为CH3COCH2COOH;
【小问4详解】
根据信息③可知,M+A→B的化学方程式为:CH2=CH3C−CCH3=CH2+C2H2;
【小问5详解】
F的同分异构体中,与F具有相同官能团且能发生水解反应和银镜反应,说明含有酯基和醛基,其同分异构体为:CH3CH2CH=CHOOCH、CH3CH=CHCH2OOCH、CH2=CHCH2CH2OOCH、CH2=CCH3CH2OOCH、 (CH3)2C=CHOOCH、CH2=CHCHCH3OOCH、CH3CH=CCH3OOCH,共有7种,其中核磁共振氢谱显示3组峰,且峰面积之比为6:1:1的有机物的结构简式为:(CH3)2C=CHOOCH;
【小问6详解】
CH2BrCH2Br在碱性条件下水解为Q:CH2OHCH2OH,环己烯被氧化为P:HOOC(CH2)4COOH,两者发生酯化反应,则R为;
相关试卷
这是一份2021-2022学年普宁市华侨中学高二(下)月考化学试卷(第一次)(含答案解析),共11页。试卷主要包含了 下列有关化学用语正确的是, 下列有关说法正确的是, 下列关于氢键的说法正确的是, 下列分子属于手性分子的是等内容,欢迎下载使用。
这是一份2021-2022学年湖南省长沙市长郡中学高二(下)月考化学试卷(第一次)(含答案解析),共20页。试卷主要包含了 文献记载,8LSO3含分子数为2NA, 下列操作能达到实验目的的是, 我国科学家研究发现, 已知等内容,欢迎下载使用。
这是一份2021-2022学年湖南省邵阳邵东市第一中学高二(下)月考化学试卷(第1次)(含答案解析),共17页。试卷主要包含了 下列化学用语正确的是, 设NA是阿伏加德罗常数的值,72LCCl4中有1等内容,欢迎下载使用。








