



初中化学人教版九年级下册课题2 溶解度课时练习
展开知识精讲
一、固体溶解度
1. 概念
表示在_________下,某固态物质在______溶剂里达到__________时所溶解的______,符号为S。
2. 含义
如“20℃时NaCl的溶解度为36g”的含义为:
在20℃时,100 g水最多能溶解36 g NaCl或在20℃时,NaCl在100 g水中达到饱和状态时所溶解的质量为36 g。
3. 四要素
(1)前提:一定温度下。(物质的溶解度会随温度的变化而变化,若不指明温度,溶解度没有意义。)
(2)标准:100g溶剂里。
(3)状态:达到饱和状态。
(4)单位:克。
及时小练
求下列物质的溶解度:
(1)在20℃时,测得25 g水中溶解9 g氯化钠恰好形成饱和溶液。
(2)在60℃时,测得105 g饱和KNO3溶液中,溶质的质量为55 g。
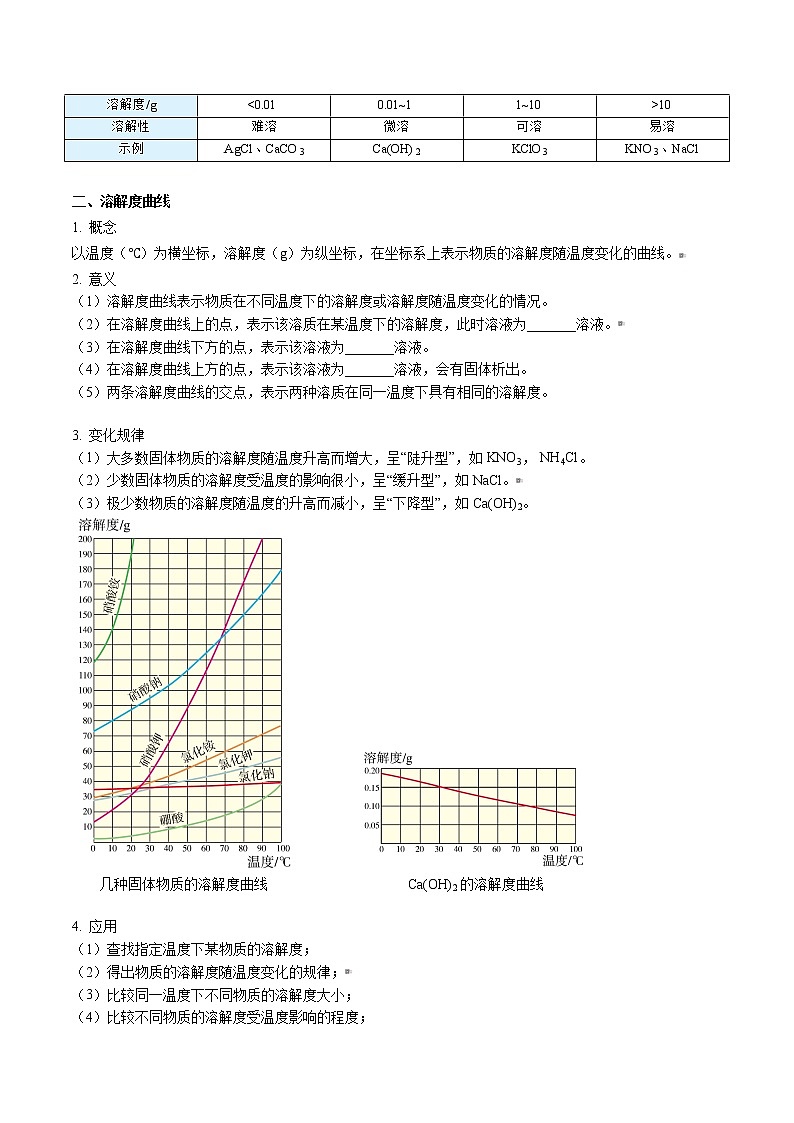
4. 与溶解性的关系
(1)溶解性是说明物质溶解能力的定性方法;
(2)溶解度是衡量某种物质在某种溶剂里溶解性大小的尺度,是溶解性的定量表示方法;
(3)溶解度大小与溶解性的关系如下表所示:
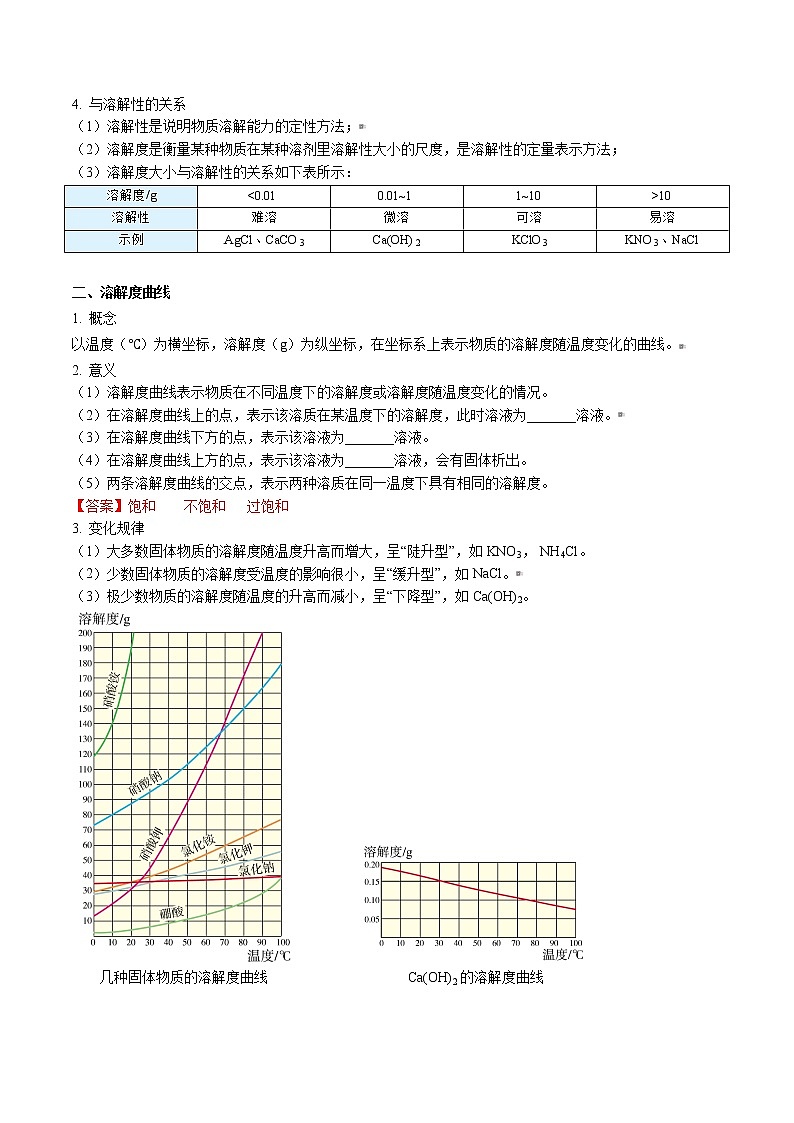
二、溶解度曲线
1. 概念
以温度(℃)为横坐标,溶解度(g)为纵坐标,在坐标系上表示物质的溶解度随温度变化的曲线。
2. 意义
(1)溶解度曲线表示物质在不同温度下的溶解度或溶解度随温度变化的情况。
(2)在溶解度曲线上的点,表示该溶质在某温度下的溶解度,此时溶液为_______溶液。
(3)在溶解度曲线下方的点,表示该溶液为_______溶液。
(4)在溶解度曲线上方的点,表示该溶液为_______溶液,会有固体析出。
(5)两条溶解度曲线的交点,表示两种溶质在同一温度下具有相同的溶解度。
3. 变化规律
(1)大多数固体物质的溶解度随温度升高而增大,呈“陡升型”,如KNO3, NH4Cl。
(2)少数固体物质的溶解度受温度的影响很小,呈“缓升型”,如NaCl。
(3)极少数物质的溶解度随温度的升高而减小,呈“下降型”,如Ca(OH)2。
几种固体物质的溶解度曲线 Ca(OH)2的溶解度曲线
4. 应用
(1)查找指定温度下某物质的溶解度;
(2)得出物质的溶解度随温度变化的规律;
(3)比较同一温度下不同物质的溶解度大小;
(4)比较不同物质的溶解度受温度影响的程度;
(5)确定溶液的状态,是饱和溶液还是不饱和溶液。
思考与交流
(1)硝酸钾溶液中混有少量氯化钠,如何提纯?
(2)氯化钠溶液中混有少量硝酸钾,如何提纯?
三、气体溶解度
1. 定义:在压强为101kPa和一定温度时,气体在1体积水里溶解达到饱和状态时的气体体积。
举个例子——氯化钠的电离
氮气的压强为101kPa和温度为0℃时,1体积水里最多能溶解0.024体积的氮气,则在0℃时,氮气的溶解度为0.024。
2. 影响因素:
(1)内因:气体本身的性质。
(2)外因
①温度:温度越高,气体溶解度_______。
②压强:压强越大,气体溶解度_______。
对点训练
题型一:溶解度的理解
【变1-3】下列关于溶解度的说法,正确的是
A.20 ℃时,100 g水中溶解20 g食盐,则20 ℃时食盐的溶解度为20 g
B.60 ℃时,100 gKNO3完全溶于水中形成饱和溶液,则60 ℃时KNO3的溶解度为100 g
C.36 gNaCl溶于100 g水中刚好形成饱和溶液,所以NaCl的溶解度为36 g
D.20 ℃时,30 gKNO3需要100 g水才能恰好完全溶解,则20 ℃时KNO3的溶解度为30 g
【变1-5】已知X物质与Y物质的溶解度都随温度的升高而增大,200C时,10g水中最多溶解4g X物质,300C时,20g水中最多溶解8g Y物质,则200C时X与Y的溶解度相比是
A.X
【例2】将相同质量的甲、乙两种不同溶质的溶液同时蒸发掉10 g水,并冷却到t ℃时,分别析出2g甲和3g乙物质(均不带结晶水),则下列说法中正确的是
A.t ℃时,甲、乙两种物质的溶解度可能相同
B.t ℃时,甲物质的溶解度一定大于乙
C.t ℃时,甲物质的溶解度一定小于乙
D.将析出晶体后的甲、乙两种饱和溶液混合后(甲、乙不反应),溶液仍饱和
【例3】根据表中氯化钠和硝酸钾部分溶解度数据分析,回答下列问题。
(1)20℃时,氯化钠的溶解度是______g。
(2)硝酸钾的溶解度随温度的升高而______,与硝酸钾相比较,氯化钠的溶解度受温度变化影响______(填“较大”或“较小”)。
(3)20℃时,在100g水中加入40g硝酸钾,充分搅拌后,将溶液温度升高到30℃(不考虑水分蒸发),所得溶液是______(填“饱和溶液”或“不饱和溶液”)。
(4)海水晒盐利用的结晶方法是______,氯化钠适用这一方法结晶是因为______。
题型二:溶解度与溶解性的关系
【例4】20 ℃时,某物质在100 g的水中最多溶解了4 g,则该物质的溶解性属于
A.易溶B.可溶C.微溶D.难溶
【变4】20℃时,1.5克某物质溶于10克水中即达到饱和,则该物质属于
A.微溶物质B.可溶物质C.易溶物质D.难溶物质
题型三:溶解度的影响因素
【变5-1】生活中的下列现象不能说明气体溶解度随温度升高而减小的( )
A.烧开水时,沸腾前有气泡逸出
B.阳光充足时,盛满水的鱼缸璧上有小气泡
C.启开啤酒瓶盖,有大量泡沫溢出
D.夏季黄昏时,池糖里的鱼浮出水面
【例6】打开碳酸饮料瓶盖时,会有大量气泡逸出。小组同学进行实验,探究影响二氧化碳溶解性的因素。
Ⅰ、探究温度和压强对二氧化碳溶解性的影响。
实验1 :标准大气压下,向试管中分别加入100mL某种无色碳酸饮料,大烧杯中加入不同温度的水,小烧杯中加入适量澄清石灰水。
实验2:室温下,向试管中分别加入100mL某种无色碳酸饮料。
【解释与结论】
(1)实验1,欲得出温度对二氧化碳溶解性的影响,依据的现象是试管中产生气泡的速率和______。
(2)实验2的目的是______。
(3)由实验1、2得到的结论是______。
Ⅱ、比较二氧化碳在不同物质中的溶解性。
实验3:烧瓶中收集250mL的气体,分别加入50mL不同液体,通过压强传感器测定瓶中压强变化。(实验前烧瓶内压强为104.20kPa,实验过程中保持温度恒定)
【解释与结论】
(4)实验后瓶内的压强,实验⑧小于实验⑦的原因是______。
(5)实验3的结论是______。
【反思与讨论】
(6)请你利用二氧化碳溶解性知识,解释“打开碳酸饮料瓶盖时,会有大量气泡逸出”的原因______。
题型四:溶解度曲线
【变6】下图是a、b、c、d四种固体物质的溶解度曲线;下表是这些固体物质在特定温度时的溶解度.根据图表信息判断下列说法正确的是
【变7-2】青海省柴达木盆地的察尔汗盐湖是我国最大的天然内陆成水湖,当地农民通过“冬天捞碱,夏天晒盐”获得大量湖盐。
(1)“夏天晒盐”中的“盐”溶解度曲线可用如图中___________来表示。
(2)t1℃时,三种物质的溶解度由小到大关系是___________。
(3)t2℃时将40g的a放入50g水中充分搅拌,所得溶液质量是___________。
(4)不改变溶液浓度,将a的不饱和溶液转化为饱和溶液的方法是___________。
(5)将t2℃时a、b的饱和溶液降温至t1℃时,比较析出溶质的质量大小关系___________。
A.a=bB.a>bC.a
(1)清晨,洋洋佩戴着KN95医用口罩走出了家门,这种口罩可以防止病毒吸入鼻腔,起到了与化学实验中___________操作相同的作用。
(2)吃完午饭,洋洋用洗涤剂清洗饭盒上的油污,这是因为洗涤剂具有___________作用。
(3)下午的化学课上,洋洋看到老师将一瓶汽水的瓶盖打开,汽水自动喷出来了,这是因为___________。
(4)伴着晚霞洋洋回到了家中,晚饭后开始复习有关溶解度曲线内容。如图是甲、乙、丙三种固体物质的溶解度由线,请回答下列问题:
①P点的含义是___________。
②t1℃时,将12克甲物质加入到50克水中,充分溶解后,所得溶液中溶质和溶剂的质量比是___________(写出最简整数比)。
③若甲中含有少量乙,可用___________的方法提纯甲(填“蒸发结晶”或“降温结晶”)。
④将t2℃时等质量甲、乙、丙三种物质的饱和溶液降温到t1℃,所得溶液的质量由大到小的顺序是___________。
提分特训
【题1】20℃时,在10g水中最多溶解0.3gA物质,则A在水中的溶解性为
A.易溶B.可溶C.微溶D.难溶
【题2】如图是a、b、c三种固体物质的溶解度曲线图,下列说法不正确的是( )
A.P点对应的a、c两种溶液中溶质的质量相等
B.升高温度可使接近饱和的c溶液变为饱和溶液
C.t2℃时,将30ga加入50g水中,充分搅拌后得到75g溶液
D.将t2℃时等质量的a、b、c三种饱和溶液分别降至t1℃,析出a最多
【题3】如图为甲、乙、丙三种固体物质的溶解度曲线,下列说法错误的是( )
A.甲中混有少量乙,若要提纯甲,可采取冷却热饱和溶液结晶法
B.t2℃时,丙的饱和溶液中溶质和溶剂的质量比为1:4
C.将t3℃的甲、乙饱和溶液降温到t1℃,析出固体甲的质量一定大于乙
D.在t3℃时,甲、乙两物质的溶解度相等
【题4】下列生活中的现象,与物质溶解性无关的是
A.咸菜长期放置在空气中,有一层“白霜”B.揭开啤酒瓶盖,有大量气泡溢出
C.烧开水时,沸腾前有气泡冒出D.盛石灰水的瓶口有一层白膜
【题5】将50g甲物质加入到50g水中,充分溶解,测得溶液的质量随温度的变化曲线如图所示,下列说法错误的是
A.70°C时,甲的溶解度最大
B.M点对应的甲的溶解度为85g
C.20°C时,甲易溶于水
D.N点对应的是甲的不饱和溶液
【题6】硝酸钾和氯化钾两种物质的溶解度曲线见下图,这两种物质的溶解度见下表。
请回答下列问题:
(1)观察溶解度曲线和溶解度表,判断物质乙是指________(填写化学式)。
(2)60℃时,饱和KNO3溶液中混有少量KCl,应采用________的方法提纯KNO3(填写“蒸发溶剂”或“冷却结晶”)。
(3)60℃时,分别将等质量的KNO3和KCl两种物质的饱和溶液温度降至t ℃,析出晶体的质量关系为:KNO3_____ KCl(填写“>”“=”或“<”)。
(4)如图所示,20℃时,将一定质量的KNO3固体放入盛水的试管中,发现有少量固体未溶解,向烧杯的水中加入某物质后,试管内固体能完全溶解。则加入的物质可以是_____(填写字母标号)。
①冰块 ②生石灰固体 ③硝酸铵固体 ④干冰 ⑤浓硫酸 ⑥氢氧化钠固体
A ①③④ B ②⑤⑥ C ①③⑤ D ②④⑥
(5)60 ℃时,将45g KCl固体溶解于100 g水中,降温至20 ℃,析出晶体的质量是______。
【题7】如图是甲、乙、丙三种固体物质的溶解度曲线。
(1)t2℃时,甲的饱和溶液中溶质与溶液的质量比为_________(填最简整数比)。
(2)t2℃时,甲的饱和溶液中溶质的质量m甲与乙的饱和溶液中溶质的质量m乙相比,两者的大小关系是 。
A.m甲>m乙B.m甲
(4)将t2℃时甲、乙的饱和溶液恒温蒸发等质量的水,析出固体的质量:甲______乙(填><=)。
(5)t2℃时,甲溶液中有少量丙,要提纯甲用__________结晶法。
(6)将t2℃时甲、乙、丙的饱和溶液降温到t1℃所得溶液中溶质的质量分数由大到小的顺序为________。
(7)分别将100g甲,丙的饱和溶液从t2℃降温至t1℃,对所得溶液的描述正确的是
A.甲,丙都是饱和溶液B.所含溶剂质量甲>丙
C.溶液的质量甲>丙D.溶质的质量分数甲>丙
提分作业
【练1】20 ℃时,食盐的溶解度是36 g,它的含义是( )
A.在100 g水中最多溶解36 g食盐
B.20 ℃时,136 g饱和食盐水中含有36 g食盐
C.20 ℃时,饱和食盐水中含有36 g食盐
D.20 ℃时,100 g饱和食盐水中含有36 g食盐
【练2】某温度下,将5 g氯化钠放入110g水中,得到 113.6 g氯化钠溶液,该溶液一定是( )
A.饱和溶液B.不饱和溶液C.稀溶液D.无法判断
【练3】20℃时,食盐的溶解度是36g。20℃时20g食盐放在50g水中充分溶解后,所得溶液的质量是
A.67gB.68gC.69gD.70g
【练4】生活中的下列现象不能说明气体溶解度随温度升高而减小的是
A.打开汽水瓶盖有大量泡沫逸出B.烧水时水沸腾前有气泡逸出
C.喝下汽水打嗝D.夏季黄昏,池塘里的鱼常浮出水面
【练5】将1 g某物质在室温时溶于20 g水中即达饱和,则一般把这种物质划分为( )
A.易溶物质B.可溶物质C.微溶物质D.难溶物质
【练6】如图是氯化钠、硝酸钾两种物质的溶解度曲线。下列说法正确的是
A.硝酸钾的溶解度大于氯化钠的溶解度
B.50℃时,向45g硝酸钾固体中加入50g水充分搅拌,得到95g溶液
C.50℃时,将等质量的硝酸钾、氯化钠两种固体分别配制成饱和溶液,需要水的质量硝酸钾比氯化钠少
D.分别将50℃的硝酸钾、氯化钠的饱和溶液降温至20℃,硝酸钾溶液析出的固体多
【练7】上完体育课后,小明感到又热又渴,他买了一罐“健力宝”饮料,拉开瓶盖,看到有大量的泡沫溢出,原因是______,他赶紧喝了几口后,禁不住打了几个嗝,感到凉爽多了。他打嗝的原因是______。
【练8】如图所示是 a、b、c 三种物质的溶解度曲线,a 与 c 的溶解度曲线相交于 P 点。根据下 图回答:
(1)P 点的含义是___________。
(2)t2℃时 30g a 物质加入到 50g 水中不断搅拌,形成溶液的质量是___________g 此时溶液中溶质和溶剂的质量比是 ___________。
(3)当 a 物质中含有少量 b 物质时,可以用 ___________(填 “蒸发结晶”或“降温结晶”)的方法提纯a.
【练9】溶解度与速度、密度一样,都是控制某变量,度量另一变量,以表达事物固有属性。
(1)20℃时NaCl的溶解度为36g,其含义是_______。
(2)影响固体溶解度大小的因素有 (填字母,下同)。
A.温度B.压强C.溶质、溶剂的种类
D.搅拌E.颗粒大小F.溶质、溶剂的质量
(3)影响固体物质溶解速度快慢的因素有 。
A.温度B.搅拌C.颗粒大小D.振荡
(4)不同温度下,O2的溶解度随压强的变化如图所示,图中t1对应的温度为40℃,则t2对应的温度 。
A.大于40℃B.小于40%C.无法确定
(5)某学生在教师的指导下完成KNO3溶解度的测定实验。
步骤1:分别准确称取3.5g、1.5g、2.0gKNO3.加入药品后发现托盘天平指针偏向右边,则接下来的操作是________。
A.添加KNO3直至天平平衡 B.取出KNO3直至天平平衡
C.改变砝码、游码,直至天平平衡 D.重新调节平衡螺母至天平平衡
步骤2:将3.5gKNO3放入大试管中,并用量筒量取10.0mL蒸馏水于试管内。注意量筒必须放平稳,视线要与液体_______保持水平。
步骤3:振荡大试管,发现有固体未溶解,于是用如下图所示方法进行水浴加热,使固体全部溶解,则此加热方法的优点是________。
步骤4:取出大试管,插入温度计,用玻璃棒轻轻搅拌并摩擦试管壁,同时观察温度计的读数。当刚有晶体析出时,立即记下此时的温度T1。
步骤5:此时在大试管中再加入1.5gKNO3,重复步骤3、4,记录温度为T2;
同样方法,再加入2.0gKNO3实验,记录温度为T3.则T3时KNO3的溶解度为_____g。
实验交流与反思:
交流1:判断溶液的饱和状态是溶解度测量的关键点。欲使接近饱和的KNO3溶液变为饱和溶液的三种方法是_______。
交流2:依据学生实验后绘制的下图溶解度曲线,下列说法正确的是_______。
A.NaCl的溶解度小于KNO3的溶解度
B.分别将b℃时,两种物质的饱和溶液降温至a℃,KNO3溶液析出的晶体多
C.在a℃时若配制等质量的两物质的饱和溶液,KNO3所需的水量多
D.从含有少量NaCl的KNO3中提纯KNO3,可采用降温结晶的方法
溶解度/g
<0.01
0.01~1
1~10
>10
溶解性
难溶
微溶
可溶
易溶
示例
AgCl、CaCO3
Ca(OH)2
KClO3
KNO3、NaCl
温度/℃
0
10
20
30
40
50
60
溶解度/g
NaCl
35.7
35.8
36.0
36.3
36.6
37.0
37.3
KNO3
13.3
20.9
31.6
45.8
63.9
85.5
110
实验装置
实验序号
大烧杯中水的温度
试管中产生气泡的速率
澄清石灰水的现象
实验①
0℃
缓慢
不浑浊
实验②
20℃
适中
不浑浊
实验③
90℃
很快
变浑浊
实验装置
实验序号
注射器活塞的位置
试管中的产生气泡的速率
实验④
不拉动活塞
适中
实验⑤
向上拉活塞到25mL
变快
实验⑥
向上拉活塞到50mL
变得更快
实验操作
实验序号
烧瓶中气体
注射器中物质
实验后瓶内压强
实验⑦
空气
水
130.25 kPa
实验⑧
CO2
水
104.98 kPa
实验⑨
CO2
盐酸
106.67 kPa
实验⑩
CO2
小苏打的水溶液
103.40 kPa
NaCl
KCl
NH4Cl
KNO3
10℃
35.8g
31.0g
33.3g
20.9g
60℃
37.3g
45.5g
55.2g
110.0g
A.图中a曲线表示KNO3的溶解度曲线
B.b的溶解度小于a的溶解度
C.要从a与d的混合物中得到a,通常采用蒸发结晶
D.KCl的不饱和溶液由60℃降温至10℃时变成饱和溶液
温度/℃
10
20
30
40
50
60
溶解度/g
甲
20.9
31.6
45.8
63.9
85.5
110
乙
31.0
34.0
37.0
40.0
42.6
45.5
人教版九年级下册课题3 有机合成材料一课一练: 这是一份人教版九年级下册课题3 有机合成材料一课一练,文件包含课题3有机合成材料教师版-九年级下册化学同步精品讲义人教版docx、课题3有机合成材料学生版-九年级下册化学同步精品讲义人教版docx等2份试卷配套教学资源,其中试卷共24页, 欢迎下载使用。
人教版九年级下册课题2 化学元素与人体健康课后复习题: 这是一份人教版九年级下册课题2 化学元素与人体健康课后复习题,文件包含课题2化学元素与人体健康教师版-九年级下册化学同步精品讲义人教版docx、课题2化学元素与人体健康学生版-九年级下册化学同步精品讲义人教版docx等2份试卷配套教学资源,其中试卷共18页, 欢迎下载使用。
人教版九年级下册第十二单元 化学与生活课题1 人类重要的营养物质课后复习题: 这是一份人教版九年级下册第十二单元 化学与生活课题1 人类重要的营养物质课后复习题,文件包含课题1人类重要的营养物质教师版-九年级下册化学同步精品讲义人教版docx、课题1人类重要的营养物质学生版-九年级下册化学同步精品讲义人教版docx等2份试卷配套教学资源,其中试卷共23页, 欢迎下载使用。













