





高中化学鲁科版 (2019)必修 第二册第3节 元素周期表的应用优秀ppt课件
展开1.以第3周期为例,掌握同周期元素性质的递变规律。2.能运用原子结构理论初步解释同周期元素性质的递变规律。
元素的最高正价取决于原子结构的哪一部分?
最高价氧化物一定可与水直接反应生成对应的水化物吗?
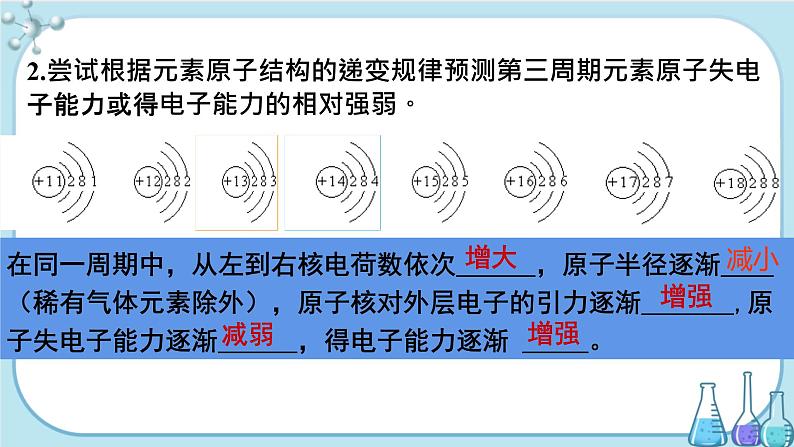
2.尝试根据元素原子结构的递变规律预测第三周期元素原子失电子能力或得电子能力的相对强弱。
在同一周期中,从左到右核电荷数依次 ,原子半径逐渐 (稀有气体元素除外),原子核对外层电子的引力逐渐 ,原子失电子能力逐渐 ,得电子能力逐渐 。
3、元素的原子为什么具有得电子和失电子的倾向?
如果原子的最外层不是8电子或2电子的稳定结构,就可以通过得到或失去电子使最外层达到稳定结构----变为阴离子或阳离子
一:认识同周期元素性质的递变
具体以第三周期元素为例讨论元素的原子得失电子能力的递变规律
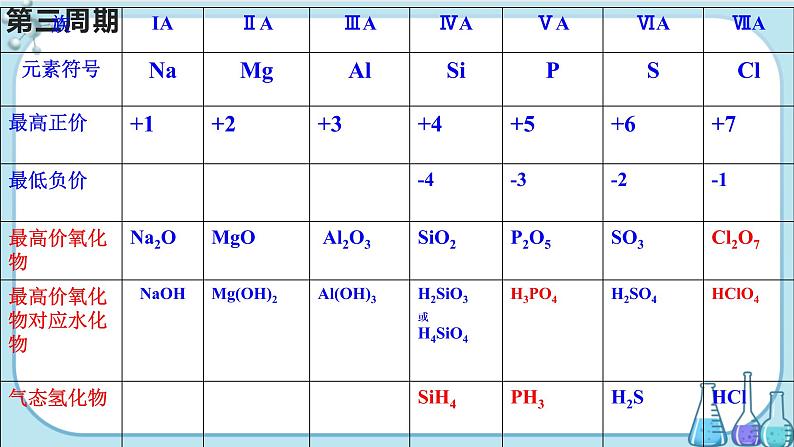
请写出第3周期元素的名称和元素符号
与冷水反应缓慢,加热后反应剧烈
铝与水加热也几乎不反应
最高价氧化物对应水化物碱性的强弱
失电子能力:Na Mg Al
【归纳结论1】同周期元素,从左到右,单质与水或酸反应越来越 ,最高价氧化物对应水化物的碱性越来越 ,失电子能力越来越 。
①比较元素的单质与水(或酸) 反应置换出氢的难易程度。置换反应越容易发生,失电子能力越强,金属元素的金属性也就越强。②比较最高价氧化物对应水化物的碱性强弱。一般说来,碱性越强,失电子能力越强。 ③置换反应(金属活动顺序表)。排在前面的金属活泼性强,更容易失电子。排在前面的金属可以把排在后面的金属从其盐溶液中置换出来。
④比较金属阳离子的氧化性强弱。氧化性越强,则对应金属元素的失电子能力(金属性)越弱。
【交流研讨】: 1.金属元素原子失电子能力(金属性)的判断依据(事实)有:
【例1】研究表明26Al可以衰变为26Mg,可以比较这两种元素金属性强弱的方法是 。A.比较这两种元素的单质的硬度和熔点B.在氯化铝和氯化镁的溶液中分别滴加过量的氢氧化钠溶液C.将打磨过的镁带和铝片分别和热水作用,并滴入酚酞溶液D.将空气中放置已久的这两种元素的单质分别和热水作用E. Al3+得电子的能力比Mg2+强
【探究2】硅、磷、硫、氯原子得电子能力的相对强弱
阅读课本,比较硅、磷、硫、氯原子得电子能力的相对强弱。
Cl> S > P > Si
【归纳总结】同周期元素,从左到右,最高价氧化物对应水化物的酸性越来越 ,单质与氢气反应越来越 ,气态氢化物的稳定性越来越 ,得电子能力越来越 。
①比较元素的单质与氢气化合的难易。反应越容易发生,得电子能力越强。②比较氢化物的稳定性。氢化物越稳定,得电子能力越强。 ③比较最高价氧化物对应水化物的酸性强弱。一般说来,酸性越强,得电子能力越强。④互相置换反应。非金属性强的元素可以把非金属性弱的元素从其盐中置换出来。
【交流研讨】:2. 你知道判断元素的原子得到电子能力(非金属性)的强弱依据(事实)有哪些吗?
⑤非金属阴离子的还原性强弱。还原性越强,其对应的非金属元素的得电子能力(非金属性)越弱。
【例2】下列有关叙述,能说明M比N的得电子能力(非金属性)强的是 ① 非金属单质M能从N的化合物中置换出非金属单质N。② M的阴离子比N的阴离子容易失电子。 ③ 单质M跟H2反应比N跟H2反应容易得多。④ 气态氢化物水溶液的酸性HmM>HnN。 ⑤ 最高价氧化物对应水化物的酸性HmMOx>HnNOy。 ⑥ 熔点M>N⑦在非金属元素化合物MxNy中M为正价,N为负价。
【思考】同周期元素的原子得失电子能力递变的原因是什么呢?
同周期元素电子层数相同,但从左到右核电荷数依次增加,原子半径逐渐减小,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,得电子能力逐渐增强。
【练习】下列有关元素性质的递变规律正确的是( ) A. 第3周期非金属元素含氧酸的酸性从左到右依次增强 B. HCl、H2S、PH3的稳定性逐渐减弱 C. 第3周期自左往右原子和离子半径均依次减小 D. 向MgCl2溶液中加入金属钠发生 2Na+MgCl2== 2NaCl+Mg , 所以金属性 : Na>Mg
【本节知识归纳】同周期元素性质的递变规律:
白色胶状物,难溶于水,能凝聚水中的悬浮物,并能吸附色素。 可作净水剂。
Al(OH)3在医学上的应用——治疗胃酸过多
1、氢氧化铝的物理性质
氢氧化铝溶于氢氧化钠溶液
2、氢氧化铝的化学性质
结论: Al(OH)3既溶于盐酸又溶于氢氧化钠溶液。
Al(OH)3 +3H+==Al3++3H2OAl(OH)3 +OH-==[Al (OH)4]-
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物。
Cu(OH)2、Fe(OH)3受热分解的化学方程式?
氢氧化铝可用作阻燃剂,受热分解时吸收热量,同时生成耐高温的氧化铝和水蒸气,起到防火作用。
氧化铝固体受热易分解:
3、氢氧化铝的制取方法
用可溶性铝盐溶液与氨水反应
Al3+ +3 NH 3 · H2O = Al(OH)3 ↓+ 3 NH 4+
思考:实验室为何不用可溶性铝盐与 NaOH溶液反应制取Al(OH)3 ?
Al(OH) 3会溶于过量的NaOH溶液!
Al(OH)3 +NaOH=Na[Al (OH)4]
化学必修 第二册第3节 元素周期表的应用图片课件ppt: 这是一份化学必修 第二册第3节 元素周期表的应用图片课件ppt,共56页。PPT课件主要包含了NO1,NO2,NO3等内容,欢迎下载使用。
高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教课内容ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 原子结构与元素周期表教课内容ppt课件,共40页。PPT课件主要包含了学习目标导航,任务分项突破,学科素养测评,课堂小结提升,不溶解,提示可以,归纳拓展,SiPSCl,活泼的金属,非金属等内容,欢迎下载使用。
高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用图片ppt课件: 这是一份高中化学鲁科版 (2019)必修 第二册第1章 原子结构 元素周期律第3节 元素周期表的应用图片ppt课件,共41页。PPT课件主要包含了[知识梳理],无色气泡冒出,无现象,不反应,注意对比实验现象,不溶解,NaOH,NaMgAl,SiH4,PH3等内容,欢迎下载使用。













