







- 《电离平衡》第一课时课件PPT+教学设计 课件 29 次下载
- 《电离平衡》第二课时课件PPT+教学设计 课件 34 次下载
- 《水的电离和溶液的PH》第一课时课件PPT+教学设计 课件 31 次下载
- 《水的电离和溶液的PH》第二课时课件+教学设计 课件 22 次下载
- 《水的电离和溶液的PH》第三课时课件+教学设计 课件 24 次下载
《电离平衡》第三课时课件PPT+教学设计
展开(人教版高中化学选择性必修1)
《电离平衡》第三课时 教学设计
课题名 | 《电离平衡》第三课时 |
教材分析 | 电离平衡常数是在学习了化学平衡常数之后,可以进行类比学习。对于判断改变条件电离平衡的移动方向,解释越稀越电离等结论提供了理论依据。 |
教学目标 | 宏观辨识与微观探析:复习化学平衡常数,建立电离平衡常数的概念。 证据推理与模型认知:建构电离平衡常数模型,解释弱电解质在水溶液中发生的变化。 科学探究与创新意识:能应用电离平衡常数模型解决弱电解质在水溶液中电离平衡。 |
教学重点 | 掌握电离平衡常数的概念,建构电离平衡常数模型。 |
教学难点 | 掌握电离平衡常数的概念,建构电离平衡常数模型。 |
教学方法 | 讲解,举例 |
教学准备 | 教师准备:PPT 学生准备:预习课本 |
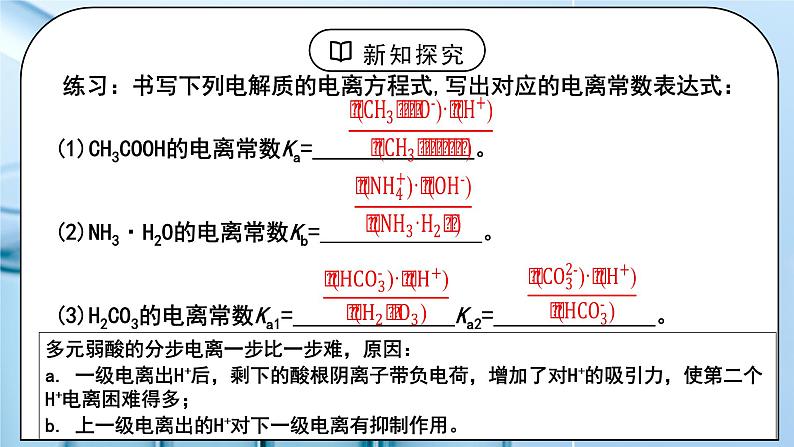
教学过程 | 一、新课导入 1.化学平衡常数: 教师:对于一般的可逆反应:mA(g)+nB(g) ⇌ pC(g)+qD(g),当该反应在一定温度下达到平衡时: 化学平衡常数只与温度有关,与反应物或生成物浓度无关。 对于吸热反应,升高温度,化学平衡常数增大。 学生:回顾化学平衡常数的定义和表达式。 [设计意图]通过回顾化学平衡常数的定义和表达式,引入电离平衡常数的学习。 二、探究新知 1.三、电离平衡常数 教师:1、定义:在一定条件下,弱电解质的电离达到平衡时,溶液中弱电解质电离所生成的各种离子浓度的乘积,与溶液中未电离分子的浓度之比是个常数,这个常数称为电离平衡常数,简称电离常数,用K表示。 Ka表示弱酸(acid)的电离平衡常数 Kb表示弱碱(base)的电离平衡常数 2.表示方法: (1)一元弱酸HA的电离常数:根据HA H++A-, 可表示为 (2)一元弱碱BOH的电离常数:根据BOH B++OH-, 可表示为 c(A -)、 c(B十)、 c(HA)和c(BOH) 均为达到电离平衡时各粒子在溶液中的浓度 (3)多元弱酸、多元弱碱的电离平衡常数 多元弱酸的电离是分步进行的,每步各有电离平衡常数,通常用K1、K2等来分别表示。例如: H2CO3 H++HCO3-
HCO3- H++CO32-
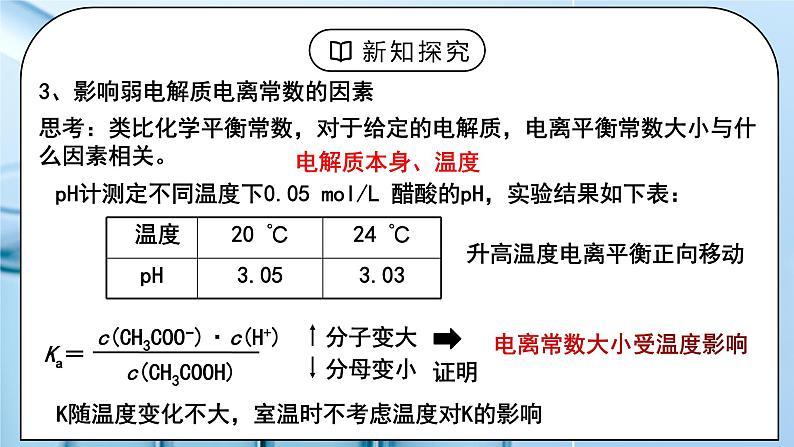
电离常数的大小:Ka1≫Ka2;多元弱酸的酸性主要由第一步电离决定。 由于多元弱碱为难溶碱,所以一般不用电离平衡常数,而用以后要学到的难溶物的溶度积常数。 3、影响弱电解质电离常数的因素 思考:类比化学平衡常数,对于给定的电解质,电离平衡常数大小与什么因素相关。 pH计测定不同温度下0.05 mol/L 醋酸的pH,实验结果如下表: 升高温度电离平衡正向移动 电离常数大小受温度影响 K随温度变化不大,室温时不考虑温度对K的影响 4、电离平衡常数的应用 ①比较弱电解质的相对强弱 K值越大,电离程度越大,酸(或碱)性越强。 酸性: H2SO3>H3PO4>HF>CH3COOH>H2CO3>H2S>HClO 多元弱酸Ka1≫Ka2,计算多元弱酸中的c(H+),或比较多元弱酸酸性的相对强弱时,通常只考虑第一步电离。 ②判断复分解反应能否发生:一般符合“较强酸制较弱酸”规律。 【实验3-2】向盛有2 mL 0.1 mol/L 醋酸的试管中加入等浓度 Na2CO3溶液,观察现象。能否推测出CH3COOH的Ka和H2CO3的Ka1 的大小? 2CH3COOH + Na2CO3 = 2CH3COONa + H2O + CO2↑ 现象:有无色气体产生 实验结论:酸性:CH3COOH > H2CO3 Ka(CH3COOH) > Ka1(H2CO3) ③比较溶液中离子浓度的大小 例:磷酸的三步电离的电离常数,第一步 > 第二步 > 第三步。 在磷酸溶液中 C(H+) > c(H2PO4-) > c(HPO42-) > c(PO43-) > c(OH-) ④判断电离平衡移动的方向 例:若将0.1 mol/L 醋酸加水稀释,使其溶质的浓度变为原来的一半 ,你能判断醋酸电离平衡移动的方向吗? 加水稀释,电离平衡向电离的方向移动 5、电离平衡常数的相关计算 例:在某温度时,溶质的物质的量浓度为0.2mol·L-1的氨水中,达到电离平衡时,已电离的NH3·H2O为1.7×10-3 mol·L-1,试计算该温度下NH3·H2O的电离常数(Kb)。 例:已知25 ℃时,CH3COOH的Ka=1.75×10−5,计算0.2mol·L−1的CH3COOH达到电离平衡时c(H)的浓度(提示:醋酸的电离常数很小,平衡时的c(CH3COOH)可近似视为仍等0.2mol·L−1mol/L。) 练习:25℃,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8。将SO2通入以上氨水中,当c(OH-)降至1.0×10-7 mol·L-1时,溶液中的 c(SO32-)/c(HSO3-) = 补充:利用平衡常数求电离度 例:取1 mL 2 mol/L 醋酸,加水稀释到10 mL,稀释后的溶液,酸的浓度和氢离子浓度分别为多少?(已知25 ℃时,CH3COOH的Ka=1.75×10−5) 学生:练习:书写下列电解质的电离方程式,写出对应的电离常数表达式:(1)CH3COOH的电离常数Ka= (2)NH3·H2O的电离常数Kb= (3)H2CO3的电离常数Ka1= Ka2= 多元弱酸的分步电离一步比一步难,原因: a. 一级电离出H+后,剩下的酸根阴离子带负电荷,增加了对H+的吸引力,使第二个H+电离困难得多; b. 上一级电离出的H+对下一级电离有抑制作用。 练习:已知25 ℃时,几种弱酸的电离平衡常数如下: 请回答下列问题: (1)CH3COOH、H2CO3、HClO、HCO3-的酸性由强到弱的顺序为__________________________________。 (2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为_____________________________。 [设计意图]学习电离平衡常数的相关概念,能进行简单计算。 |
板书设计 | 三、电离平衡常数 1、定义 2.表示方法 3、影响因素 4、应用 ①比较弱电解质的相对强弱 ②判断复分解反应能否发生 ③比较溶液中离子浓度的大小 ④判断电离平衡移动的方向 5、电离平衡常数的相关计算 |
课后作业 |
练习册上相关习题 |
教学反思 | 亮点:从化学平衡常数入手引入电离平衡常数的学习,采用对比的学习方法,通过举例详细讲解了电离平衡常数的应用和计算。 课堂教学建议:本节课内容是有关电离平衡常数的应用和计算,教师应针对考点举例帮助学生理解。 |










