



- 2.2.3化学平衡课件PPT 课件 1 次下载
- 2.3化学反应的方向课件PPT 课件 2 次下载
- 3.2.水的电离和溶液的PH课件PPT 课件 1 次下载
- 3.2.水的电离和溶液的PH (2)课件PPT 课件 1 次下载
- 3.2.水的电离和溶液的PH (3)课件PPT 课件 1 次下载
高中化学人教版 (2019)选择性必修1第一节 电离平衡教学课件ppt
展开[学习目标]1.理解强电解质、弱电解质的概念。 2.能描述弱电解质在水溶液中的电离平衡,正确书写电离方程式。 3.理解一定条件下弱电解质电离平衡移动。 4.了解电离常数的概念、表达式和意义。
判断:①NaCl溶液;②干冰;③液态的醋酸;④铜;⑤BaSO4固体;⑥蔗糖;⑦酒精;⑧熔融的KNO3。(1)以上物质能导电的是: ;(2)以上物质属于电解质的是: ;(3)以上物质属于非电解质的是: ;
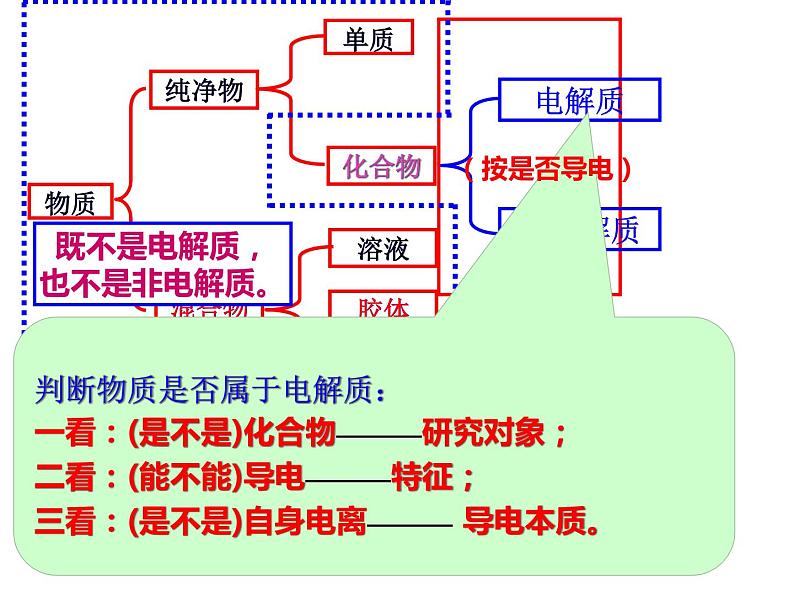
电解质:在水溶液里或熔化状态下能够(自身电离)导电的化合物。
非电解质:在水溶液里和熔化状态下都不能导电的化合物。
注意:(1)单质与混合物既不是电解质又不是非电解质。
在水溶液里或熔融状态下自身能直接电离产生自由移动的离子。
(2)电解质导电的原因(先电离后导电) :
既不是电解质,也不是非电解质。
判断物质是否属于电解质:一看:(是不是)化合物————研究对象;二看:(能不能)导电————特征;三看:(是不是)自身电离———— 导电本质。
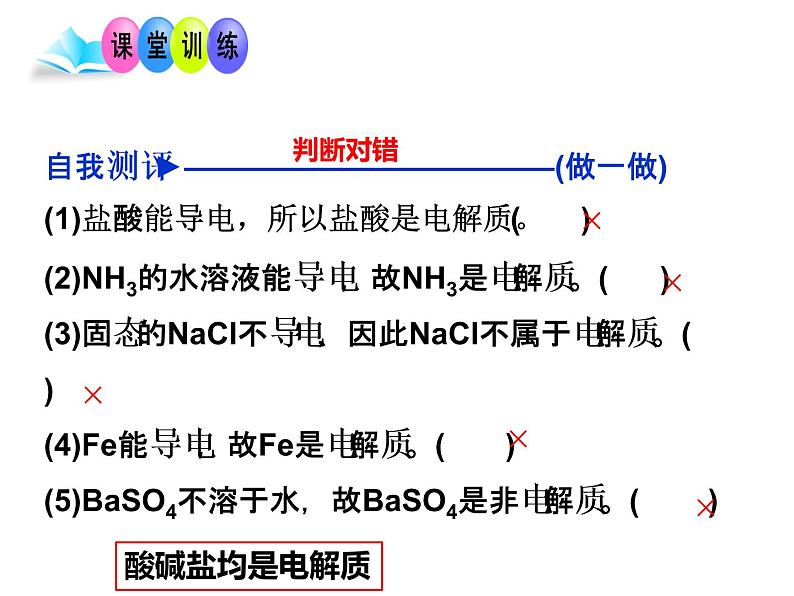
自我测评►————————————(做一做)(1)盐酸能导电,所以盐酸是电解质。( )(2)NH3的水溶液能导电,故NH3是电解质。( )(3)固态的NaCl不导电,因此NaCl不属于电解质。( )(4)Fe能导电,故Fe是电解质。( )(5)BaSO4不溶于水,故BaSO4是非电解质。( )
水溶液中完全电离,无电离平衡。
水溶液中只部分电离,存在电离平衡。
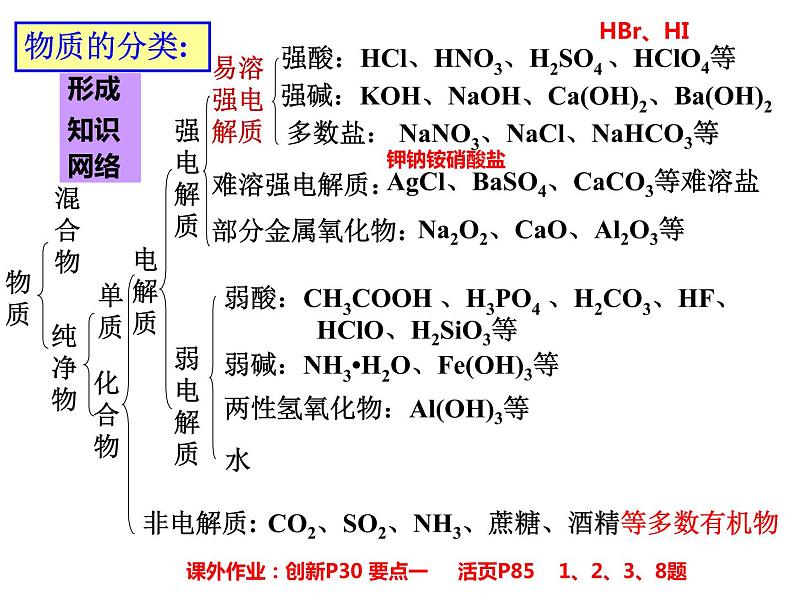
强酸、强碱、绝多数盐、活泼金属氧化物等
弱酸、弱碱、水、极少数盐等
溶质分子与水合离子共存
1、电解质的强弱与其溶解度无关,只与电离程度有关。
2、影响电解质溶液导电能力的主要因素 —— ( 温度)、自由移动离子浓度 、(离子所带单位电荷)
相关概念请在课本p41右上划上记号
强酸:HCl、HNO3、H2SO4 、HClO4等
强碱:KOH、NaOH、Ca(OH)2、Ba(OH)2
多数盐: NaNO3、NaCl、NaHCO3等
弱酸:CH3COOH 、H3PO4 、H2CO3、HF、 HClO、H2SiO3等
弱碱:NH3•H2O、Fe(OH)3等
CO2、SO2、NH3、蔗糖、酒精等多数有机物
AgCl、BaSO4、CaCO3等难溶盐
Na2O2、CaO、Al2O3等
两性氢氧化物:Al(OH)3等
课外作业:创新P30 要点一 活页P85 1、2、3、8题
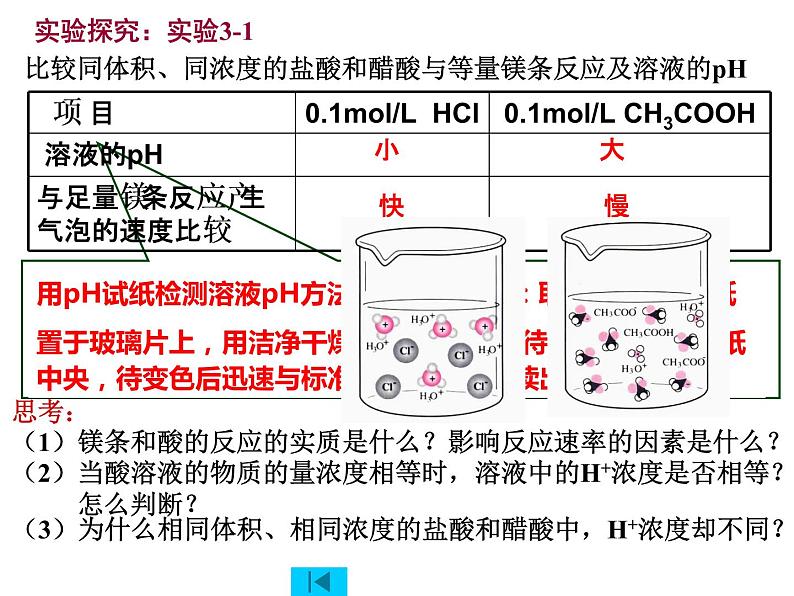
比较同体积、同浓度的盐酸和醋酸与等量镁条反应及溶液的pH
思考:(1)镁条和酸的反应的实质是什么?影响反应速率的因素是什么?
(2)当酸溶液的物质的量浓度相等时,溶液中的H+浓度是否相等? 怎么判断?
(3)为什么相同体积、相同浓度的盐酸和醋酸中,H+浓度却不同?
2、把0.05mlNaOH固体加入打下列100mL液体中,溶液的导电能力变化不大的是()离子浓度和离子电荷A、自来水 B、0.5ml/L盐酸 C、 0.5ml/L醋酸溶液 D、0.05ml/L氨水
练习:写出KAl(SO4)2 、 NH4HCO3 、NaHSO3在水中的电离方程式。
1、弱电解质的电离方程式
注意:多元弱酸电离 :分步电离,逐级减弱,分步书写, 以一级电离为主;
多元弱碱电离:分步电离,逐级减弱,一步书写;
强酸酸式盐完全电离:NaHSO4=Na++H++SO42-
注:熔融态时,NaHSO4(熔融)=Na++HSO4-
变 —— 条件改变,平衡移动
定 —— 溶液中离子浓度和分子浓度保持不变
逆 —— 离子化与分子化的过程可逆
等 —— v(电离)___v(结合)___0
2、电离平衡的定义: 一定条件下,弱电解质分子电离成离子的速率和离子重新 结合成弱电解质分子的速率相等时的状态叫电离平衡
化学平衡的特征及有关原理同样适用于电离平衡
当改变影响平衡的某一条件时,将体系中的变化情况填写下表:
讨论:定温下,醋酸溶液中有电离平衡
CH3COOH CH3COO- + H+
(2)加入与弱电解质电离出的离子发生反应的离子,电离平衡正向移动,电离程度增大。
(1)向溶液中加入与弱电解质电离有相同离子的强电解质, 使电离平衡向逆方向移动。
(二)影响电离平衡的因素
2、浓度:(1)增大弱电解质溶液浓度,
1、温度:升温,电离平衡向电离方向移动。
内因:弱电解质本身的性质
(因电离过程吸热,相当于破坏化学键。)
(2) 通常加水稀释弱电解质溶液时,
弱电解质分子和电离生成的离子浓度都减小。
(勒夏特列原理也适用于电离平衡)
越热越电离(升温促进电离)
电离平衡向电离方向移动, 溶液中弱电解质分子和电离生成的离子浓度都增大。
越稀越电离(稀释促进电离)
电离平衡向电离方向移动,
1、某一元强酸X和某一元弱酸Y的水溶液中,c(H+)均为1×10-2ml·L-1,各取这两种溶液10mL分别与足量金属镁反应。下列叙述中正确的是( ) A、产生H2量:X>Y B、反应消耗镁的量:X
3、石灰乳悬浊液中存在下列平衡向一定量的此悬浊液中加入少量生石灰,维持温度不变,下列说法中正确的是( ) A、Ca(OH)2 溶解度减小 B、c(Ca2+)增大 C、溶液中c(OH-)不变 D、溶液中OH-数目不变
4、在室温下,冰醋酸加水稀释过程中,溶液导电能力I随加入水量(V表示体积)的变化曲线如右图所示,请回答:(1)“Q”点导电能力最差的原因是( );(2)a、b、c三点处,溶液中c(H+)由小到大的顺序( ), 离子数由小到大的顺序是( );电离度最大的是( )。(3)若要使C点处溶液中c(CH3COO-)增大,c(H+)减小,可采取的措施是( )
Q点无溶剂水,没有自由移动的离子。
(提示:溶剂水极难电离,这里可以忽略不计)
加入少量CH3COONa固体
讨论:为何多元弱酸分步电离一步比一步困难?(课本P44T5)
试比较课本P43表3-4中四种弱酸的酸性强弱
首先弱酸酸式根离子要再电离出H+,需要克服阴离子自身对H+的吸引,而且所带电荷越多,需要能量越高,越难电离;其次前一步电离出的H+对后续电离有抑制作用。
【实验3-2】酸性:CH3COOH>H2CO3>H3BO3
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡完美版课件ppt: 这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡完美版课件ppt,共43页。PPT课件主要包含了回顾什么是电解质,旧知回顾,②⑤⑥⑦⑧⑩,①③⑧⑪,情境导入,实验探究,①③⑤⑩,②⑧⑨,水溶液,0最小等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 电离平衡优质课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡优质课ppt课件,共28页。PPT课件主要包含了基础巩固,能力提升等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 电离平衡一等奖ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡一等奖ppt课件,共47页。PPT课件主要包含了第一节电离平衡,知识梳理,正误判断,问题导学,核心突破,试题调研,课后作业等内容,欢迎下载使用。













