





高中化学第四节 化学反应的调控图片课件ppt
展开学习目标: 1.通过工业合成氨适宜条件的选择与优化,认识化学反应速率和化学平衡的综合调控在生产生活和科学研究的重要作用。 2.在合成氨适宜条件的讨论中,形成多角度分析化学反应和化工生产条件的思路,体会化学反应原理的应用价值重点、难点: 合成氨反应中化学反应速率和化学平衡的综合调控
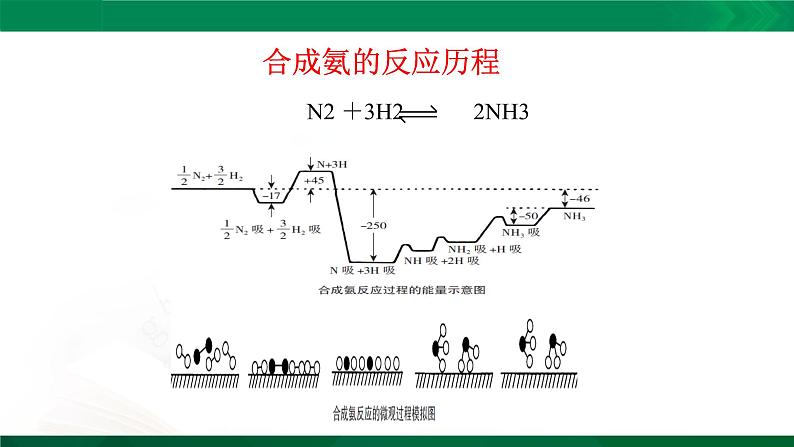
德国化学家哈伯向合成氨发起冲击。1908年7月,他在实验室用氮气和氢气在600 ℃、20 MPa下得到了氨,但是产率只有2%。
工业合成氨的原理是N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·ml-1,从速率角度分析,反应需要在较高 (填“较高”或“较低”)温度下进行,而从提高反应物转化率的角度分析,反应需要在低温、高压(从压强和温度方面回答)条件下进行,原因是合成氨的反应为正反应为气体体积减小的放热反应。
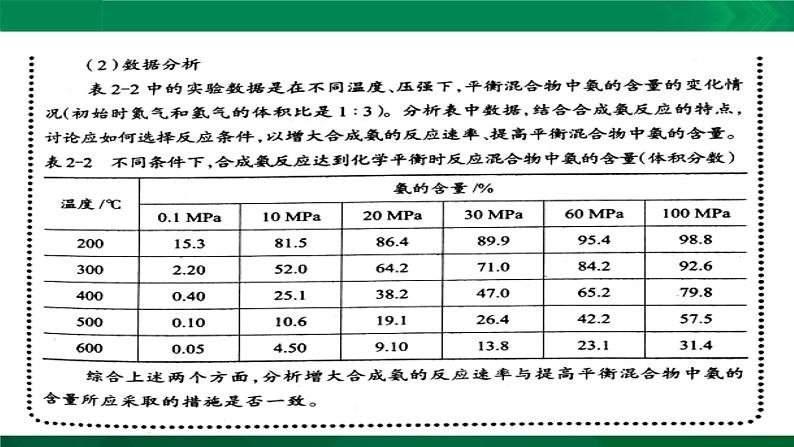
影响因素:(1)增大合成氨反应速率的措施:升高温度、增大压强、增大反应物浓度、使用催化剂等。(2)提高平衡混合气体中氨的含量措施:降低温度、增大压强、增大反应物浓度等。
实现工业生产:综合考虑成本要低!
从化学反应速率与化学平衡考虑,都是压强越大越好。
综合成本与设备耐压:
10 MPa~30 MPa
寻找工业合成氨的适宜条件
增大化学反应速率,不改变平衡混合物的组成。
现在常用铁,其活性最好的温度为500 ℃左右。
低温可以提高平衡混合物中氨的含量,但低温会减小化学反应速率。
综合考虑,特别是考虑催化剂的活性,一般400~500 ℃
选择化工生产适宜条件的分析角度
既不能过快,又不能太慢
既要注意外界条件对速率和平衡影响的一致性,又要注意二者影响的矛盾性
增加易得廉价原料,提高难得高价原料的利用率,从而降低生产成本
如设备承受高温、高压能力等
注意催化剂的活性对温度的限制
合成氨常用的生产条件:
使用催化剂温度:400~500 ℃ 压强: 10 MPa~30 MPa将氨及时分离出来,原料气循环使用
化工生产中调控反应的一般思路
哈伯: 锇(剧毒)作催化剂 、17.5 MPa~20.0 MPa、500~600 ℃ 、氨含量6%
博施: 铁作催化剂 、开发了适合高温、高压下的合成设备、设计了获得大量廉价原料气的方法
(1)自发反应在一定条件下 就能自发进行的反应称为自发反应。(2)熵和熵变的含义①熵的含义熵是衡量一个体系 的物理量。用符号 表示。同一条件下,不同物质有不同的熵值,同一物质在不同状态下熵值也不同,一般规律是S(g) S(l) S(s)。②熵变的含义熵变是反应前后体系 ,用 表示,化学反应的ΔS越大,越有利于反应 。
二、化学反应方向的判断
(3)判断化学反应方向的判据ΔG=ΔH-TΔSΔG<0时,反应 自发进行;ΔG=0时,反应达到 状态;ΔG>0时,反应 自发进行。
(1)温度越高越利于合成氨反应平衡正向移动。 ( )(2)合成氨反应中,压强越大越利于增大反应速率和平衡正向移动。 ( )(3)使用催化剂能提高合成氨反应物的平衡转化率。 ( )(4)充入的N2越多越有利于NH3的合成。( )(5)恒容条件下充入稀有气体有利于NH3的合成。( )(6)工业合成氨的反应是熵增加的放热反应,在任何温度下都可自发进行。( )
1.判断正误(正确的打“√”,错误的打“×”)
2.在合成氨时,要使氨的产率增大,又要使化学反应速率增大,可以采取的措施有( )①增大体积使压强减小 ②减小体积使压强增大 ③升高温度 ④降低温度 ⑤恒温恒容,再充入N2和H2 ⑥恒温恒压,再充入N2和H2 ⑦及时分离产生的NH3 ⑧使用催化剂A.②④⑤⑦ B.②③④⑤⑦⑧C.②⑤ D.②③⑤⑧
3.有关合成氨工业的说法中,正确的是( )A.增大H2的浓度,可提高H2的转化率B.由于氨易液化,N2、H2在实际生产中会循环使用,所以总体来说氨的产率很高C.合成氨工业的反应温度控制在400~500 ℃,目的是使化学平衡向正反应方向移动D.合成氨厂采用的压强是10 MPa~30 MPa,因为该压强下铁触媒的活性最大
解析:A项,增大H2的浓度,H2的转化率减小;C项,温度控制在400~500 ℃主要是为了兼顾速率与平衡,且500 ℃时催化剂活性最大;D项,压强采用10 MPa~30 MPa主要是考虑对设备材料的要求。
4.硫酸是一种重要的化工产品,目前主要采用“接触法”进行生产。有关接触氧化反应2SO2+O2 2SO3的说法中正确的是( )A.只要选择适宜的条件,SO2和O2就能全部转化为SO3B.该反应达到平衡后,反应就完全停止了,即正、逆反应速率均为零C.在达到平衡的体系中,充入由18O原子组成的O2后,SO2中18O含量减少,SO3中18O含量增多D.在工业合成SO3时,要同时考虑反应速率和反应能达到的限度两方面的问题
解析:该反应为可逆反应,SO2和O2不能全部转化为SO3,A错;达到平衡后反应不停止,正、逆反应速率相等,B错;达到平衡后充入由18O原子组成的O2,平衡正向移动,SO3中18O含量增多,因为反应可逆,SO2中18O含量也增多,C错。
5.某工业生产中发生反应:2A(g)+B(g) 2M(g) ΔH<0。下列有关该工业生产的说法正确的是( )A.工业上合成M时,一定采用高压条件,因为高压有利于M的生成B.若物质B价廉易得,工业上一般采用加入过量的B以提高A和B的转化率C.工业上一般采用较高温度合成M,因温度越高,反应物的转化率越高D.工业生产中常采用催化剂,因为生产中使用催化剂可提高M的日产量
解析:工业上合成M可能采用常压,如H2SO4工业中SO3的生成;加入过量B只能提高A的转化率,B的转化率降低;温度升高,平衡逆向移动,反应物的转化率降低;使用催化剂可降低反应的活化能,提高反应速率。
6. 在硫酸工业中,通过下列反应使SO2氧化成SO3:2SO2(g)+O2(g) 2SO3(g) ΔH=-198 kJ·ml-1。(已知催化剂是V2O5,在400~500 ℃时催化效果最好)下表为不同温度和压强下SO2的转化率(%):
人教版 (2019)选择性必修1第四节 化学反应的调控优秀课件ppt: 这是一份人教版 (2019)选择性必修1第四节 化学反应的调控优秀课件ppt,共22页。PPT课件主要包含了知识回顾,催化剂,影响平衡的因素,制尿素,制纯碱,制硝酸,制冷剂,合成氨的应用,思考探究,3便宜等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 电离平衡集体备课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡集体备课ppt课件,共20页。PPT课件主要包含了情境导入,知识回顾,课前预习,知识精讲,思考与讨论,学以致用,课堂检测,课堂小结等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第二节 反应热的计算评课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第二节 反应热的计算评课ppt课件,共15页。PPT课件主要包含了这是什么规律,学习任务一盖斯定律,△H=△H1+△H2,殊途同归,1途径角度,反应热,2能量守恒角度,始态S,终态L,CO2g等内容,欢迎下载使用。













