


高中化学人教版 (2019)选择性必修1第二节 反应热的计算评课ppt课件
展开下列数据△H1表示燃烧热吗?Why?
提供: H2O(g)==H2O(l) △H2=-44kJ/ml
H2(g)+1/2O2(g)==H2O(g) △H1=-241.8kJ/ml
H2(g)+1/2O2(g)==H2O(l)
那么,H2的燃烧热△H究竟是多少?如何计算?
△H1+△H2=-285.8kJ/ml
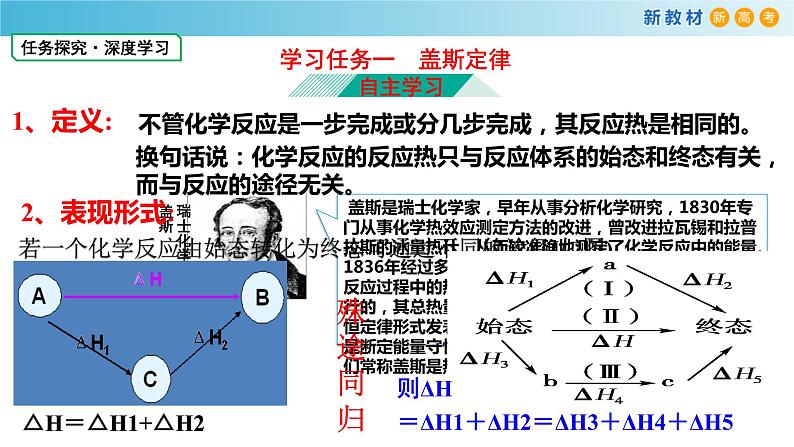
不管化学反应是一步完成或分几步完成,其反应热是相同的。
换句话说:化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关。
若一个化学反应由始态转化为终态可通过不同的途径(如图)
则ΔH=ΔH1+ΔH2=ΔH3+ΔH4+ΔH5
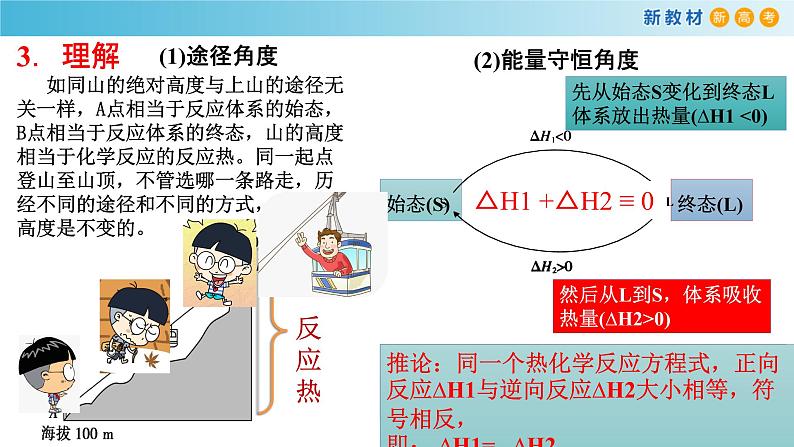
如同山的绝对高度与上山的途径无关一样,A点相当于反应体系的始态,B点相当于反应体系的终态,山的高度相当于化学反应的反应热。同一起点登山至山顶,不管选哪一条路走,历经不同的途径和不同的方式,但山的高度是不变的。
先从始态S变化到终态L 体系放出热量(∆H1 <0)
然后从L到S,体系吸收热量(∆H2>0)
△H1 +△H2 ≡ 0
经过一个循环,体系仍处于S态,因为物质没有发生变化,所以就不能引发能量变化,即∆H1+∆H2=0
推论:同一个热化学反应方程式,正向反应∆H1与逆向反应∆H2大小相等,符号相反,即: ∆H1= –∆H2
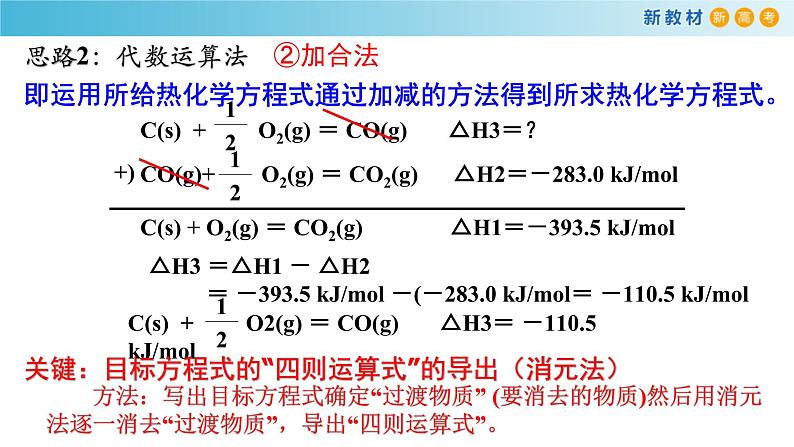
C(s)+ O2(g)
△H1= △H2 + △H3
△H3 =△H1 - △H2
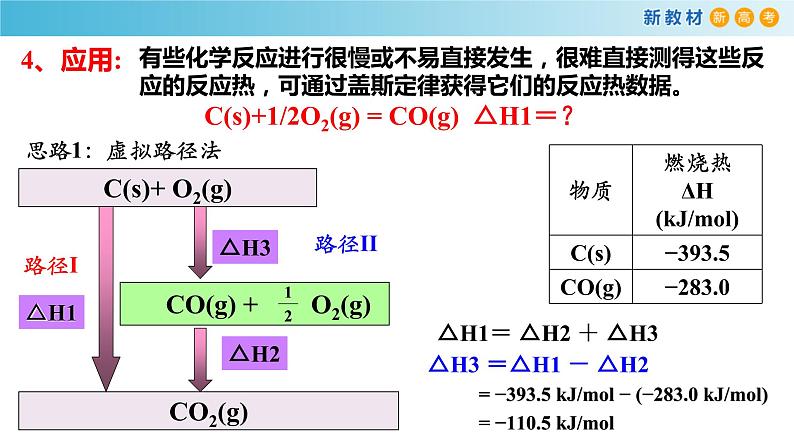
有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
C(s)+1/2O2(g) = CO(g) △H1=?
= −393.5 kJ/ml − (−283.0 kJ/ml) = −110.5 kJ/ml
C(s) + O2(g) = CO(g) △H3=?
CO(g)+ O2(g) = CO2(g) △H2=-283.0 kJ/ml
C(s) + O2(g) = CO2(g) △H1=-393.5 kJ/ml
△H3 =△H1 - △H2 = -393.5 kJ/ml -(-283.0 kJ/ml= -110.5 kJ/ml
即运用所给热化学方程式通过加减的方法得到所求热化学方程式。
关键:目标方程式的“四则运算式”的导出(消元法)
方法:写出目标方程式确定“过渡物质” (要消去的物质)然后用消元法逐一消去“过渡物质”,导出“四则运算式”。
从反应途径角度:A→D:ΔH=ΔH1+ΔH2+ΔH3 =-(ΔH4+ΔH5+ΔH6);从能量守恒角度:ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0。
小结:利用盖斯定律计算反应热的一般步骤
(1) 确定待求方程式(即目标方程式);(2) 以目标方程式为参考,把已知方程式扩大或减小一定的倍数后进行加减消去未出现在目标方程式中的化学式,最后得出待求方程式;(3)把已知ΔH 带正负号进行与上述相同的四则运算规则进行计算即得目标方程式的ΔH 。
【例1】已知 ① CO(g) + 1/2 O2(g) = CO2(g) ; ΔH1= -283.0 kJ/ml ② H2(g) + 1/2 O2(g) = H2O(l) ; ΔH2= -285.8 kJ/ml ③ C2H5OH(l) + 3 O2(g) = 2 CO2(g) + 3H2O(l); ΔH3=-1370 kJ/ml 试计算: ④ 2CO(g)+ 4 H2(g) = H2O(l)+ C2H5OH (l) 的ΔH
【解】:①×2 + ②×4 - ③ = ④ ΔH=ΔH1×2 +ΔH2×4 -ΔH3 =-283.2×2 -285.8×4 +1370 =-339.2 kJ/ml
应用盖斯定律计算反应热时应注意的事项1.热化学方程式中物质的化学计量数同乘以某一个数时,反应热数值也必须乘上该数。2.热化学方程式相加减时,反应热也随之相加 减。3.将一个热化学方程式颠倒时,ΔH的“+”、“-”号必须随之改变。4.若热化学方程式需相减,最好能先把被减方程式进行颠倒,然后相加,更不易出错。
查燃烧热表知:①C(石墨,s)+O2(g)= CO2(g) △H1=-393.5kJ/ml②C(金刚石,s)+O2(g)= CO2(g) △H2=-395.0kJ/ml
解:①- ②得:C(石墨,s)= C(金刚石,s) ; △H=+1.5kJ/ml
例2:写出石墨变成金刚石的热化学方程式 (25℃,101kPa时)
根据盖斯定律书写热化学方程式的方法:
(1)确定待求反应的热化学方程式;(2)找出待求热化学方程式中各物质出现在已知方程式中的位置(是同侧还是异侧);(3)利用同侧相加、异侧相减进行处理;(4)根据未知方程式中各物质的化学计量数通过乘除来调整已知反应的化学计量数,并消去中间产物;(5)实施叠加并确定反应热的变化。
“三步”确定热化学方程式或ΔH
根据待求解的热化学方程式中的反应物和生成物找出可用的已知热化学方程式。
①根据待求解的热化学方程式调整可用热化学方程式的方向,同时调整△H的符号。
②根据待求解的热化学方程式将调整好的热化学方程式进行缩小或扩大相应的倍数,同时调整△H的值。
将调整好的热化学方程式和△H分别进行求△H加和。确定目标反应的焓变△H。
1、已知 ① CO(g) + 1/2 O2(g) = CO2(g) ΔH1= -283.0 kJ/ml ② H2(g) + 1/2 O2(g) = H2O(l) ΔH2= -285.8 kJ/ml ③ C2H5OH(l) + 3 O2(g) = 2CO2(g) + 3 H2O(l) ΔH3= -1370 kJ/ml 计算: 2CO(g)+ 4 H2(g)= H2O(l)+ C2H5OH(l) 的ΔH
得 ④=①×2 + ②×4 - ③
2 CO(g) + O2(g) = 2CO2(g) 2ΔH1= -566.0 kJ/ml4 H2(g) + 2O2(g) = 4 H2O(l) 4ΔH2= -1143.2kJ/ml 2CO2(g) + 3 H2O(l) = C2H5OH(l) + 3O2(g) -ΔH3 = + 1370 kJ/ml
2CO(g)+ 4 H2(g)= H2O(l)+ C2H5OH(l) ΔH =-339.2 kJ/ml
1、已知下列反应的反应热CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1= -870.3 kJ/mlC(s) + O2 (g) = CO2(g) △H2= -393.5 kJ/mlH2(g) + ½ O2(g) =H2O(l) △H3= -285.8 kJ/ml试计算下述反应的反应热:2C(s) + 2H2 (g) + O2 (g) = CH3COOH (l)
解: ④= ②×2 +③×2- ① 2C(s) + 2O2 (g) = 2CO2(g) 2△H2= -787.0 kJ/ml 2H2(g) + O2(g) =2H2O(l) 2△H3= -571.6 kJ/ml +) 2CO2(g)+2H2O(l) =CH3COOH(l)+2O2(g) -△H1= 870.3 kJ/ml ---------------------------------------------------------------------------------------------------------------------------------------- 2C(s) +2H2(l)+O2(g)=CH3COOH(l) △H= -488.3 kJ/ml
N2(g)+2O2(g)==2NO2(g) △H1=+67.2kJ/ml N2H4(g)+O2(g)==N2(g)+2H2O(l) △H2=-534kJ/ml 请写出发射火箭反应的热化学方程式。
2N2H4(g)+ 2NO2(g)==3N2(g)+4H2O(l) △H3=-1135.2kJ/ml
得 ③=②×2 - ①
2N2H4(g)+ 2NO2(g)==3N2(g)+4H2O(l) △H3
2、某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
3、已知25 ℃、101 kPa时:4Fe(s)+3O2(g)==2Fe2O3(s) ΔH=-1 648 kJ·ml-1 ①C(s)+O2(g)==CO2(g) ΔH=-393 kJ·ml-1 ②2Fe(s)+2C(s)+3O2(g)==2FeCO3(s) ΔH=-1 480 kJ·ml-1 ③FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
解析:①×1/2+②×2-③ = -1648 ×1/2+(-393 )×2-(-1480 ) =-130 kJ·ml-1
2FeCO3(s)+1/2O2(g)= Fe2O3(s) + 2CO2(g) ΔH=-130 kJ·ml-1
高中化学人教版 (2019)选择性必修1第一节 电离平衡集体备课ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第一节 电离平衡集体备课ppt课件,共20页。PPT课件主要包含了情境导入,知识回顾,课前预习,知识精讲,思考与讨论,学以致用,课堂检测,课堂小结等内容,欢迎下载使用。
人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡评课课件ppt: 这是一份人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第一节 电离平衡评课课件ppt,共28页。PPT课件主要包含了情境导入,知识回顾,课前预习,知识精讲,分析结果,H2O,CH3COOH,CH3COO−,Cl−,HCl完全电离等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修1第一节 原电池多媒体教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第一节 原电池多媒体教学课件ppt,共1页。













