






人教版化学中考复习--第26课时--实验探究题--(课件)
展开1.明确探究的目的,能根据目的提出探究的问题;2.根据探究问题作出猜想,针对猜想设计实验方案,或对已有的实验方案进行评价;3.进行实验,观察和描述实验现象,或记录实验数据;4.结合方案和现象,进行推理分析得出结论,对猜想进行证实或证伪。
·类型1 有关物质成分的探究
·类型2 有关物质性质的探究
·类型3 有关物质变化影响因素的探究
·类型4 有关反应异常现象的探究
类型1 有关物质成分的探究
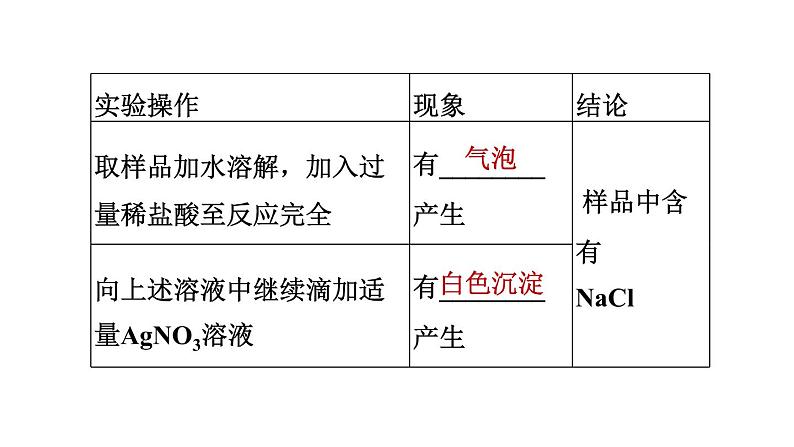
【2022广东】侯德榜是我国制碱工业的先驱,为纯碱和氮肥工业的发展作出了杰出贡献。工业纯碱中可能混有少量NaCl,同学们对工业纯碱样品展开探究。探究一:确定纯碱样品中是否含有NaCl
有同学认为该实验方案有错误,正确方案应选用________(填字母)代替稀盐酸。a.CaCl2溶液 b.稀硝酸 c.BaCl2溶液
探究二:测定纯碱样品中Na2CO3的质量分数【方案1】将样品溶解,加入过量CaCl2溶液,搅拌至反应完全。该反应的化学方程式为____________________________________________。过滤、洗涤、干燥,称量沉淀的质量,计算Na2CO3的质量分数。
CaCl2+Na2CO3===CaCO3↓+2NaCl
【方案2】如图1所示,取样品于锥形瓶中,加入足量稀盐酸。反应结束后,根据干燥管增重计算Na2CO3的质量分数。若结果大于100%,可能的原因是________________________________________________________________________________________________________________________________。
反应过程中生成的CO2中混有水蒸气和氯化氢气体,被氢氧化钠吸收,氢氧化钠也会吸收空气中的CO2和水蒸气
【讨论】上述两个方案中,你认为方案________更优。【拓展】图2为Na2CO3和NaCl的溶解度曲线。为提纯含少量NaCl的纯碱样品,将其浓溶液从t1 ℃冷却至t2 ℃,t1~t2的最优范围是________(填字母)。a.40~10 b.60~30 C.70~40
类型2 有关物质性质的探究
【2022荆州】“天宫课堂”上航天员做的泡腾片实验,让同学们再次感受到化学的魅力。泡腾片中含有碳酸钠或碳酸氢钠等物质,同学们决定对它们的某些性质进行探究。【实验一】:探究碳酸钠和碳酸氢钠溶液的酸碱度。【实验探究1】用pH试纸测得等浓度的碳酸氢钠溶液的pH为9,碳酸钠溶液的pH为11。
【实验结论1】两者均显碱性,且碱性较强的是________。【实验二】探究碳酸钠和盐酸的反应。【实验探究2】向盛有碳酸钠溶液的烧杯中,逐滴加入一定浓度的稀盐酸并充分搅拌,测得pH变化与时间的关系如图1所示。观察到ab段无气泡产生,从b点开始产生气泡。经测定b点溶质只有碳酸氢钠和氯化钠,c点pH为7。
【实验结论2】碳酸钠和盐酸的反应是分两步发生的,ab段发生反应的化学方程式为____________________________,c点溶液中的溶质为__________________。【实验三】探究碳酸钠和碳酸氢钠的热稳定性。【查阅资料】①碳酸氢钠受热分解成碳酸钠、水和二氧化碳;②碳酸钠受热不分解。
HCl+Na2CO3===NaHCO3+NaCl
【实验验证】取一定量的碳酸氢钠放入试管中加热,如图2所示。
【交流反思】试管A管口向下倾斜的原因是_________________________________,试管B中出现____________________现象,证明有二氧化碳生成。【实验结论3】碳酸钠的热稳定性强于碳酸氢钠。
防止反应生成的水倒流使试管炸裂
【拓展应用】溶洞内钟乳石的形成原理与碳酸氢钠受热分解相似——溶有碳酸氢钙[Ca(HCO3)2]的地下水,在遇热或当压强突然变小时,其中的碳酸氢钙会分解成碳酸钙沉积下来,天长日久就形成了千姿百态的钟乳石。请写出碳酸氢钙分解的化学方程式:____________________________________________。
类型3 有关物质变化影响因素的探究
【2022黄石】某化学兴趣小组在学习O2制备时,对MnO2作催化剂加快双氧水分解产生了兴趣,他们提出疑问:其他物质能否对双氧水分解速率产生影响?【查阅资料】影响化学反应速率的因素有很多,如:使用催化剂、改变温度、改变反应物的浓度等。
【实验探究】小组的同学们按图1组装实验装置,在室温下分别进行了四组实验,并用传感器测定实验过程中O2含量的变化情况,得到如图2所示曲线。
【实验结论】对比四条曲线,进行分析:(1)FeCl3溶液、CuSO4溶液对H2O2的分解______(填“有”或“无”)催化作用。(2)写出实验中催化效果最优的使H2O2分解的化学方程式:_________________________________________________。(3)第1组实验的目的是________。
(4)小组的同学们不加催化剂,在不同温度下,用不同浓度的H2O2进行实验,记录实验现象如下表。据此可得出:升高温度或________(填“增大”或“减小”)反应物浓度可加快H2O2的分解。
(5)实验需要30 g 10%的双氧水,可用15%的双氧水加________g蒸馏水配制。
类型4 有关反应异常现象的探究
【2022福州延安中学三模15分】学习小组在进行镁带与酸反应的实验时,发现足量镁带与稀盐酸反应后出现了灰白色沉淀,而与稀硫酸反应后,未有此现象,学习小组对这一异常现象开展探究。【探究一】:探究灰白色沉淀中是否含有过量的镁或反应生成的氯化镁。
(1)①取灰白色沉淀样品,加入____________________,无气泡产生,灰白色沉淀中不含镁。②取等质量的灰白色沉淀和 MgCl2晶体分别放入同温、等量水中,灰白色沉淀不溶解而 MgCl2晶体全部________,灰白色沉淀中不含 MgCl2。【探究二】:探究灰白色固体产生的原因。
用如图 1 所示装置(平底烧瓶已固定)分别进行镁带与稀盐酸、稀硫酸反应的实验,其中镁带与稀盐酸反应的实验现象如表所示。
足量镁带和稀盐酸反应的实验现象:
(2)实验时,使镁条与稀盐酸、稀硫酸反应的操作是_________________________________________________。(3)根据实验现象推测:①产生灰白色沉淀需________(填“酸性”“碱性”或“中性”)条件;②灰白色沉淀产生和________(填离子符号)有关。
将铜丝向下按,使镁带与液体接触
(4)为证实灰白色沉淀中含有Cl-,小赵同学设计了如下实验:过滤,取少量灰白色沉淀,加入足量稀硝酸使其完全溶解,继续滴加______________,出现白色沉淀,他得出结论:灰白色沉淀中含有Cl-。【结论】镁与稀盐酸反应产生灰白色沉淀与溶液中的氯离子有关。
(5)图 2 是两个实验反应过程中烧瓶内压强的变化情况。根据图示可得出:实验中盐酸反应生成的氢气体积________(填“>”“=”或“<”)稀硫酸反应生成的氢气体积;反应结束后,烧瓶内压强减小的原因是__________________________________________________________________。
反应放热,反应结束后不再放热,温度降低
(6)资料显示:灰白色沉淀为碱式氯化镁,它存在多种组成,受热后分解生成 MgO、H2O 和 HCl,为进一步探究灰白色沉淀 Mg2(OH)xCly·nH2O 组成,小组同学设计如下实验。【实验步骤】①组装仪器,______________;
②取 20.65 g Mg2(OH)xCly·nH2O 于 A 中,按图示装入其他药品(均足量);③打开止水夹,缓缓通入一段时间N2后,关闭止水夹;④称量C质量并记录数据为120.0 g;
⑤点燃酒精灯加热至A中固体完全分解,继续通入一段时间N2;⑥称量C质量并记录数据为123.65 g,称量 A 中残留固体质量并记录数据为 8.0 g。
【交流讨论】(7)步骤5通N2的目的是______________________________________________。(8)装置D的作用是______________________________________________。(9)根据计算结果,请完整写出该碱式氯化镁的化学式:______________________________________________。
将A中气体全部赶到B、C装置,使测定数据更准确
防止空气中的水蒸气和二氧化碳进入装置C
Mg2(OH)3Cl·4H2O
1.【2022福建11分】ZB是常用的阻燃剂。已知:Ⅰ.用硼酸(H3BO3)与ZnO、H2O合成ZB,ZB的组成会受温度等合成条件的影响。Ⅱ.ZB受热,先释放出水;当温度高于350 ℃,生成ZnO和B2O3固体;继续升温到400 ℃以上,B2O3熔化为玻璃态物质。
(1)ZB能起阻燃作用的原因是_______________________________________(写一种)。
B2O3熔化成玻璃态物质能隔绝空气(合理即可)
(2)为研究温度对合成的ZB组成的影响,研究小组在不同温度下制取ZB。实验如下:x、y分别为________和________。
(3)为检测102 ℃时合成的ZB含水的质量分数,某同学利用如图1装置(夹持仪器已略)进行实验。需要不断通入干燥空气的目的是____________________________________。②实验时,需要称量获得的数据有:ZB样品的质量、_________________________________的质量。
使产生的水蒸气全部从玻璃直管排出
含ZB样品的玻璃直管加热前后
(4)为评估102 ℃时合成的ZB的阻燃性能,进行木材粉末灼烧残重实验:某温度下,灼烧质量相同的两份干燥的木材粉末(一份经ZB处理)30 min,测量残留固体质量;调整温度,重复实验,得到木材粉末灼烧后固体残留率(w)随温度变化关系如图2。
①低于200 ℃时,两份木材粉末质量均保持不变的原因是____________________。②图中曲线________(填“a”或“b”)对应的木材粉末是经ZB处理的,判断的理由是____________________________________________________。
相同条件下曲线a对应的固体残留率比b的大
(5)为寻找阻燃性能最佳的ZB的合成温度,应开展的实验是_________________________________________________________________________________________________。
在相同条件下,分别取不同温度下合成的ZB,进行木材粉末灼烧残重实验
Ⅰ.设计如图1实验装置,开展氢气还原氧化铜实验并检验固体产物。(1)制取氢气的反应的化学方程式为______________________________________。
Zn+H2SO4===ZnSO4+H2↑
(2)氧化钙的作用是_________________________________。(3)取反应后的红色固体于烧杯中,加入氨水并搅拌,观察到_____________________________,证明固体产物中有Cu2O。
干燥氢气(或吸收氢气中的水蒸气)
红色固体溶解无色溶液变为蓝色
Ⅱ.探究反应生成Cu2O的质量变化情况。称取若干份质量均为0.600 0 g的CuO,在相同条件下分别用氢气还原不同时间(t),检测所得固体产物中Cu2O的质量(m),结果如图2。
(4)由图2可知,在氢气还原氧化铜反应过程中,Cu2O质量的变化趋势是__________________________。(5)为确保氢气还原氧化铜所得固体产物不含Cu2O,应采取的措施是________________________________。
确保加热条件下通氢气时间足够长
(6)结合探究Ⅱ结果计算分析,假设1中“在同一条件下两个反应能同时进行”合理的依据是___________________________________________________________________________________________。
若分步进行,Cu2O的最大质量应为0.540 0 g,不是0.321 8 g
(7)若要确认“假设2”是否合理,在探究Ⅱ的基础上,还需进行的实验是___________________________________________________________________________________________。
隔绝空气加热Cu和CuO混合物,将所得固体放入烧杯,再加氨水并搅拌,观察溶液是否变蓝
3.【2020福建11分】欲证明“CO2与NaOH发生了化学反应”,某化学兴趣小组进行以下探究实验(实验装置中夹持仪器已略去)。【实验1】配制溶液(1)用NaOH固体配制20 g 20%NaOH溶液,无需用到的仪器有________(填标号)。A.胶头滴管 B.酒精灯 C.量筒D.烧杯 E.玻璃棒
【实验2】按图1所示装置进行实验。实验前U形管两端液面相平,将NaOH溶液滴入试管中,恢复到室温后,U形管中的液面左高右低。据此,甲同学得出“CO2与NaOH发生了化学反应”的结论。
(2)U形管中液面高度发生变化的原因是____________________。(3)上述结论的证据不充足,理由是_____________________________________。
CO2可溶于水,与水发生反应
【实验3】按图2所示装置进行实验。查阅资料:ⅰ.CaCl2溶液呈中性;ⅱ.CaCl2+2NaOH===Ca(OH)2↓+2NaCl。实验步骤如下:①检查装置的气密性,往装置中加入药品;
②关闭K1、K2,将注射器中的NaOH溶液缓缓推入A中;③A中物质充分作用后,打开K1,B中无色溶液倒吸入A中,A中产生沉淀且溶液显红色;④关闭K1,打开K2,将注射器活塞向上拉,C中溶液倒吸入A中。
(4)步骤③中“产生沉淀”的现象仍不足以证明CO2与NaOH发生了化学反应,理由是_____________________________________________。
CaCl2与NaOH溶液反应也会产生沉淀
2024贵州中考复习 人教版化学 题型八 实验探究题 课件: 这是一份2024贵州中考复习 人教版化学 题型八 实验探究题 课件,共60页。PPT课件主要包含了专题突破·明技法,贵州五年真题,NaHCO3,Na2CO3,复分解反应,出现水雾,延展性,H2O和O2,把pH计分别伸入,不严密之处是等内容,欢迎下载使用。
安徽中考复习 人教版化学 题型突破 题型五 实验探究题 课件: 这是一份安徽中考复习 人教版化学 题型突破 题型五 实验探究题 课件,共56页。PPT课件主要包含了专题突破·明技法,滤液显蓝色,肯定含有硝酸铜,稀盐酸,产生白色沉淀,HCl+AgNO3,硫酸铜,氯化钡,CuNO32,无色酚酞试液等内容,欢迎下载使用。
人教版中考化学复习题型突破七实验探究题练习课件: 这是一份人教版中考化学复习题型突破七实验探究题练习课件,共60页。PPT课件主要包含了氧化铜和二氧化锰,SO2和H2,Na2CO3溶液,完全变质,紫色石蕊溶液,硝酸银,氯化钠,有气泡产生,其他垃圾,NaCl或氯化钠等内容,欢迎下载使用。












