




人教版化学中考一轮复习--基础梳理--第8课时 金属的化学性质(课件)
展开· 考点1 金属的化学性质
· 考点2 金属活动性顺序
· 考点3 金属与酸反应的曲线分析
· 考点4 金属与盐溶液反应的曲线及滤液、滤渣成分的分析
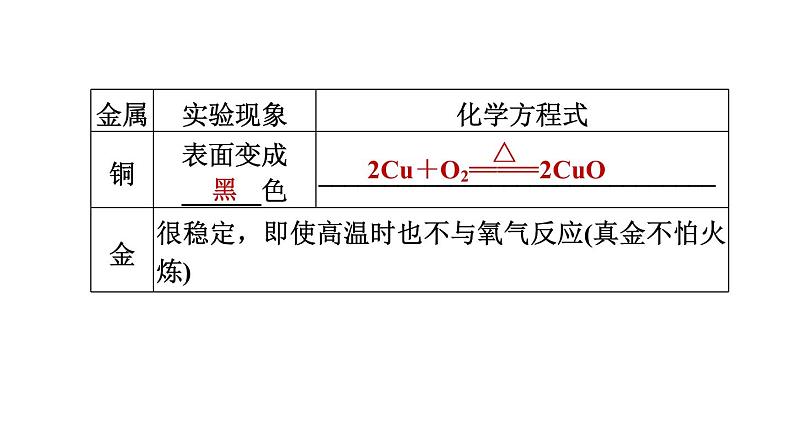
考点1 金属的化学性质【6年5考】
4Al+3O2===2Al2O3
金属+氧气―→金属氧化物(化合反应)
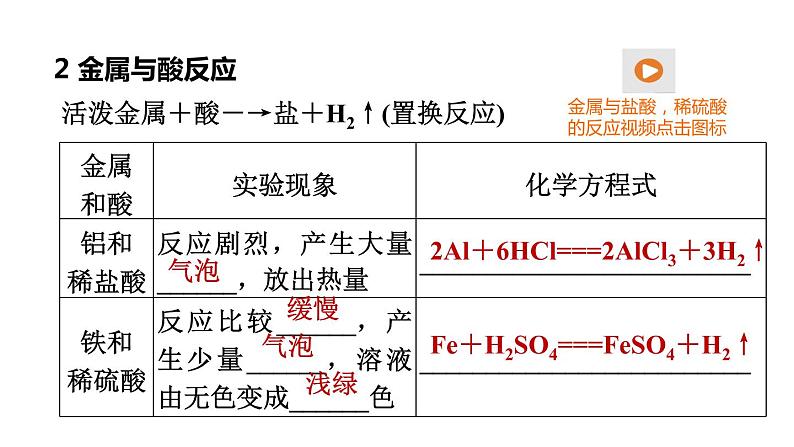
2Al+6HCl===2AlCl3+3H2↑
活泼金属+酸―→盐+H2↑(置换反应)
Fe+H2SO4===FeSO4+H2↑
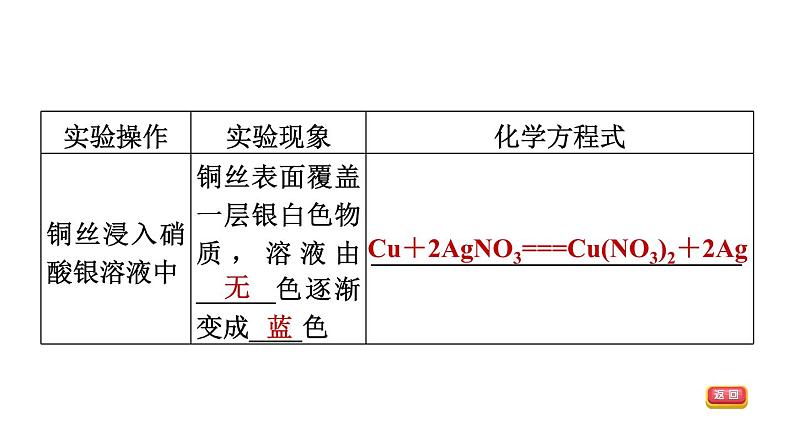
3 金属与盐溶液反应
Fe+CuSO4===FeSO4+Cu
金属+盐―→新金属+新盐(置换反应)
Cu+2AgNO3===Cu(NO3)2+2Ag
考点2 金属活动性顺序【6年4考】
①利用金属在自然界中的存在形式进行判断,以单质形式存在的金属比以化合态形式存在的金属活动性________。②利用金属与酸反应的剧烈程度进行判断。相同条件下,金属与酸反应越剧烈,金属的活动性越________。③利用金属与金属盐溶液的反应进行判断,若能发生反应,说明金属的金属活动性强;若不能发生反应,说明金属盐溶液中的金属的金属活动性强。
(1)比较两种金属活动性强弱例:验证金属活动性顺序Zn>Cu
2 探究金属活动性顺序的实验设计
(2)比较三种金属的活动性顺序例:验证金属活动性顺序Zn>Cu>Ag
硝酸铜溶液(合理即可)
硝酸锌溶液(合理即可)
【注意】在实验前,先将金属进行打磨,以除去金属表面的氧化物或污物。
考点3 金属与酸反应的曲线分析
1 足量酸与等量的金属
等质量的Mg、Al、Zn和等质量、等浓度且足量的酸(以稀硫酸为例)反应,比较生成氢气的质量、速率和反应的酸的质量,设金属的质量为m,通过化学方程式计算(如下所示),补充下表,并在图中补充曲线示意图。例如:金属的质量为m,设产生氢气的质量为x,消耗酸的质量为y。
Mg+H2SO4===MgSO4+H2↑24 98 2 m y x用相同方法可算出Al、Zn与稀H2SO4反应产生的H2和消耗的酸的质量
【小结】酸足量时,生成氢气的质量由金属的种类及质量决定。
2 足量金属与等量的酸
足量的Mg、Al、Zn和等质量、等浓度的酸(以稀硫酸为例)反应,比较生成氢气的质量、速率和反应的金属的质量,设酸的质量为m,通过化学方程式计算,补充下表,并在图中补充曲线示意图。
【小结】酸不足金属过量时,生成的氢气的质量由酸的质量决定。
例:将形状相同的等质量的镁、铁同时分别放入两份相同的稀盐酸中,生成H2的质量与反应时间的关系如图所示。下列分析错误的是( )A.X、Y分别为镁、铁B.两份盐酸均完全反应C.参与反应的镁、铁原子个数比为2∶1D.反应结束时,镁一定有剩余,铁可能有剩余
考点4 金属与盐溶液反应的曲线及滤液、滤渣成分的分析
1 金属与盐溶液反应的曲线
例:铁粉与硫酸铜溶液反应Fe+CuSO4===FeSO4+Cu56 160 152 64溶液质量________ 固体质量________
【思考】锌粉与硫酸铜溶液反应后溶液和固体质量变化与上述曲线是否相同?试着自己画图并分析,溶液质量________,固体质量________。
2 反应后滤渣、滤液的成分分析
金属与盐溶液的反应要遵循“先远后近”(金属活动性顺序表中的位置)的原则,结合反应的程度进行分析。例:将铁片放入Cu(NO3)2和AgNO3的混合溶液中,判断反应后滤液、滤渣的成分。
Fe(NO3)2、Cu(NO3)2、AgNO3
Fe(NO3)2、Cu(NO3)2
归纳总结:滤液中一定存在活动性最强的金属离子,滤渣中一定存在活动性最弱的金属单质。其余物质根据反应程度判断是否存在。
Mg+2HCl===MgCl2+H2↑(合理即可)
Fe+CuSO4===FeSO4+Cu(合理即可)
· 考点1 金属的化学性质(1)
· 考点2 金属活动性顺序(2)
· 考点3 金属与酸反应的曲线分析(3)
· 考点4 金属与盐溶液反应的曲线及滤液、滤渣成分的分析(4)
1.【2021福建3分】据文献报道:一种特殊的铜纳米颗粒具有与金、银极其相似的反应惰性,可替代黄金作精密电子元器件。下列对该铜纳米颗粒的判断,正确的是( )A.能与盐酸反应产生氢气B.在空气中容易锈蚀C.能与硫酸亚铁发生置换反应D.具有良好的导电性
考点1 金属的化学性质
2.【2022三明一检节选3分】我国是钢铁大国,经济的发展离不开钢铁。钢和生铁的区别是__________不同。验证Mg、Fe、Cu三种金属的活动性顺序,可以将打磨好的铁丝分别放入少量的_______(填化学式,下同)溶液和______________________ 溶液中,然后根据实验现象进行判断。
考点2 金属活动性顺序
CuCl2(合理即可)
3.【2022福州一检3分】某实验小组在相同条件下探究金属与酸反应的放热情况,实验装置如图1,实验所用药品如下表。溶液温度随反应时间变化如图2。下列分析错误的是( )
A.实验①对应图2中曲线cB.反应结束后,实验①和②有金属粉末剩余C.实验③能产生0.2g氢气D.图2说明金属越活泼,单位时间内反应放出热量越多
中考化学复习基础梳理第8课时金属的化学性质课件: 这是一份中考化学复习基础梳理第8课时金属的化学性质课件,共36页。PPT课件主要包含了金属与氧气反应,金属与酸反应,金属活动性顺序,教你来探究,无明显现象,ZnCu,CuAg,ZnCuAg,FeNO32,含碳量等内容,欢迎下载使用。
人教版化学中考一轮复习--基础梳理--第10课时 酸和碱(二)(课件): 这是一份人教版化学中考一轮复习--基础梳理--第10课时 酸和碱(二)(课件),共34页。PPT课件主要包含了熟石灰,氢氧化钙的制取,化学性质,Na2CO3+H2O,CaCO3↓+H2O,CaCl2+2H2O,OH-,归纳总结,阳离子,教你来探究等内容,欢迎下载使用。
人教版化学中考一轮复习--基础梳理--第9课时 酸和碱(一)(课件): 这是一份人教版化学中考一轮复习--基础梳理--第9课时 酸和碱(一)(课件),共28页。PPT课件主要包含了不变色,易错辨析,~14,pH试纸,pH的测定方法,标准比色卡,辨析小练,酸碱度的应用,刺激性,黏稠油状等内容,欢迎下载使用。












