




还剩12页未读,
继续阅读
第十单元酸和碱复习课件PPT
展开
这是一份第十单元酸和碱复习课件PPT,共20页。
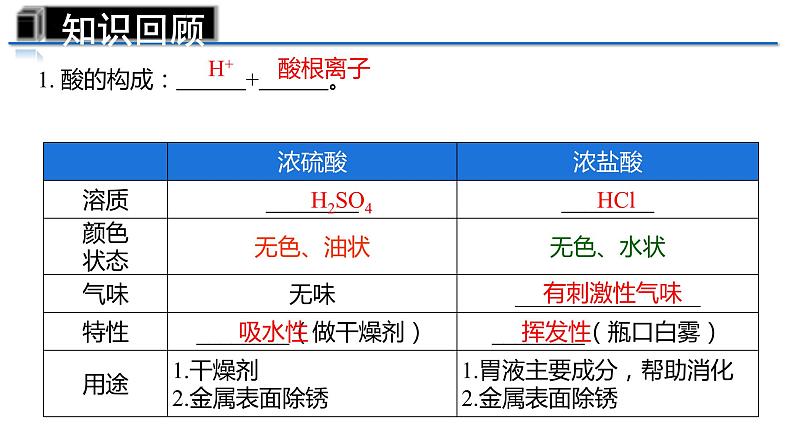
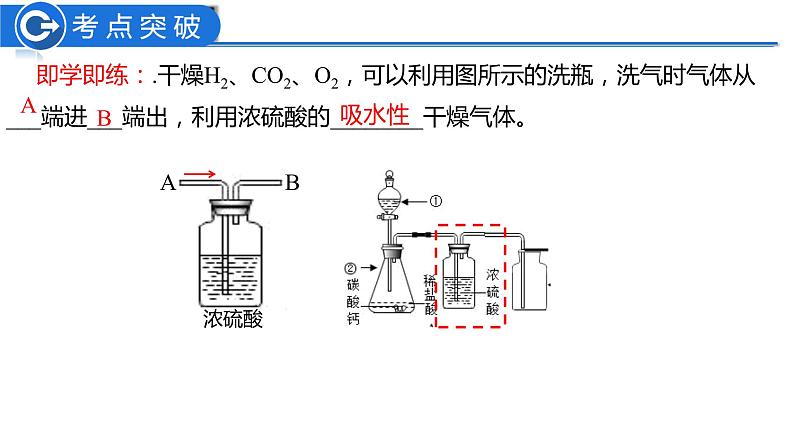
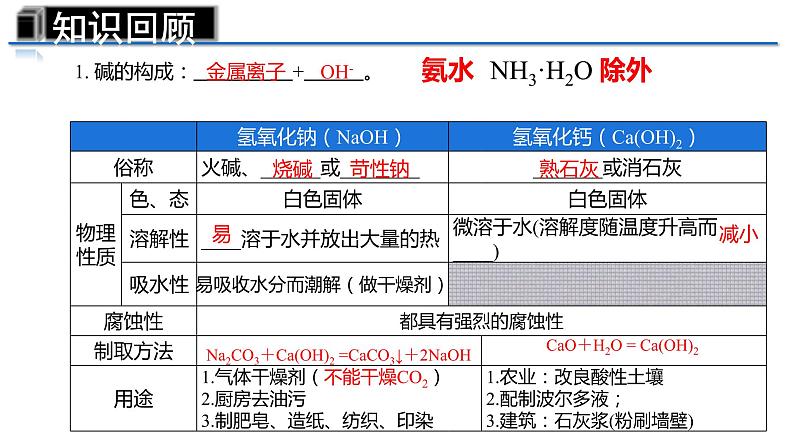
第十单元复习——重温酸碱之旅第一站 ——认识常见的酸和碱【练习2】下列物质属于碱的( )A.盐酸 B.熟石灰 C.生石灰 D.石灰石【练习1】下列物质属于酸的( )A.碳酸 B.硫酸铜C.碳酸钙 D.氢氧化钠考考你1. 酸的构成: + 。H2SO4HCl有刺激性气味吸水性H+ 酸根离子挥发性知识回顾即学即练:.干燥H2、CO2、O2,可以利用图所示的洗瓶,洗气时气体从___端进___端出,利用浓硫酸的________干燥气体。BA吸水性1. 碱的构成: + 。金属离子 OH-烧碱苛性钠熟石灰易减小Na2CO3+Ca(OH)2 =CaCO3↓+2NaOHCaO+H2O = Ca(OH)2氨水 NH3·H2O 除外知识回顾第二站—— 体验酸碱的化学性质:课堂加油站——小组合作 这里有两瓶没贴标签的溶液:氢氧化钙溶液、稀盐酸。根据以下化学试剂,请同学们分组讨论,按要求设计实验方案(看哪组的方案最多)。可能用到的化学试剂与仪器: 酚酞试液、石蕊试液、生锈的铁钉、锌粒、大理石、鸡蛋壳、碳酸钠溶液、pH试纸。药匙、试管、玻璃棒、镊子、玻璃片。紫色石蕊溶液遇酸变 ,无色酚酞溶液遇酸 。(2)酸+金属=__________ 酸的化学性质(酸具有相似化学性质的原因: )(3)酸+金属氧化物=_______红盐+氢气盐+水不变色(1)酸与指示剂的作用Fe2O3 +6HCl=2FeCl3 +3H2OFe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2OMg + H2SO4 = MgSO4+H2↑Mg + 2HCl = MgCl2 + H2↑(4)酸+碱→盐+水NaOH+HCl=NaCl+ H2OCaCO3+2HCl= CaCl2+ CO2 ↑ +H2O(5)酸+盐→新酸+新盐Na2CO3+2HCl=2NaCl+CO2↑+H2OH2SO4 +2NaOH=Na2SO4 +2 H2O溶液中都含有H+活动小结 碱的化学性质(碱具有相似化学性质的原因: )蓝红Na2CO3+H2OCaCO3↓+H2ONa2SO4+2H2OCaCl2+2H2OCu(OH)2↓+Na2SO4溶液中都含有OH-活动小结酸碱盐酸非金属氧化物酸碱指示剂H+OH-酸5条 、碱4条 请记住1.某工业区经常下酸雨导致土壤呈酸性,植物难以正常生长。可采取措施( ) A.在土壤里施加NaOH溶液 B.多浇水 C.撒入适量熟石灰 D.撒入适量石灰石粉末C2.某同学不小心被黄蜂蛰了(黄蜂毒液呈碱性),为了减轻疼痛,可以涂抹下列哪种物质( ) A.浓硫酸 B.食醋 C.食盐水 D.苏打水或肥皂水(呈碱性) B第三站——中和反应及其应用中和反应1.定义: 和 作用生成盐和水的反应叫做中和反应。酸碱2.实质:__ _和__ ___生成 。氢离子氢氧根水H+ + OH- → H2O3.中和反应在实际中的应用①用 改良酸性土壤,中和酸性废水等。②用含 的药物中和过多的胃酸。③蚊虫叮咬可以涂抹 缓解疼痛。 知识回顾当堂训练BA.偏高 B.偏低 C.相等 D.无法确定水湿润后2. 用pH试纸测定石灰水的pH,如图所示,则测得的结果与实际值相比( )1、室温时,下列液体的pH小于7的是( )A.白醋 B.蒸馏水 C.食盐水 D.肥皂水 A 第四站—— 检验溶液酸碱度溶液的酸碱度1.溶液的酸碱度可用 表示。pH范围: 。当pH= 7时,呈中性;2.pH值测定方法——pH试纸(结果为整数)当pH>7时,呈碱性 当pH<7时,呈酸性 pH越小酸性 pH越大碱性 溶液酸碱的强弱程度测定溶液pH的方法:在玻璃片上放一小片pH试纸, 滴在pH试纸上,把试纸显示的颜色与标准的比色卡比较,读出溶液的pH。越强越强用玻璃棒蘸取待测液 知识回顾1.若将pH试纸用水润湿, 测酸性溶液的pH,会导致溶液酸性______,pH______。2.若将pH试纸用水润湿, 测碱性溶液的pH,会导致溶液碱性______,pH______。减弱减弱变大变小当堂训练3.向稀氢氧化钠溶液中滴加稀盐酸至过量,溶液pH变化曲线正确的是( ) A 4.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图。(1)该反应的化学方程式为: 。(2)该实验操作是将____________ 滴加到另一种溶液中。(3)当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式) _______________________。 (4)当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈 色。NaOH + HCl = NaCl + H2O 氢氧化钠溶液NaCl、HCl红 综合提升(2)能观察到上述现象的原因是______________________________________。CO2被吸收,导致容器内压强减小NaOH溶液中含有水,水能溶解CO2,也能与CO2反应将NaOH溶液换成等体积的水,重复上述实验(1)实验的现象为______________。气球变大(3)小明认为,要得到CO2能与NaOH反应的结论,仅凭上述实验不严谨,其理由是___________________________________________________________。(4)要得到科学严谨的结论,且仍利用上述装置,需补做的对比实验是_______________________________________________________。探究CO2与NaOH能否发生化学反应拓展提升
第十单元复习——重温酸碱之旅第一站 ——认识常见的酸和碱【练习2】下列物质属于碱的( )A.盐酸 B.熟石灰 C.生石灰 D.石灰石【练习1】下列物质属于酸的( )A.碳酸 B.硫酸铜C.碳酸钙 D.氢氧化钠考考你1. 酸的构成: + 。H2SO4HCl有刺激性气味吸水性H+ 酸根离子挥发性知识回顾即学即练:.干燥H2、CO2、O2,可以利用图所示的洗瓶,洗气时气体从___端进___端出,利用浓硫酸的________干燥气体。BA吸水性1. 碱的构成: + 。金属离子 OH-烧碱苛性钠熟石灰易减小Na2CO3+Ca(OH)2 =CaCO3↓+2NaOHCaO+H2O = Ca(OH)2氨水 NH3·H2O 除外知识回顾第二站—— 体验酸碱的化学性质:课堂加油站——小组合作 这里有两瓶没贴标签的溶液:氢氧化钙溶液、稀盐酸。根据以下化学试剂,请同学们分组讨论,按要求设计实验方案(看哪组的方案最多)。可能用到的化学试剂与仪器: 酚酞试液、石蕊试液、生锈的铁钉、锌粒、大理石、鸡蛋壳、碳酸钠溶液、pH试纸。药匙、试管、玻璃棒、镊子、玻璃片。紫色石蕊溶液遇酸变 ,无色酚酞溶液遇酸 。(2)酸+金属=__________ 酸的化学性质(酸具有相似化学性质的原因: )(3)酸+金属氧化物=_______红盐+氢气盐+水不变色(1)酸与指示剂的作用Fe2O3 +6HCl=2FeCl3 +3H2OFe2O3 + 3H2SO4 = Fe2(SO4)3 + 3H2OMg + H2SO4 = MgSO4+H2↑Mg + 2HCl = MgCl2 + H2↑(4)酸+碱→盐+水NaOH+HCl=NaCl+ H2OCaCO3+2HCl= CaCl2+ CO2 ↑ +H2O(5)酸+盐→新酸+新盐Na2CO3+2HCl=2NaCl+CO2↑+H2OH2SO4 +2NaOH=Na2SO4 +2 H2O溶液中都含有H+活动小结 碱的化学性质(碱具有相似化学性质的原因: )蓝红Na2CO3+H2OCaCO3↓+H2ONa2SO4+2H2OCaCl2+2H2OCu(OH)2↓+Na2SO4溶液中都含有OH-活动小结酸碱盐酸非金属氧化物酸碱指示剂H+OH-酸5条 、碱4条 请记住1.某工业区经常下酸雨导致土壤呈酸性,植物难以正常生长。可采取措施( ) A.在土壤里施加NaOH溶液 B.多浇水 C.撒入适量熟石灰 D.撒入适量石灰石粉末C2.某同学不小心被黄蜂蛰了(黄蜂毒液呈碱性),为了减轻疼痛,可以涂抹下列哪种物质( ) A.浓硫酸 B.食醋 C.食盐水 D.苏打水或肥皂水(呈碱性) B第三站——中和反应及其应用中和反应1.定义: 和 作用生成盐和水的反应叫做中和反应。酸碱2.实质:__ _和__ ___生成 。氢离子氢氧根水H+ + OH- → H2O3.中和反应在实际中的应用①用 改良酸性土壤,中和酸性废水等。②用含 的药物中和过多的胃酸。③蚊虫叮咬可以涂抹 缓解疼痛。 知识回顾当堂训练BA.偏高 B.偏低 C.相等 D.无法确定水湿润后2. 用pH试纸测定石灰水的pH,如图所示,则测得的结果与实际值相比( )1、室温时,下列液体的pH小于7的是( )A.白醋 B.蒸馏水 C.食盐水 D.肥皂水 A 第四站—— 检验溶液酸碱度溶液的酸碱度1.溶液的酸碱度可用 表示。pH范围: 。当pH= 7时,呈中性;2.pH值测定方法——pH试纸(结果为整数)当pH>7时,呈碱性 当pH<7时,呈酸性 pH越小酸性 pH越大碱性 溶液酸碱的强弱程度测定溶液pH的方法:在玻璃片上放一小片pH试纸, 滴在pH试纸上,把试纸显示的颜色与标准的比色卡比较,读出溶液的pH。越强越强用玻璃棒蘸取待测液 知识回顾1.若将pH试纸用水润湿, 测酸性溶液的pH,会导致溶液酸性______,pH______。2.若将pH试纸用水润湿, 测碱性溶液的pH,会导致溶液碱性______,pH______。减弱减弱变大变小当堂训练3.向稀氢氧化钠溶液中滴加稀盐酸至过量,溶液pH变化曲线正确的是( ) A 4.在用稀盐酸和氢氧化钠溶液进行中和反应实验时,反应过程中溶液的酸碱度变化如图。(1)该反应的化学方程式为: 。(2)该实验操作是将____________ 滴加到另一种溶液中。(3)当加入溶液的质量为ag时,所得溶液中的溶质为(写化学式) _______________________。 (4)当加入溶液的质量为bg时,向所得溶液中滴加酚酞溶液,溶液呈 色。NaOH + HCl = NaCl + H2O 氢氧化钠溶液NaCl、HCl红 综合提升(2)能观察到上述现象的原因是______________________________________。CO2被吸收,导致容器内压强减小NaOH溶液中含有水,水能溶解CO2,也能与CO2反应将NaOH溶液换成等体积的水,重复上述实验(1)实验的现象为______________。气球变大(3)小明认为,要得到CO2能与NaOH反应的结论,仅凭上述实验不严谨,其理由是___________________________________________________________。(4)要得到科学严谨的结论,且仍利用上述装置,需补做的对比实验是_______________________________________________________。探究CO2与NaOH能否发生化学反应拓展提升
相关资料
更多









