


还剩12页未读,
继续阅读
第十一单元课题1第2课时复分解反应课件PPT
展开
这是一份第十一单元课题1第2课时复分解反应课件PPT,共20页。
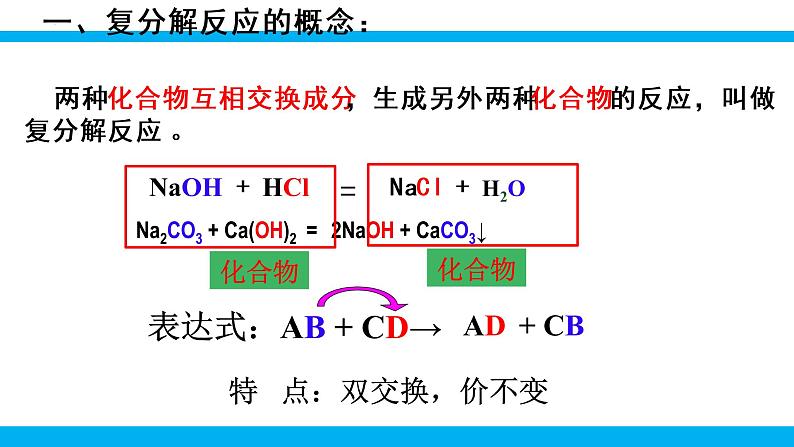
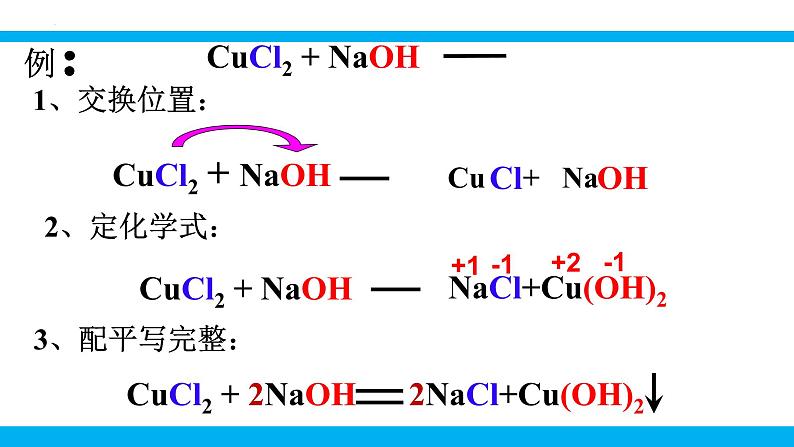
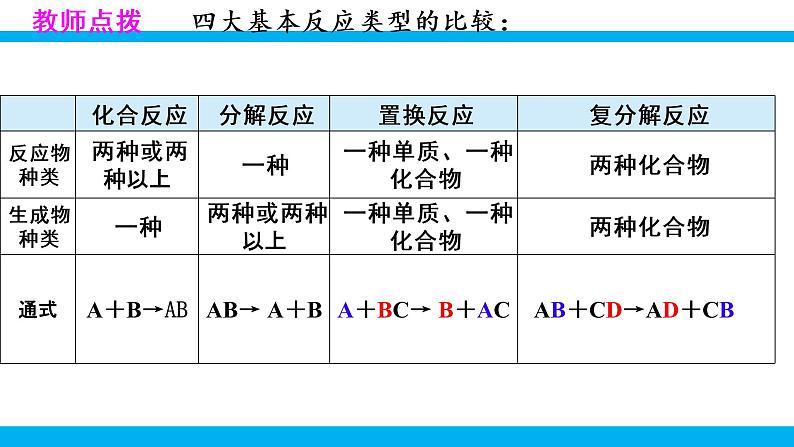
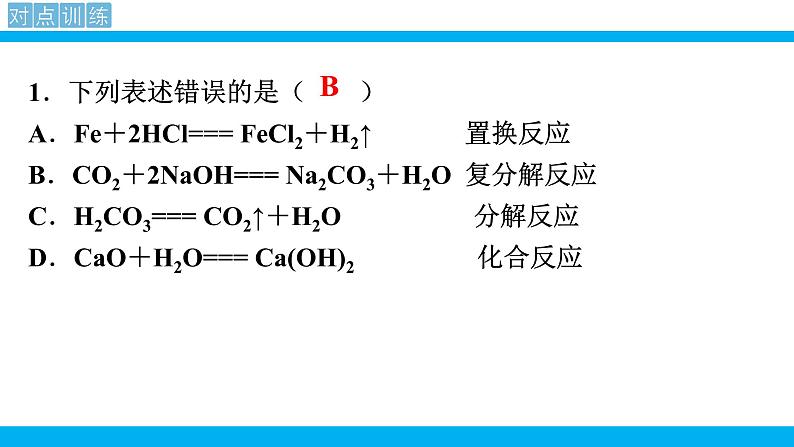
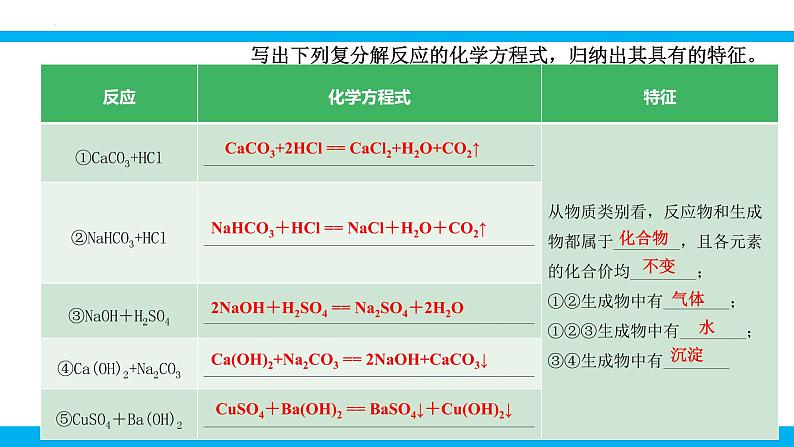
第十一单元 盐 化肥课题1 生活中常见的盐第2课时 复分解反应表达式:AB + CD→特 点:双交换,价不变AD+ CB一、复分解反应的概念: 两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓化合物化合物1、交换位置: Cu + NaCl OH2、定化学式:例: 3、配平写完整:2NaCl+Cu(OH)2练习:判断下列反应是否属于复分解反应1、Al(OH)3+6HCl==AlCl3+3H2O2、6HCl+Fe2O3==2FeCl3+3H2O3、CH4 +2O2 ==CO2 + 2H2O点燃4、CO2 + Ca(OH)2 == CaCO3↓+ H2O 单质 没互换成分5、Na2CO3+2HCl=2NaCl+H2O+CO2H2CO3教师点拨 四大基本反应类型的比较: 1.下列表述错误的是( )A.Fe+2HCl=== FeCl2+H2↑ 置换反应 B.CO2+2NaOH=== Na2CO3+H2O 复分解反应C.H2CO3=== CO2↑+H2O 分解反应D.CaO+H2O=== Ca(OH)2 化合反应B写出下列复分解反应的化学方程式,归纳出其具有的特征。CaCO3+2HCl == CaCl2+H2O+CO2↑NaHCO3+HCl == NaCl+H2O+CO2↑2NaOH+H2SO4 == Na2SO4+2H2OCa(OH)2+Na2CO3 == 2NaOH+CaCO3↓CuSO4+Ba(OH)2 == BaSO4↓+Cu(OH)2↓化合物不变气体水沉淀二、复分解反应发生的条件 只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。 K+、Na+ 、 NH4+、NO3-钾钠铵硝盐皆可溶阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。AgClAgCl盐酸盐不溶是银盐阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。BaSO4 BaSO4硫酸盐不溶是钡盐阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。K2CO3Na2CO3(NH4)2CO3 K2CO3,Na2CO3 ,(NH4)2CO3碳酸盐只溶钾钠铵阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。 KOH,Ca(OH)2, NaOH, Ba(OH)2 , NH3·H2O多数酸溶碱少溶,溶碱只有钾钠铵钡钙NaOHBa(OH)2Ca(OH)2NH3·H2OKOH阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。探究:书本P75判断稀硫酸与下列四种化合物的溶液之间是否能发生反应,填写下表:反应不反应有水生成H2SO4+2NaOH= Na2SO4+2H2O反应没有沉淀或气体或水生成H2SO4+K2CO3=== K2SO4+H2O+CO2↑有气体和水生成反应有沉淀生成H2SO4+Ba(NO3)2= BaSO4↓+2HNO3无三、 从微观角度看复分解反应的实质完成下列反应的有关问题。HCl+NaOH =NaCl+H2O2HCl+Na2CO3=2NaCl+CO2↑+H2OCuSO4+2NaOH=Cu(OH)2↓+Na2SO4H++OH-=H2O2H++CO32-= CO2↑+H2OCu2++2OH-= Cu(OH)2↓Na+、Cl-Na+、Cl-Na+、SO42-↑↓HCl+NaOH =NaCl+H2O2HCl+Na2CO3=2NaCl+CO2↑+H2OCuSO4+2NaOH=Cu(OH)2↓+Na2SO4H++OH-=H2O2H++CO32-= CO2↑+H2OCu2++2OH-= Cu(OH)2↓【小结归纳】酸碱盐之间发生复分解反应的实质是离子之间的反应,两种离子之间如果能结合生成沉淀或放出气体或生成水,反应就能发生。↑↓三、 从微观角度看复分解反应的实质2.判断下列各组离子在水溶液中能否共存,能的打“√”,不能的打“×”。×××××××√√√ 初中阶段常见的不能共存的离子:①OH-不能与H+、Cu2+、Fe3+、Mg2+、Al3+、NH4+等共存;②CO32-不能与H+、Ca2+、Ba2+共存;③SO42-不能与Ba2+共存;④Cl-不能与Ag+共存;⑤H+不能与CO32-、HCO3-、OH-共存。教师点拨3.能在同一溶液中大量共存,且溶液无色透明的一组物质是( )A.Fe2 (SO4)3、NaCl、Zn ( NO3)2 B.MgCl2、Na2SO4、NaOHC.CaCl2、NaNO3、Ba ( NO3)2 D.H2SO4、NaNO3、NaHCO34.易错辨析。判断下列说法是否正确,对的打“√”,错的打“×”。(1)有沉淀生成的反应一定是复分解反应。( )(2)反应物和生成物都是化合物的反应一定是复分解反应。( )(3)在复分解反应中,生成物不可能同时出现水、沉淀或气体中的两种。( )(4) MgCl2溶液与NaOH溶液混合后有沉淀生成,溶液总质量减小。( )C×××√
第十一单元 盐 化肥课题1 生活中常见的盐第2课时 复分解反应表达式:AB + CD→特 点:双交换,价不变AD+ CB一、复分解反应的概念: 两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应 。Na2CO3 + Ca(OH)2 = 2NaOH + CaCO3↓化合物化合物1、交换位置: Cu + NaCl OH2、定化学式:例: 3、配平写完整:2NaCl+Cu(OH)2练习:判断下列反应是否属于复分解反应1、Al(OH)3+6HCl==AlCl3+3H2O2、6HCl+Fe2O3==2FeCl3+3H2O3、CH4 +2O2 ==CO2 + 2H2O点燃4、CO2 + Ca(OH)2 == CaCO3↓+ H2O 单质 没互换成分5、Na2CO3+2HCl=2NaCl+H2O+CO2H2CO3教师点拨 四大基本反应类型的比较: 1.下列表述错误的是( )A.Fe+2HCl=== FeCl2+H2↑ 置换反应 B.CO2+2NaOH=== Na2CO3+H2O 复分解反应C.H2CO3=== CO2↑+H2O 分解反应D.CaO+H2O=== Ca(OH)2 化合反应B写出下列复分解反应的化学方程式,归纳出其具有的特征。CaCO3+2HCl == CaCl2+H2O+CO2↑NaHCO3+HCl == NaCl+H2O+CO2↑2NaOH+H2SO4 == Na2SO4+2H2OCa(OH)2+Na2CO3 == 2NaOH+CaCO3↓CuSO4+Ba(OH)2 == BaSO4↓+Cu(OH)2↓化合物不变气体水沉淀二、复分解反应发生的条件 只有当两种化合物互相交换成分,生成物中有沉淀或有气体或有水生成时,复分解反应才可以发生。阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。 K+、Na+ 、 NH4+、NO3-钾钠铵硝盐皆可溶阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。AgClAgCl盐酸盐不溶是银盐阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。BaSO4 BaSO4硫酸盐不溶是钡盐阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。K2CO3Na2CO3(NH4)2CO3 K2CO3,Na2CO3 ,(NH4)2CO3碳酸盐只溶钾钠铵阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。 KOH,Ca(OH)2, NaOH, Ba(OH)2 , NH3·H2O多数酸溶碱少溶,溶碱只有钾钠铵钡钙NaOHBa(OH)2Ca(OH)2NH3·H2OKOH阅读课本第114页附录Ⅰ,小结常见碱和盐的溶解性规律。探究:书本P75判断稀硫酸与下列四种化合物的溶液之间是否能发生反应,填写下表:反应不反应有水生成H2SO4+2NaOH= Na2SO4+2H2O反应没有沉淀或气体或水生成H2SO4+K2CO3=== K2SO4+H2O+CO2↑有气体和水生成反应有沉淀生成H2SO4+Ba(NO3)2= BaSO4↓+2HNO3无三、 从微观角度看复分解反应的实质完成下列反应的有关问题。HCl+NaOH =NaCl+H2O2HCl+Na2CO3=2NaCl+CO2↑+H2OCuSO4+2NaOH=Cu(OH)2↓+Na2SO4H++OH-=H2O2H++CO32-= CO2↑+H2OCu2++2OH-= Cu(OH)2↓Na+、Cl-Na+、Cl-Na+、SO42-↑↓HCl+NaOH =NaCl+H2O2HCl+Na2CO3=2NaCl+CO2↑+H2OCuSO4+2NaOH=Cu(OH)2↓+Na2SO4H++OH-=H2O2H++CO32-= CO2↑+H2OCu2++2OH-= Cu(OH)2↓【小结归纳】酸碱盐之间发生复分解反应的实质是离子之间的反应,两种离子之间如果能结合生成沉淀或放出气体或生成水,反应就能发生。↑↓三、 从微观角度看复分解反应的实质2.判断下列各组离子在水溶液中能否共存,能的打“√”,不能的打“×”。×××××××√√√ 初中阶段常见的不能共存的离子:①OH-不能与H+、Cu2+、Fe3+、Mg2+、Al3+、NH4+等共存;②CO32-不能与H+、Ca2+、Ba2+共存;③SO42-不能与Ba2+共存;④Cl-不能与Ag+共存;⑤H+不能与CO32-、HCO3-、OH-共存。教师点拨3.能在同一溶液中大量共存,且溶液无色透明的一组物质是( )A.Fe2 (SO4)3、NaCl、Zn ( NO3)2 B.MgCl2、Na2SO4、NaOHC.CaCl2、NaNO3、Ba ( NO3)2 D.H2SO4、NaNO3、NaHCO34.易错辨析。判断下列说法是否正确,对的打“√”,错的打“×”。(1)有沉淀生成的反应一定是复分解反应。( )(2)反应物和生成物都是化合物的反应一定是复分解反应。( )(3)在复分解反应中,生成物不可能同时出现水、沉淀或气体中的两种。( )(4) MgCl2溶液与NaOH溶液混合后有沉淀生成,溶液总质量减小。( )C×××√
相关资料
更多









