







人教版九年级上册第三单元 物质构成的奥秘课题2 原子的结构试讲课ppt课件
展开第三单元 物质构成的奥秘
课题2 原子的结构
第二课时 原子核外电子的排布
教学过程
回顾思考
以氧原子为例说明构成原子的粒子有哪几种?它们是怎样构成原子的?为什么整个氧原子不显电性?
答案:构成氧原子的粒子包括质子、中子和电子。
氧原子是由原子核和核外电子构成的,原子核又是由质子和中子构成的。在氧原子中,质子带正电,中子不带电,故由质子和中子构成的原子核带正电;核外电子带负电。原子核与核外电子所带电荷相等,电量相反,故整个氧原子不显电性。
导入新课
100多种元素的原子中,除氢原子核外只有一个电子,运动情况比较简单外,其他原子核外都有多个电子,这些电子在原子核外是如何运动的呢(画简图表示)?它们能否挣脱原子核的吸引呢?
讲授新课
三、原子核外电子的排布
【学生思考】电子在核外的空间里做高速运动,它们会相互碰撞“打架”吗?电子在核外的排布会有什么特点?
【学生阅读】阅读教材第54页,找出核外电子的运动特点。
1.核外电子是分层运动的,这种分层运动也叫分层排布
【教师点拨】核外电子运动经常出现的区域叫电子层。能量低,离核近;能量高,离核远。
元素的原子核外电子层最少的有1层,最多的有7层。离核最远,能量最高的电子层叫最外层。
电子层:一、二、三、四、五、六、七
离核的距离:最近———————————————→最远
科学家在探索原子核外电子运动时,也经历了假设、猜想的阶段,然后通过科学的手段、借助先进的仪器进行实验测定、检验而得到真理的。那么电子为什么有的排在第一层?有的排在第二层?各电子层上电子数目有什么规律?
【归纳总结】核外电子排布的规律
(1)各电子层最多能容纳的电子数为2n2个;
(2)第一层最多容纳2个电子,第二层最多容纳8个电子,最外层不超过8个电子(若第一层为最外层时,不超过2个电子);
(3)能量低的优先排满,依次再排能量逐步升高的电子层。
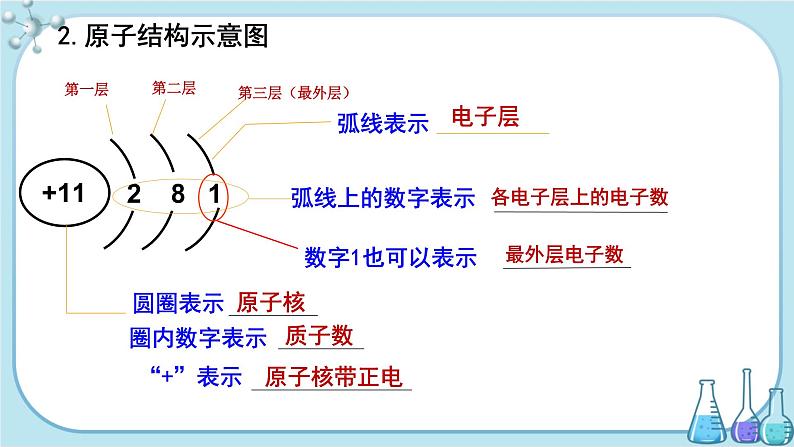
2.原子结构示意图
【教师点拨】当我们知道了核外电子的分层排布情况,我们就可以画出一种示意图来表示原子的结构了。(边讲边画钠原子的结构示意图)
【学生交流】结合黑板上的示意图,找学生叙述各部分的意义。
【学生回答】
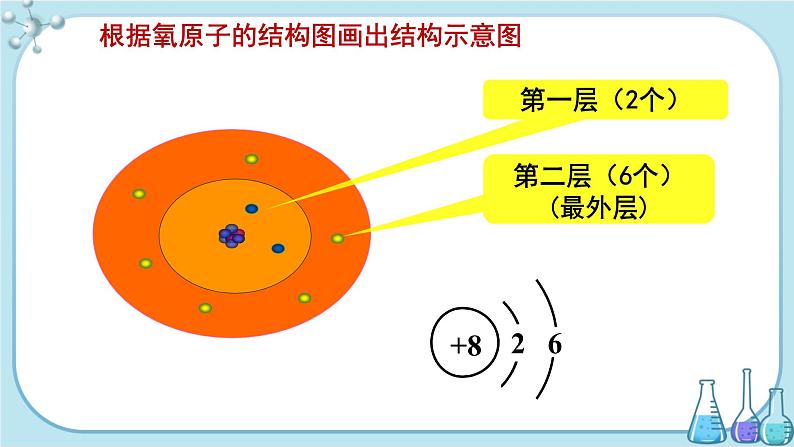
巩固练习 画氧原子的结构示意图。
答案:
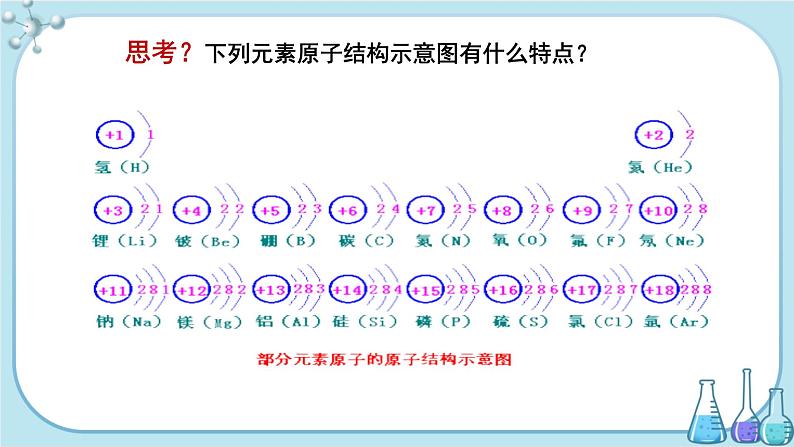
【学生讨论】展示1~18号元素的原子结构示意图,从中你可以获得哪些信息,发现哪些规律?找到之后记录下来,看谁找的多。引导学生观察、互相讨论。
部分原子的结构示意图
【学生回答】
每一横行电子层数相同;
每一纵列最外层电子数相同(He除外);
每一横行最外层电子数从左到右依次增加;
每一纵列电子层数从上到下依次增加等。
3.原子结构与元素分类、元素化学性质的关系
【教师点拨】相对稳定结构:最外层电子数为8个(只有一个电子层时为2个)
【教师提问】1.不同类元素的原子最外层电子数有何特点?它们的结构是否稳定?
2.化学反应过程中元素的原子总是力求使自身结构趋于或达到稳定结构,金属与非金属元素通过何种方式可趋于达到相对稳定结构?
3.不同种类元素的原子最外层电子数与化学性质有怎样的关系?
【学生回答】学生分析原子最外层电子数特点及与元素性质的关系。
原子的分类 | 最外层电子数 | 得失电子趋势 | 化学 性质 | 举例 |
稀有气体元素的原子 | 一般为8个(氦为2个) | 相对稳定,不易得失电子 | 稳定 | 氦、氖、氩 |
金属元素 | 一般少于4个 | 易失去电子 | 不稳定 | 钠、钾、镁等 |
非金属元素 | 一般等于或大于4个 | 易得到电子 | 不稳定 | 硫、氯等 |
【教师点拨】
元素的性质与核外电子的排布,特别是最外层电子数的关系最密切。
(1)金属元素:最外层一般少于4个电子,易失去最外层电子,化学性质活泼。
(2)非金属元素:最外层一般等于或大于4个电子,易得到电子,化学性质活泼。
(3)稀有气体元素:最外层为8个电子(氦为2个),具有相对稳定结构,化学性质不活泼。
例题 某原子的原子结构示意图如图所示,请回答下列问题。
A B C D E
(1)图中x= ,该原子属于 (填“金属”或“非金属”)原子。
(2)A~E表示的微粒中,具有相对稳定结构的是 (填序号,下同),与题给原子化学性质相似的是 。
解析:(1)在原子中,质子数=核外电子数,35=2+8+18+x,x=7;因为最外层电子数为7,大于4,所以该原子属于非金属原子。
(2)最外层电子数为8(只有一个电子层时为2)的结构为相对稳定结构。题中只有C项原子最外层电子数为8,具有相对稳定结构。最外层电子数相同的原子具有相似的化学性质,因此题中的E项原子与题给原子具有相似的化学性质。
答案:(1)7 非金属 (2)C E
【教师点拨】
1.元素的化学性质与原子的最外层电子数有着密切关系。
2.最外层电子数决定元素的化学性质。
【教师提问】由于金属原子、非金属原子的原子核外最外层没有达到稳定结构,在化学反应中易得失电子,从而达到稳定结构,那么,原子得失电子形成什么离子?
4.离子的形成
【教师展示】展示钠在氯气中燃烧生成氯化钠的形成过程以及钠原子结构示意图和氯原子结构示意图。那么原子如何达到相对稳定结构?边展示,边分析。
【教师讲述】通过结构示意图我们可以知道,钠原子最外层有一个电子,而氯原子最外层有七个电子。钠在氯气中燃烧生成氯化钠,在这个反应中,每个钠原子失去一个电子,形成钠离子,每个氯原子得到一个电子,形成氯离子。钠离子与氯离子由于静电作用结合成稳定的化合物——氯化钠。
【教师讲述】像这样由阴阳离子结合而成的物质还有很多,如氯化镁、氯化钾等,离子也是构成物质的一种微粒。那么如何来表示离子的符号呢?
四、离子
1.离子的定义:带电的原子(或原子团)叫离子。
2.离子的分类
(1)阳离子:带正电的原子(或原子团)叫做阳离子。
特点:电子数<质子数。
(2)阴离子:带负电的原子(或原子团)叫做阴离子。
特点:电子数>质子数。
3.离子化合物:像氯化钠一样由阴、阳离子靠静电作用形成的化合物。
4.离子符号的书写:先写元素或原子团符号,然后在符号右上方先标电荷数值(数值为“1”时省略),后标“+”“-”号。离子所带电荷数由该元素原子的最外层电子数决定。
【教师提问】2Mg2+中数字“2”表示何种意义?
【学生回答】
5.离子符号表示的意义
【教师讲述】教师介绍原子团,要求学生熟记常见原子团(根)的符号、名称。
名称: 氢氧根 硝酸根 铵根 碳酸根 硫酸根
符号: OH-
【学生讨论】原子和离子的比较有哪些区别和联系?
【归纳总结】(1)区别:①原子结构一般不稳定(稀有气体除外),而离子结构稳定;②原子不显电性,离子带电;③原子在化学反应中不变,离子可能变;④原子用元素符号表示,离子用离子符号表示。
(2)联系:①都能构成物质,保持物质的化学性质;②用图示表示它们之间的关系。
【学生思考】想一想分子、原子、离子、物质间的关系。
【教师展示】
【教师点拨】构成物质的粒子包括原子、分子、离子。
(1)由原子直接构成的物质:稀有气体(如He、Ne等);金属(如Hg、Fe等);少数固态非金属(如C、Si等)。
(2)由分子构成的物质:双原子气体分子(如H2、O2、N2等);多原子共价化合物(如H2O、CO2、HCl等)。
(3)由离子构成的物质:离子化合物(如NaCl、K2S、CuSO4等)。
课堂小结
1.原子中的核外电子是分层排布的,可以用原子结构示意图表示。
2.构成物质的粒子,除原子和分子之外,还有离子(带电的原子叫做离子,带电的原子团也叫做离子)。
当堂达标
1.下列结构示意图,表示阴离子的是( )
A B C D
答案:D
2.某元素的原子结构示意图为,下列说法错误的是( )
A.该元素原子的质子数为11
B.该元素原子的核外有三个电子层
C.该元素属于非金属元素
D.该元素原子的核外电子总数为11
答案:C
3.下列粒子结构示意图中,表示阳离子的是( )
A B C D
答案:C
4.甲、乙是两种粒子的结构示意图,下列说法正确的是( )
甲 乙
A.甲是阳离子
B.乙是阴离子
C.甲、乙属于不同种粒子
D.甲、乙都属于金属原子
答案:C
板书设计
第三单元 物质构成的奥秘
课题2 原子的结构
第二课时 原子核外电子的排布
三、原子核外电子的排布
1.电子在核外是分层排布的
2.排布规律
3.原子结构示意图
4.最外层电子数与原子化学性质的关系
四、离子
1.定义:带电的原子或原子团叫做离子。
2.离子与原子的区别及联系
3.分类
(1)阳离子:原子失电子,带正电 质子数>电子数
(2)阴离子:原子得电子,带负电 质子数<电子数
4.离子符号的书写
初中化学人教版九年级上册课题2 原子的结构教课课件ppt: 这是一份初中化学人教版九年级上册课题2 原子的结构教课课件ppt,共38页。PPT课件主要包含了C和D等内容,欢迎下载使用。
化学九年级上册课题2 原子的结构优质ppt课件: 这是一份化学九年级上册课题2 原子的结构优质ppt课件,文件包含人教版九年级化学上册课题2原子的结构第2课时课件pptx、人教版九年级化学上册课题2原子的结构第2课时教案doc等2份课件配套教学资源,其中PPT共20页, 欢迎下载使用。
人教版九年级上册课题3 元素一等奖ppt课件: 这是一份人教版九年级上册课题3 元素一等奖ppt课件,文件包含第三单元课题3《元素》第2课时课件PPTpptx、33元素第2课时教案含练习docx等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。













