






所属成套资源:苏教版化学必修第二册PPT课件整册
- 7.1 氮的固定 课件 课件 0 次下载
- 7.2.1 氨气 课件 课件 0 次下载
- 7.3.1 铵盐的性质与常见氮肥 课件 课件 0 次下载
- 7.3.2 氮氧化物的无害化处理 课件 课件 0 次下载
- 8.1.1 天然气的利用 甲烷 课件 课件 0 次下载
苏教版 (2019)必修 第二册第二单元 重要的含氮化工原料优质课件ppt
展开
这是一份苏教版 (2019)必修 第二册第二单元 重要的含氮化工原料优质课件ppt,共17页。PPT课件主要包含了硝酸的制备,反应原理,合成塔,硝酸的物理性质,硝酸的化学性质,不稳定性,NO2红棕色,强氧化性,2与非金属反应,硝酸氧化性分析等内容,欢迎下载使用。
1.掌握硝酸的重要性质和应用。2.能从不同视角认识含氮化合物之间转化的条件和方式。
硝酸是最重要的无机强酸之一,也是重要的化工原料,在工农业生产和人类生活中发挥着极为重要的作用。
思考:1.怎样制备硝酸,反应原理是什么?2.硝酸有哪些性质?
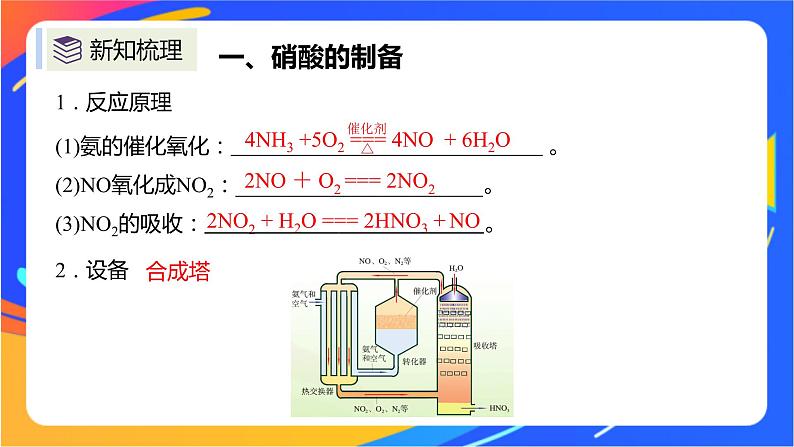
2NO + O2 === 2NO2
2NO2 + H2O === 2HNO3 + NO
(1)氨的催化氧化: 。 (2)NO氧化成NO2:_______________________。(3)NO2的吸收: 。
硝酸是一种无色、易挥发、具有刺激性气味的液体,沸点为83℃,密度为1.42g·cm-3,能与水以任意比互溶。市售浓硝酸的质量分数约为69%。
市售浓硝酸常因溶有少量NO2而显黄色
思考:怎样去除黄色,怎样保存硝酸呢?
提示:向硝酸缓慢通入O2,能消除黄色,原理4NO2 + O2 + 2H2O === 4HNO3
注意:硝酸密封贮存棕色细口瓶,并置于低温、避光处。
【实验1】将铜片置于具支试管的底部,通过分液漏斗加入2mL浓硝酸,将产生的气体通入倒置于水槽里充满水的集气瓶中(右图1),观察实验现象。【实验2】在上述装置中,用分液漏斗向试管内加稀硝酸(右图2),继续收集产生的气体,观察实验现象。
产生红棕色气体,溶液变蓝绿色,收集到无色气体
Cu + 4HNO3 === Cu(NO3)2 + 2NO2↑ + 2H2O3NO2 + H2O === 2HNO3 + NO(无色气体)
产生无色气体,溶液变蓝绿色,收集到无色气体
3Cu + 8HNO3 === 3Cu(NO3)2 + 2NO↑ + 4H2O
(1)与金属反应(除Au、Pt外)
硝酸除强氧化性外,还有酸性
注:常温下,铁、铝遇浓硝酸钝化,形成一层致密的氧化膜,阻止继续反应。故能用铁制或铝制容器盛装浓硝酸。
实验现象:产生红棕色气体
思考:反应中浓硝酸除有强氧化性外,还有其他性质吗?
(3)与其他还原性物质反应
NaOH + HNO3 === NaNO3 + H2O
CaO + 2HNO3 === Ca(NO3)2 + H2O
Ca(OH)2 + 2HNO3 === Ca(NO3)2 + 2H2O
(2)与碱性氧化物反应
Fe2O3 + 6HNO3 === 2Fe(NO3)3 + 3H2O
特例:3FeO +10HNO3 === 3Fe(NO3)3 + NO↑+ 5H2OFeO中铁为+2价,有还原性,与硝酸发生氧化还原反应
硝酸是一种重要的化工原料,常用来制造氮肥、燃料、塑料、炸药、硝酸盐等。
NH3→NO→NO2→HNO3
-3 +2 +4 +5
1.下列反应中硝酸既表现出酸性又表现出氧化性的是( )A.使石蕊溶液变红B.与铜反应放出NO气体,生成Cu(NO3)2C.与Na2CO3反应放出CO2气体,生成NaNO3D.与S单质混合共热时生成H2SO4和NO2
2.将硝酸表现出的性质(代号字母)填在下列各反应操作或现象后:A.氧化性 B.酸性 C.还原性 D.不稳定性(1)久置的浓硝酸变黄色________。(2)用硝酸浸洗附有银的试管________。(3)常温下用铁制或铝制容器贮存、运输浓HNO3____________。(4)用稀HNO3浸洗久置石灰水试剂瓶上的固体____________。(5)用Cu和稀HNO3制NO气体________。
相关课件
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物获奖作业课件ppt,文件包含524硝酸课件pptx、524硝酸分层作业含解析docx、524硝酸分层作业无答案docx等3份课件配套教学资源,其中PPT共38页, 欢迎下载使用。
这是一份新高考化学一轮复习课件 第4章 热点强化9 亚硝酸及亚硝酸钠的性质,共17页。PPT课件主要包含了高考化学一轮复习策略等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 氮及其化合物课文内容ppt课件,共24页。PPT课件主要包含了无色液体,有刺激性气味,易挥发,二化学性质,不稳定性,变黄的浓硝酸,强氧化性,有大量气泡产生,无色变为蓝色,红棕色等内容,欢迎下载使用。










