






还剩52页未读,
继续阅读
所属成套资源:苏教版化学选择性必修2课件PPT全册
成套系列资料,整套一键下载
高中化学苏教版选择性必修2 专题3 第三单元 第1课时 共价键的形成及类型课件PPT
展开
这是一份高中化学苏教版选择性必修2 专题3 第三单元 第1课时 共价键的形成及类型课件PPT,共60页。
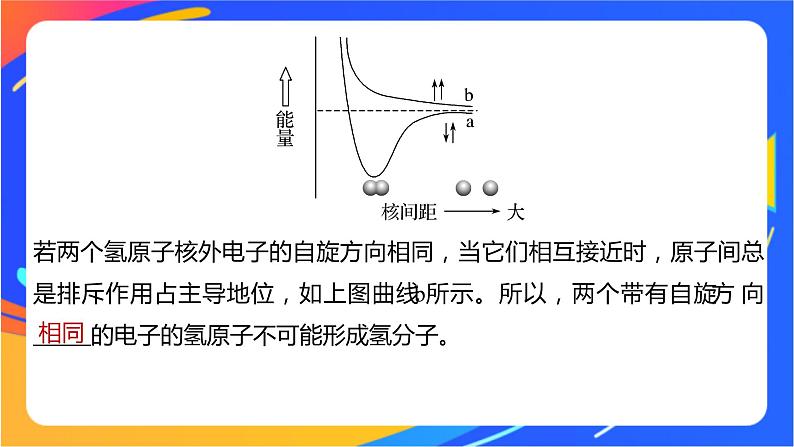
第1课时共价键的形成及类型核心素养发展目标1.了解共价键的形成条件及实质,能从微观角度分析共价键的类型, 会区分σ键和π键,极性键和非极性键,促进宏观辨识与微观探析 学科核心素养的发展。2.能熟练判断分子中σ键和π键的存在及个数,从而建立判断σ键和π 键的思维模型。随堂演练知识落实课时对点练内容索引一、共价键的形成二、共价键的类型一、共价键的形成1.共价键通常情况下, 相近的原子之间通过共用电子对形成共价键。吸引电子能力2.形成过程(以氢气分子的形成为例)当两个氢原子相互接近时,若两个氢原子核外电子的自旋方向 ,它们接近到一定距离时,两个氢原子的 轨道发生重叠,电子在两原子核间出现的机会 。随着核间距的减小,核间电子出现的机会增大,体系的能量逐渐 ,达到能量最低状态。若核间距进一步地减小,两原子核间的斥力增大,使体系的能量迅速上升,这种排斥作用又将氢原子推回到平衡位置。氢分子的形成过程中能量(主要指势能)随核间距的变化如上图曲线a所示。相反1s较大下降若两个氢原子核外电子的自旋方向相同,当它们相互接近时,原子间总是排斥作用占主导地位,如上图曲线b所示。所以,两个带有自旋方向 的电子的氢原子不可能形成氢分子。相同3.形成的本质当成键原子相互接近时,原子轨道发生 ,自旋方向 的_______电子形成共用电子对,两原子核间的电子密度 ,体系的能量 。重叠相反未成对增加降低4.共价键的特征共价键电子出现机会最大1.NH3分子中为什么N原子是1个,而H原子为3个?2.从电负性角度理解共价键、离子键的形成条件,完成表中内容。结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是元素的电负性相差不大的原子之间形成的化学键。2.10.91.0离子共价归纳总结(1)共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。共价键的方向性决定了分子的空间结构。(2)共价键的形成条件:电负性之差小于1.7的元素之间易形成共价键。1.正误判断,正确的打“√”,错误的打“×”(1)形成共价键后体系的能量降低,趋于稳定( )(2)共价键的饱和性是由成键原子的未成对电子数决定的( )(3)共价键的饱和性决定了分子内部原子的数量关系( )(4)共价键的方向性是由成键原子轨道的方向性决定的( )(5)原子轨道在空间都具有方向性( )√√√√×2.下列说法正确的是A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的B.H2O与H2S的空间结构一样是由共价键的饱和性决定的C.并非所有的共价键都有方向性D.两原子轨道发生重叠后,电子在两核间出现的概率减小√解析 Cl2是双原子分子,H2S是三原子分子,这是由共价键的饱和性决定的,A不正确;氢气中的共价键没有方向性,C正确;两原子轨道发生重叠后,电子在两核间出现的概率增大,D不正确。3.下列各组物质中,所有化学键都是共价键的是A.H2S和Na2O2 B.H2O2和CaF2C.NH3和N2 D.HNO3和NaCl√解析 A项,Na2O2中既有离子键又有O—O共价键,不符合题意;B项,CaF2中只有离子键,不符合题意;D项,NaCl中只有离子键,不符合题意。易错提醒对于共价键的错误认识(1)共价键不仅存在于共价化合物中,也可以存在于离子化合物中,如NaOH、NH4Cl中都含有共价键,还可以存在于非金属单质中,如H2、O3等。(2)非金属元素之间并不是只形成共价键,也可以形成离子键,如铵盐NH4NO3只由非金属元素组成,但是含有离子键。(3)活泼的金属元素和非金属元素之间也可以形成共价键,如AlCl3中只有共价键。(4)所有共价键都有饱和性,但并不是所有的共价键都有方向性,如s-s σ键就没有方向性。返回二、共价键的类型1.σ键和π键(1)(2)分类依据:成键原子的原子轨道的 。(3)特点:一般地,σ键原子轨道重叠程度 ,键的强度 ;π键原子轨道重叠程度 ,键的强度 。“头碰头”重叠方式大大小小2.极性键和非极性键同种不偏移不同种较大负正3.配位键——特殊共价键(1)概念:由一个原子提供孤电子对与另一个有空轨道可接受电子的原子形成的共价键。(2)表示方法:在表示分子或离子的结构式时,常用“―→”表示配位键,其箭头指向 的原子。(3)配位键与共价键在形成过程上的主要不同是配位键的共用电子对是由某个原子提供的,共价键的共用电子对是成键原子双方共同提供的。接受孤电子对1.观察下图乙烷、乙烯和乙炔分子的结构,并回答下列问题。(1)它们的分子中分别由几个σ键和几个π键构成?提示 乙烷:7个σ键;乙烯:5个σ键和1个π键;乙炔:3个σ键和2个π键。(2)乙烯和乙炔的化学性质为什么比乙烷活泼?提示 乙烯的碳碳双键和乙炔的碳碳三键中分别含1个和2个π键,π键原子轨道重叠程度小,不稳定,容易断裂;而乙烷中没有π键,σ键较稳定,不易断裂。2.在气体单质分子中,一定含有σ键,可能含有π键吗?提示 稀有气体的单质分子中不含化学键,多原子分子中一定含有σ键,可能含有π键。3.BeCl2以二聚体形式存在,试标出配位键。提示 4.我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。归纳总结(1)σ键和π键的比较①两个s轨道只能形成σ键,不能形成π键。②两个原子形成共价键时,其原子轨道尽可能满足最大重叠程度,故两个原子形成共价键时先形成σ键,然后才能形成π键。所以两个原子间可以只形成σ键,但不能只形成π键。③σ键原子轨道重叠程度较大,电子在核间出现的概率大,强度较大,不容易断裂;π键原子轨道重叠程度较小,电子在核间出现的概率小,强度较小,容易断裂。总之,σ键一般比π键强度大,表现在化学性质的不同,通常含π键的物质的化学性质更活泼,如乙烯比乙烷更活泼。(2)非极性键、极性键、配位键的区别与联系1.下列说法对σ键和π键的认识不正确的是A.分子中只要含有共价键,则至少含有一个σ键B.s-s σ键、p-p σ键与s-p σ键都是轴对称的C.p-p σ键和p-p π键的重叠方式是相同的D.含有π键的分子在反应时,π键是化学反应的积极参与者√解析 单键为σ键,双键和三键中均含1个σ键,所以分子中含有共价键,则至少含有一个σ键,故A正确;因s-s σ键、p-p σ键与s-p σ键的电子云均为“头碰头”重叠,则为轴对称,故B正确;p-p σ键和p-p π键的重叠方式是不相同的,p-p σ键是“头碰头”重叠而p-p π键是“肩并肩”重叠,故C错误;π键不稳定,易断裂,则含有π键的分子在反应时,π键是化学反应的积极参与者,故D正确。2.若X、Y两种粒子之间可形成配位键,则下列说法正确的是A.X、Y只能是分子B.X、Y只能是离子C.若X提供空轨道,则Y至少要提供一对孤电子对D.若X提供空轨道,则配位键表示为X→Y√解析 形成配位键的两种微粒可以均是分子或者均是离子,还可以一种是分子、一种是离子,但必须是一种微粒提供空轨道、另一种微粒提供孤电子对,A、B项错误,C项正确;配位键中箭头应该指向提供空轨道的X,D项错误。3.现有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2按要求回答下列问题(填序号):(1)只含有极性键的是______;只含有非极性键的是________;既含有极性键,又含有非极性键的是________。①③②④⑦⑤⑥⑧解析 ①中H—F键、③中H—O键属于极性键;②中Cl—Cl键、④中N≡N键、⑦中H—H键属于非极性键;⑤中C—H键属于极性键,C==C键属于非极性键,⑥中C—H键属于极性键,C—C键属于非极性键,⑧中H—O键属于极性键,O—O键属于非极性键。(2)只含有σ键的是_______________;既含有σ键又含有π键的是_____。(3)含有由两个原子的s轨道重叠形成的σ键的是____。(4)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是___________。①②③⑥⑦⑧④⑤⑦②④⑤⑥⑧解析 ②中Cl—Cl键、④中N≡N键、⑤中C==C键、⑥中C—C键、⑧中O—O键都是由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键。返回随堂演练 知识落实1.下列关于共价键的说法正确的是A.共价键只存在于共价化合物中B.只含有共价键的物质一定是共价化合物C.非金属元素的原子只能通过共价键形成共价分子D.离子化合物中可能含有极性键也可能含有非极性键√1234562.下列有关σ键和π键的说法错误的是A.π键是原子轨道“肩并肩”方式重叠形成的共价键B.当原子形成分子时,首先形成σ键,可能形成π键C.σ键较π键稳定D.苯分子中含有12个σ键和3个π键√1234563.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是A.CH4与NH3 B.C2H6与C2H4C.H2与Cl2 D.Cl2与N2√解析 分子中全是s-p σ键,A正确;C2H6中只存在σ键,而C2H4中存在σ键和π键,B错误;H2为s-s σ键,Cl2为p-p σ键,C错误;Cl2中只存在σ键,而N2中存在σ键和π键,D错误。1234564.丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是A.4个σ键,1个π键 B.11个σ键,3个π键C.4个σ键,3个π键 D.9个σ键,5个π键√12345解析 分子中含有1个C==C键,2个C==O键、2个C—H键、2个C—O键、2个C—C键、2个O—H键,其中C==C键、C==O键含有σ键、π键,其他都为σ键,则分子中含有11个σ键、3个π键。65.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是A.仅有一个σ键B.仅有一个π键C.一个σ键,一个π键D.一个σ键,两个π键√解析 由题给条件所有原子均符合8电子稳定结构可知,其结构式应为F—N==N—F,则两个氮原子之间为氮氮双键,含有一个σ键和一个π键。1234566.回答下列问题:(1)今有A、B两种元素,A的+1价阳离子与B的-2价阴离子的电子层结构与氖相同。①用电子式表示A与B两种元素构成的两种化合物分别为__________________和_____________________。前者只有_____键;后者既有_____键,又有______________键。12345离子离子非极性(或共价)6②元素B的气态氢化物的电子式为__________,该分子中的键属于_____(填“极性”或“非极性”)键,该氢化物与H+形成的键属于_______。③元素A的最高价氧化物对应水化物的电子式为_________________,其中既有_____键,又有_____________键。极性配位键离子极性(或共价)解析 由其离子的电子层结构判断A+为Na+,B2-为O2-。123456(2)某有机物的结构式如下所示:则分子中有____个σ键,____个π键。73解析 除共价单键全部为σ键外,双键中有一个为σ键,另一个为π键;三键中有一个为σ键,另两个为π键,故该有机物分子中σ键总数为7,π键总数为3。返回123456课 时 对 点 练题组一 共价键的形成与判断1.下列元素的原子间易形成共价键的是A.Na和Cl B.K和FC.H和Cl D.Ca和O√1234567891011121314151617181912345678910111213141516171819解析 非金属元素的原子间容易形成共价键,活泼的金属和非金属元素的原子间容易形成离子键。则Na和Cl形成的是离子键,A错误;K和F形成的是离子键,B错误;H和Cl均是非金属元素,形成的是共价键,C正确;Ca和O形成的是离子键,D错误。2.已知X、Y、Z、W四种元素原子的电负性数值如下所示:12345678910111213141516171819你认为上述四种元素中,最容易形成共价键的是A.X与Y B.X与W C.Y与Z D.Y与W√解析 当两种元素原子的电负性相差很大时,形成的将是离子键;当两种元素原子的电负性相差不大时,形成的将是共价键。3.下列说法正确的是A.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方 向性B.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的 价电子数C.基态C原子有两个未成对电子,所以最多只能形成2个共价键D.1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和 性决定的√12345678910111213141516171819解析 只有2个s原子轨道重叠形成的共价键没有方向性,其他原子轨道重叠形成的共价键都有方向性,A不正确;非金属元素的原子形成的共价键数目一般等于该原子最外层的未成对电子数,不能说一定等于该元素原子的价电子数,B不正确;在形成CH4分子的过程中,碳原子2s轨道中的1个电子激发到2p空轨道,这样形成了4个未成对电子,C不正确;N原子最外层2p轨道上共有3个未成对电子,1个N原子可以与3个H原子结合形成NH3,此时共价键饱和,D正确。123456789101112131415161718194.下列说法正确的是A.若把H2S写成H3S,违背了共价键的饱和性B.H3O+的存在说明共价键不具有饱和性C.所有共价键都有方向性D.两个原子轨道发生重叠后,两核中的电子不仅存在于两核之间,还会 绕两核运动√12345678910111213141516171819解析 硫原子有两个未成对电子,根据共价键的饱和性,形成的氢化物为H2S,A项正确;H2分子中氢原子的s轨道成键时,因为s轨道呈球形,所以H2中的H—H键没有方向性,C项错误;两个原子轨道发生重叠后,只有共用电子对在两核之间绕两个原子核运动,D项错误。12345678910111213141516171819题组二 共价键的分类及判断5.(2020·湖北黄梅一中高二月考)如图所示的分子中含有σ键和π键的数目分别为12345678910111213141516171819A.13 2 B.10 2 C.10 3 D.9 3√解析 题述分子中含有6个C—H键、2个C—C键、1个C==C键、1个C≡C键,单键中只含有σ键,双键中含有1个σ键和1个π键,三键中含有1个σ键和2个π键,故该分子中共有10个σ键和3个π键,故C项正确。123456789101112131415161718196.下列关于σ键和π键的理解不正确的是A.σ键可以绕键轴旋转,π键不能绕键轴旋转B.H2分子中的σ键是s-s σ键,HClO分子中的σ键都是p-p σ键C.C2H4分子和N2H4分子中都含有5个σ键D.σ键以“头碰头”方式重叠,π键以“肩并肩”方式重叠√12345678910111213141516171819解析 σ键为轴对称,π键为镜面对称,则σ键可以绕键轴旋转,π键不能绕键轴旋转,故A正确;H只有1s轨道上的电子,O的2p轨道上的电子与H的1s轨道上的电子以“头碰头”方式重叠形成s-p σ键,故B错误;乙烯分子中氢原子和碳原子之间存在共价单键,为σ键,碳碳原子之间存在共价双键,有1个σ键和1个π键,则C2H4分子中有5个σ键和1个π键,N2H4中只有5个共价单键,即含有5个σ键,故C正确;π键为p电子“肩并肩”重叠形成,而σ键为s或p电子“头碰头”重叠形成,故D正确。123456789101112131415161718197.下列一定既含有σ键又含有π键的分子是①N2O ②H2O2 ③N2 ④C3H6 ⑤HCHO ⑥Na2O2A.①②③ B.①③④ C.①③⑤ D.③④⑥√12345678910111213141516171819解析 ②中均为单键,④可能为环丙烷,此时均为单键,⑥为离子化合物且含O—O键,均不符合,只有①③⑤为既含有σ键又有含π键的分子。8.防晒霜之所以能有效地减轻紫外线对人体的伤害,是因为其有效成分的分子中含有π键,这些分子中的 π键电子可以在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。下列物质没有防晒效果的是C.肉桂酸(C6H5—CH==CH—COOH)D.酒精√123456789101112131415161718199.下列物质的分子中既有σ键又有π键,并含有非极性键的是①NH3 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2A.②⑤⑥ B.①②⑤⑥C.②③④ D.②④⑥√1234567891011121314151617181912345678910111213141516171819解析 ①NH3中存在H—N键,只有σ键,故错误;②N2的结构式为N≡N,含有σ键和π键,N与N之间为非极性键,故正确;③H2O中只存在H—O键,即只有σ键,故错误;④HCl的结构式为H—Cl,只存在σ键,故错误;⑤C2H4中的氢原子和碳原子之间存在共价单键、碳碳之间存在共价双键,含有σ键和π键,C与C之间为非极性键,故正确;⑥C2H2中的氢原子和碳原子之间存在共价单键、碳碳之间存在共价三键,所以含有σ键和π键,C与C之间为非极性键,故正确。10.据报道,大气中存在一种潜在的温室气体SF5—CF3(结构如图),虽然其数量有限,但它是已知气体中吸热最高的。关于SF5—CF3的说法正确的是A.分子中有σ键也有π键B.C—F是s-p σ键C.分子中不是所有原子都满足8电子稳定结构D.0.1 mol SF5—CF3分子中电子数为8NA12345678910111213141516171819√解析 只有共价单键,则分子中只有σ键,没有π键,故A错误;一个SF5—CF3分子中有94个电子,则0.1 mol SF5—CF3分子中电子数为9.4NA,故D错误。1234567891011121314151617181911.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是①H2O ②NH3 ③F- ④CN- ⑤COA.①② B.①②③C.①②④ D.①②③④⑤√12345678910111213141516171819解析 能与某些金属离子形成配位键应为含有孤电子对的阴离子或分子,以上五种微粒的结构中都含有孤电子对。12.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图所示。下列有关该物质的说法正确的是A.分子中含6个σ键B.分子式为C3H2O3C.分子中只有极性键D.8.6 g该物质完全燃烧得到6.72 L CO2√12345678910111213141516171819解析 根据题图中该分子的结构可知该物质的分子式为C3H2O3,1个分子中含有4个C—O键、1个C==C键,2个C—H键、1个C==O键,其中单键均为σ键,双键中含有1个σ键和1个π键,因此分子中含8个σ键,故A错误、B正确;12345678910111213141516171819该分子中的C—H键、C—O键等为极性键,C==C键为非极性键,故C错误;未给出CO2所处的状态,不能根据其物质的量计算体积,故D错误。13.在下列化学反应中,所断裂的共价键中,仅仅断裂σ键的是√解析 氮气中π键断裂,故A不选;乙炔中π键断裂,故B不选;氯气、氢气中均为σ键断裂,故C选;乙烯中π键断裂,故D不选。1234567891011121314151617181914.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)。下列说法正确的是A.硝基胍分子中只含极性键,不含非极性键B.N原子间只能形成σ键C.硝基胍分子中σ键与π键的个数比是5∶1D.10.4 g硝基胍中含有11×6.02×1023个原子√12345678910111213141516171819解析 分子中N—N键为非极性键,A项错误;N原子间可以形成σ键和π键,B项错误;分子中含有4个N—H键、1个C==N键、1个N==O键、2个C—N键、1个N—N键和1个N→O键,σ键与π键的个数比是5∶1,C项正确;12345678910111213141516171819硝基胍的分子式为CN4H4O2,相对分子质量为104,10.4 g该物质的物质的量为0.1 mol,含有1.1×6.02×1023个原子,D项错误。A.为使该转化成功进行,Y可以是酸性KMnO4溶液B.等物质的量的T、X分子中含有π键的数目均为NAC.X分子中含有的σ键个数是T分子中含有的σ键个数的2倍D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键15.由短周期前10号元素组成的物质T和X,有如图所示的转化。X不稳定,易分解。下列有关说法正确的是(设NA代表阿伏加德罗常数的值)√12345678910111213141516171819解析 由结构模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,Y为氧化剂,可以选择氧化性较强的酸性KMnO4溶液,A项正确;B项中要注意等物质的量并不一定是1 mol,B项错误;X分子中含有的σ键个数为5,T分子中含有的σ键个数为3,C项错误;T、X分子中均只含有极性键,无非极性键,D项错误。1234567891011121314151617181916.分析下列化学式中画横线的元素,选出符合要求的物质填空。A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2(1)所有的外围电子都参与形成共价键的是____(填字母,下同)。(2)只有一个外围电子参与形成共价键的是____。(3)最外层有未参与成键的电子对的是_______。(4)既有σ键又有π键的是___。12345678910111213141516171819DECABCFF解析 NH3中氮原子与3个氢原子形成3个σ键,还有一对不成键电子;H2O中氧原子与2个氢原子形成2个σ键,还有两对不成键电子;HCl中氯原子与1个氢原子形成1个σ键,还有三对不成键电子;CH4中碳原子与4个氢原子形成4个σ键,所有外围电子都参与成键;C2H6中碳原子分别与3个氢原子及另1个碳原子形成4个σ键,所有电子都参与成键;N2中1个氮原子与另1个氮原子形成1个σ键,2个π键,还有一对不成键电子。1234567891011121314151617181917.回答下列问题:(1)1 mol CO2中含有的σ键数目为_____。(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为______。HCN分子中σ键与π键数目之比为_____。(3)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数之比为_____。(4)1 mol乙醛分子中含有 σ键的数目为________________,1个CO(NH2)2分子中含有σ键的个数为___。123456789101112131415161718192NA1∶21∶15∶16NA(或3.612×1024)718.X、Y、Z是元素周期表中的短周期元素,其中X、Y同周期,Y、Z同主族,Y原子最外层p轨道上的电子数等于前一电子层电子总数,X原子最外层的p能级中只有一个轨道填充了2个电子,而且这三种元素可以形成化合物YX2、ZX2。根据上述信息回答下列问题:(1)写出下列元素符号:X____,Y____,Z____。OCSi(2)YX2分子中含___个σ键,含___个π键。22解析 X、Y、Z元素的符号分别是O、C、Si。解析 CO2分子的结构式为O==C==O,故其中含2个σ键,含2个π键。1234567891011121314151617181919.(1)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,且已知它的结构中还含有配位键,氯化铝的化学式为_______,请在其结构式中标出配位键:Al2Cl6答案 1234567891011121314151617181912345678910111213141516171819答案 12345678910111213141516171819返回本课结束
第1课时共价键的形成及类型核心素养发展目标1.了解共价键的形成条件及实质,能从微观角度分析共价键的类型, 会区分σ键和π键,极性键和非极性键,促进宏观辨识与微观探析 学科核心素养的发展。2.能熟练判断分子中σ键和π键的存在及个数,从而建立判断σ键和π 键的思维模型。随堂演练知识落实课时对点练内容索引一、共价键的形成二、共价键的类型一、共价键的形成1.共价键通常情况下, 相近的原子之间通过共用电子对形成共价键。吸引电子能力2.形成过程(以氢气分子的形成为例)当两个氢原子相互接近时,若两个氢原子核外电子的自旋方向 ,它们接近到一定距离时,两个氢原子的 轨道发生重叠,电子在两原子核间出现的机会 。随着核间距的减小,核间电子出现的机会增大,体系的能量逐渐 ,达到能量最低状态。若核间距进一步地减小,两原子核间的斥力增大,使体系的能量迅速上升,这种排斥作用又将氢原子推回到平衡位置。氢分子的形成过程中能量(主要指势能)随核间距的变化如上图曲线a所示。相反1s较大下降若两个氢原子核外电子的自旋方向相同,当它们相互接近时,原子间总是排斥作用占主导地位,如上图曲线b所示。所以,两个带有自旋方向 的电子的氢原子不可能形成氢分子。相同3.形成的本质当成键原子相互接近时,原子轨道发生 ,自旋方向 的_______电子形成共用电子对,两原子核间的电子密度 ,体系的能量 。重叠相反未成对增加降低4.共价键的特征共价键电子出现机会最大1.NH3分子中为什么N原子是1个,而H原子为3个?2.从电负性角度理解共价键、离子键的形成条件,完成表中内容。结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是_____键;而_____键是元素的电负性相差不大的原子之间形成的化学键。2.10.91.0离子共价归纳总结(1)共价键的饱和性决定了各种原子形成分子时相互结合的数量关系。共价键的方向性决定了分子的空间结构。(2)共价键的形成条件:电负性之差小于1.7的元素之间易形成共价键。1.正误判断,正确的打“√”,错误的打“×”(1)形成共价键后体系的能量降低,趋于稳定( )(2)共价键的饱和性是由成键原子的未成对电子数决定的( )(3)共价键的饱和性决定了分子内部原子的数量关系( )(4)共价键的方向性是由成键原子轨道的方向性决定的( )(5)原子轨道在空间都具有方向性( )√√√√×2.下列说法正确的是A.Cl2是双原子分子,H2S是三原子分子,这是由共价键的方向性决定的B.H2O与H2S的空间结构一样是由共价键的饱和性决定的C.并非所有的共价键都有方向性D.两原子轨道发生重叠后,电子在两核间出现的概率减小√解析 Cl2是双原子分子,H2S是三原子分子,这是由共价键的饱和性决定的,A不正确;氢气中的共价键没有方向性,C正确;两原子轨道发生重叠后,电子在两核间出现的概率增大,D不正确。3.下列各组物质中,所有化学键都是共价键的是A.H2S和Na2O2 B.H2O2和CaF2C.NH3和N2 D.HNO3和NaCl√解析 A项,Na2O2中既有离子键又有O—O共价键,不符合题意;B项,CaF2中只有离子键,不符合题意;D项,NaCl中只有离子键,不符合题意。易错提醒对于共价键的错误认识(1)共价键不仅存在于共价化合物中,也可以存在于离子化合物中,如NaOH、NH4Cl中都含有共价键,还可以存在于非金属单质中,如H2、O3等。(2)非金属元素之间并不是只形成共价键,也可以形成离子键,如铵盐NH4NO3只由非金属元素组成,但是含有离子键。(3)活泼的金属元素和非金属元素之间也可以形成共价键,如AlCl3中只有共价键。(4)所有共价键都有饱和性,但并不是所有的共价键都有方向性,如s-s σ键就没有方向性。返回二、共价键的类型1.σ键和π键(1)(2)分类依据:成键原子的原子轨道的 。(3)特点:一般地,σ键原子轨道重叠程度 ,键的强度 ;π键原子轨道重叠程度 ,键的强度 。“头碰头”重叠方式大大小小2.极性键和非极性键同种不偏移不同种较大负正3.配位键——特殊共价键(1)概念:由一个原子提供孤电子对与另一个有空轨道可接受电子的原子形成的共价键。(2)表示方法:在表示分子或离子的结构式时,常用“―→”表示配位键,其箭头指向 的原子。(3)配位键与共价键在形成过程上的主要不同是配位键的共用电子对是由某个原子提供的,共价键的共用电子对是成键原子双方共同提供的。接受孤电子对1.观察下图乙烷、乙烯和乙炔分子的结构,并回答下列问题。(1)它们的分子中分别由几个σ键和几个π键构成?提示 乙烷:7个σ键;乙烯:5个σ键和1个π键;乙炔:3个σ键和2个π键。(2)乙烯和乙炔的化学性质为什么比乙烷活泼?提示 乙烯的碳碳双键和乙炔的碳碳三键中分别含1个和2个π键,π键原子轨道重叠程度小,不稳定,容易断裂;而乙烷中没有π键,σ键较稳定,不易断裂。2.在气体单质分子中,一定含有σ键,可能含有π键吗?提示 稀有气体的单质分子中不含化学键,多原子分子中一定含有σ键,可能含有π键。3.BeCl2以二聚体形式存在,试标出配位键。提示 4.我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。经X射线衍射测得化合物R的晶体结构,其局部结构如图所示。归纳总结(1)σ键和π键的比较①两个s轨道只能形成σ键,不能形成π键。②两个原子形成共价键时,其原子轨道尽可能满足最大重叠程度,故两个原子形成共价键时先形成σ键,然后才能形成π键。所以两个原子间可以只形成σ键,但不能只形成π键。③σ键原子轨道重叠程度较大,电子在核间出现的概率大,强度较大,不容易断裂;π键原子轨道重叠程度较小,电子在核间出现的概率小,强度较小,容易断裂。总之,σ键一般比π键强度大,表现在化学性质的不同,通常含π键的物质的化学性质更活泼,如乙烯比乙烷更活泼。(2)非极性键、极性键、配位键的区别与联系1.下列说法对σ键和π键的认识不正确的是A.分子中只要含有共价键,则至少含有一个σ键B.s-s σ键、p-p σ键与s-p σ键都是轴对称的C.p-p σ键和p-p π键的重叠方式是相同的D.含有π键的分子在反应时,π键是化学反应的积极参与者√解析 单键为σ键,双键和三键中均含1个σ键,所以分子中含有共价键,则至少含有一个σ键,故A正确;因s-s σ键、p-p σ键与s-p σ键的电子云均为“头碰头”重叠,则为轴对称,故B正确;p-p σ键和p-p π键的重叠方式是不相同的,p-p σ键是“头碰头”重叠而p-p π键是“肩并肩”重叠,故C错误;π键不稳定,易断裂,则含有π键的分子在反应时,π键是化学反应的积极参与者,故D正确。2.若X、Y两种粒子之间可形成配位键,则下列说法正确的是A.X、Y只能是分子B.X、Y只能是离子C.若X提供空轨道,则Y至少要提供一对孤电子对D.若X提供空轨道,则配位键表示为X→Y√解析 形成配位键的两种微粒可以均是分子或者均是离子,还可以一种是分子、一种是离子,但必须是一种微粒提供空轨道、另一种微粒提供孤电子对,A、B项错误,C项正确;配位键中箭头应该指向提供空轨道的X,D项错误。3.现有以下物质:①HF ②Cl2 ③H2O ④N2 ⑤C2H4 ⑥C2H6 ⑦H2 ⑧H2O2按要求回答下列问题(填序号):(1)只含有极性键的是______;只含有非极性键的是________;既含有极性键,又含有非极性键的是________。①③②④⑦⑤⑥⑧解析 ①中H—F键、③中H—O键属于极性键;②中Cl—Cl键、④中N≡N键、⑦中H—H键属于非极性键;⑤中C—H键属于极性键,C==C键属于非极性键,⑥中C—H键属于极性键,C—C键属于非极性键,⑧中H—O键属于极性键,O—O键属于非极性键。(2)只含有σ键的是_______________;既含有σ键又含有π键的是_____。(3)含有由两个原子的s轨道重叠形成的σ键的是____。(4)含有由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键的是___________。①②③⑥⑦⑧④⑤⑦②④⑤⑥⑧解析 ②中Cl—Cl键、④中N≡N键、⑤中C==C键、⑥中C—C键、⑧中O—O键都是由一个原子的p轨道与另一个原子的p轨道重叠形成的σ键。返回随堂演练 知识落实1.下列关于共价键的说法正确的是A.共价键只存在于共价化合物中B.只含有共价键的物质一定是共价化合物C.非金属元素的原子只能通过共价键形成共价分子D.离子化合物中可能含有极性键也可能含有非极性键√1234562.下列有关σ键和π键的说法错误的是A.π键是原子轨道“肩并肩”方式重叠形成的共价键B.当原子形成分子时,首先形成σ键,可能形成π键C.σ键较π键稳定D.苯分子中含有12个σ键和3个π键√1234563.下列分子中存在的共价键类型完全相同(从σ键、π键的形成方式角度分析)的是A.CH4与NH3 B.C2H6与C2H4C.H2与Cl2 D.Cl2与N2√解析 分子中全是s-p σ键,A正确;C2H6中只存在σ键,而C2H4中存在σ键和π键,B错误;H2为s-s σ键,Cl2为p-p σ键,C错误;Cl2中只存在σ键,而N2中存在σ键和π键,D错误。1234564.丁烯二酸(HOOCCH==CHCOOH)分子结构中含有σ键、π键的个数分别是A.4个σ键,1个π键 B.11个σ键,3个π键C.4个σ键,3个π键 D.9个σ键,5个π键√12345解析 分子中含有1个C==C键,2个C==O键、2个C—H键、2个C—O键、2个C—C键、2个O—H键,其中C==C键、C==O键含有σ键、π键,其他都为σ键,则分子中含有11个σ键、3个π键。65.在N2F2分子中,所有原子均符合8电子稳定结构,则该分子中两个氮原子之间的键型构成是A.仅有一个σ键B.仅有一个π键C.一个σ键,一个π键D.一个σ键,两个π键√解析 由题给条件所有原子均符合8电子稳定结构可知,其结构式应为F—N==N—F,则两个氮原子之间为氮氮双键,含有一个σ键和一个π键。1234566.回答下列问题:(1)今有A、B两种元素,A的+1价阳离子与B的-2价阴离子的电子层结构与氖相同。①用电子式表示A与B两种元素构成的两种化合物分别为__________________和_____________________。前者只有_____键;后者既有_____键,又有______________键。12345离子离子非极性(或共价)6②元素B的气态氢化物的电子式为__________,该分子中的键属于_____(填“极性”或“非极性”)键,该氢化物与H+形成的键属于_______。③元素A的最高价氧化物对应水化物的电子式为_________________,其中既有_____键,又有_____________键。极性配位键离子极性(或共价)解析 由其离子的电子层结构判断A+为Na+,B2-为O2-。123456(2)某有机物的结构式如下所示:则分子中有____个σ键,____个π键。73解析 除共价单键全部为σ键外,双键中有一个为σ键,另一个为π键;三键中有一个为σ键,另两个为π键,故该有机物分子中σ键总数为7,π键总数为3。返回123456课 时 对 点 练题组一 共价键的形成与判断1.下列元素的原子间易形成共价键的是A.Na和Cl B.K和FC.H和Cl D.Ca和O√1234567891011121314151617181912345678910111213141516171819解析 非金属元素的原子间容易形成共价键,活泼的金属和非金属元素的原子间容易形成离子键。则Na和Cl形成的是离子键,A错误;K和F形成的是离子键,B错误;H和Cl均是非金属元素,形成的是共价键,C正确;Ca和O形成的是离子键,D错误。2.已知X、Y、Z、W四种元素原子的电负性数值如下所示:12345678910111213141516171819你认为上述四种元素中,最容易形成共价键的是A.X与Y B.X与W C.Y与Z D.Y与W√解析 当两种元素原子的电负性相差很大时,形成的将是离子键;当两种元素原子的电负性相差不大时,形成的将是共价键。3.下列说法正确的是A.所有的原子轨道都具有一定的伸展方向,因此所有的共价键都具有方 向性B.某原子跟其他原子形成共价键时,其共价键数一定等于该元素原子的 价电子数C.基态C原子有两个未成对电子,所以最多只能形成2个共价键D.1个N原子最多只能与3个H原子结合形成NH3分子,是由共价键的饱和 性决定的√12345678910111213141516171819解析 只有2个s原子轨道重叠形成的共价键没有方向性,其他原子轨道重叠形成的共价键都有方向性,A不正确;非金属元素的原子形成的共价键数目一般等于该原子最外层的未成对电子数,不能说一定等于该元素原子的价电子数,B不正确;在形成CH4分子的过程中,碳原子2s轨道中的1个电子激发到2p空轨道,这样形成了4个未成对电子,C不正确;N原子最外层2p轨道上共有3个未成对电子,1个N原子可以与3个H原子结合形成NH3,此时共价键饱和,D正确。123456789101112131415161718194.下列说法正确的是A.若把H2S写成H3S,违背了共价键的饱和性B.H3O+的存在说明共价键不具有饱和性C.所有共价键都有方向性D.两个原子轨道发生重叠后,两核中的电子不仅存在于两核之间,还会 绕两核运动√12345678910111213141516171819解析 硫原子有两个未成对电子,根据共价键的饱和性,形成的氢化物为H2S,A项正确;H2分子中氢原子的s轨道成键时,因为s轨道呈球形,所以H2中的H—H键没有方向性,C项错误;两个原子轨道发生重叠后,只有共用电子对在两核之间绕两个原子核运动,D项错误。12345678910111213141516171819题组二 共价键的分类及判断5.(2020·湖北黄梅一中高二月考)如图所示的分子中含有σ键和π键的数目分别为12345678910111213141516171819A.13 2 B.10 2 C.10 3 D.9 3√解析 题述分子中含有6个C—H键、2个C—C键、1个C==C键、1个C≡C键,单键中只含有σ键,双键中含有1个σ键和1个π键,三键中含有1个σ键和2个π键,故该分子中共有10个σ键和3个π键,故C项正确。123456789101112131415161718196.下列关于σ键和π键的理解不正确的是A.σ键可以绕键轴旋转,π键不能绕键轴旋转B.H2分子中的σ键是s-s σ键,HClO分子中的σ键都是p-p σ键C.C2H4分子和N2H4分子中都含有5个σ键D.σ键以“头碰头”方式重叠,π键以“肩并肩”方式重叠√12345678910111213141516171819解析 σ键为轴对称,π键为镜面对称,则σ键可以绕键轴旋转,π键不能绕键轴旋转,故A正确;H只有1s轨道上的电子,O的2p轨道上的电子与H的1s轨道上的电子以“头碰头”方式重叠形成s-p σ键,故B错误;乙烯分子中氢原子和碳原子之间存在共价单键,为σ键,碳碳原子之间存在共价双键,有1个σ键和1个π键,则C2H4分子中有5个σ键和1个π键,N2H4中只有5个共价单键,即含有5个σ键,故C正确;π键为p电子“肩并肩”重叠形成,而σ键为s或p电子“头碰头”重叠形成,故D正确。123456789101112131415161718197.下列一定既含有σ键又含有π键的分子是①N2O ②H2O2 ③N2 ④C3H6 ⑤HCHO ⑥Na2O2A.①②③ B.①③④ C.①③⑤ D.③④⑥√12345678910111213141516171819解析 ②中均为单键,④可能为环丙烷,此时均为单键,⑥为离子化合物且含O—O键,均不符合,只有①③⑤为既含有σ键又有含π键的分子。8.防晒霜之所以能有效地减轻紫外线对人体的伤害,是因为其有效成分的分子中含有π键,这些分子中的 π键电子可以在吸收紫外线后被激发,从而阻挡部分紫外线对皮肤的伤害。下列物质没有防晒效果的是C.肉桂酸(C6H5—CH==CH—COOH)D.酒精√123456789101112131415161718199.下列物质的分子中既有σ键又有π键,并含有非极性键的是①NH3 ②N2 ③H2O ④HCl ⑤C2H4 ⑥C2H2A.②⑤⑥ B.①②⑤⑥C.②③④ D.②④⑥√1234567891011121314151617181912345678910111213141516171819解析 ①NH3中存在H—N键,只有σ键,故错误;②N2的结构式为N≡N,含有σ键和π键,N与N之间为非极性键,故正确;③H2O中只存在H—O键,即只有σ键,故错误;④HCl的结构式为H—Cl,只存在σ键,故错误;⑤C2H4中的氢原子和碳原子之间存在共价单键、碳碳之间存在共价双键,含有σ键和π键,C与C之间为非极性键,故正确;⑥C2H2中的氢原子和碳原子之间存在共价单键、碳碳之间存在共价三键,所以含有σ键和π键,C与C之间为非极性键,故正确。10.据报道,大气中存在一种潜在的温室气体SF5—CF3(结构如图),虽然其数量有限,但它是已知气体中吸热最高的。关于SF5—CF3的说法正确的是A.分子中有σ键也有π键B.C—F是s-p σ键C.分子中不是所有原子都满足8电子稳定结构D.0.1 mol SF5—CF3分子中电子数为8NA12345678910111213141516171819√解析 只有共价单键,则分子中只有σ键,没有π键,故A错误;一个SF5—CF3分子中有94个电子,则0.1 mol SF5—CF3分子中电子数为9.4NA,故D错误。1234567891011121314151617181911.下列分子或离子中,能提供孤电子对与某些金属离子形成配位键的是①H2O ②NH3 ③F- ④CN- ⑤COA.①② B.①②③C.①②④ D.①②③④⑤√12345678910111213141516171819解析 能与某些金属离子形成配位键应为含有孤电子对的阴离子或分子,以上五种微粒的结构中都含有孤电子对。12.碳酸亚乙烯酯是锂离子电池低温电解液的重要添加剂,其结构如图所示。下列有关该物质的说法正确的是A.分子中含6个σ键B.分子式为C3H2O3C.分子中只有极性键D.8.6 g该物质完全燃烧得到6.72 L CO2√12345678910111213141516171819解析 根据题图中该分子的结构可知该物质的分子式为C3H2O3,1个分子中含有4个C—O键、1个C==C键,2个C—H键、1个C==O键,其中单键均为σ键,双键中含有1个σ键和1个π键,因此分子中含8个σ键,故A错误、B正确;12345678910111213141516171819该分子中的C—H键、C—O键等为极性键,C==C键为非极性键,故C错误;未给出CO2所处的状态,不能根据其物质的量计算体积,故D错误。13.在下列化学反应中,所断裂的共价键中,仅仅断裂σ键的是√解析 氮气中π键断裂,故A不选;乙炔中π键断裂,故B不选;氯气、氢气中均为σ键断裂,故C选;乙烯中π键断裂,故D不选。1234567891011121314151617181914.硝基胍的结构简式如图所示(“→”是一种特殊的共价单键,属于σ键)。下列说法正确的是A.硝基胍分子中只含极性键,不含非极性键B.N原子间只能形成σ键C.硝基胍分子中σ键与π键的个数比是5∶1D.10.4 g硝基胍中含有11×6.02×1023个原子√12345678910111213141516171819解析 分子中N—N键为非极性键,A项错误;N原子间可以形成σ键和π键,B项错误;分子中含有4个N—H键、1个C==N键、1个N==O键、2个C—N键、1个N—N键和1个N→O键,σ键与π键的个数比是5∶1,C项正确;12345678910111213141516171819硝基胍的分子式为CN4H4O2,相对分子质量为104,10.4 g该物质的物质的量为0.1 mol,含有1.1×6.02×1023个原子,D项错误。A.为使该转化成功进行,Y可以是酸性KMnO4溶液B.等物质的量的T、X分子中含有π键的数目均为NAC.X分子中含有的σ键个数是T分子中含有的σ键个数的2倍D.T分子中只含有极性键,X分子中既含有极性键又含有非极性键15.由短周期前10号元素组成的物质T和X,有如图所示的转化。X不稳定,易分解。下列有关说法正确的是(设NA代表阿伏加德罗常数的值)√12345678910111213141516171819解析 由结构模型可知,T为HCHO,X不稳定,易分解,则X为H2CO3,Y为氧化剂,可以选择氧化性较强的酸性KMnO4溶液,A项正确;B项中要注意等物质的量并不一定是1 mol,B项错误;X分子中含有的σ键个数为5,T分子中含有的σ键个数为3,C项错误;T、X分子中均只含有极性键,无非极性键,D项错误。1234567891011121314151617181916.分析下列化学式中画横线的元素,选出符合要求的物质填空。A.NH3 B.H2O C.HCl D.CH4 E.C2H6 F.N2(1)所有的外围电子都参与形成共价键的是____(填字母,下同)。(2)只有一个外围电子参与形成共价键的是____。(3)最外层有未参与成键的电子对的是_______。(4)既有σ键又有π键的是___。12345678910111213141516171819DECABCFF解析 NH3中氮原子与3个氢原子形成3个σ键,还有一对不成键电子;H2O中氧原子与2个氢原子形成2个σ键,还有两对不成键电子;HCl中氯原子与1个氢原子形成1个σ键,还有三对不成键电子;CH4中碳原子与4个氢原子形成4个σ键,所有外围电子都参与成键;C2H6中碳原子分别与3个氢原子及另1个碳原子形成4个σ键,所有电子都参与成键;N2中1个氮原子与另1个氮原子形成1个σ键,2个π键,还有一对不成键电子。1234567891011121314151617181917.回答下列问题:(1)1 mol CO2中含有的σ键数目为_____。(2)已知CO和CN-与N2结构相似,CO分子内σ键与π键个数之比为______。HCN分子中σ键与π键数目之比为_____。(3)C、H元素形成的化合物分子中共有16个电子,该分子中σ键与π键的个数之比为_____。(4)1 mol乙醛分子中含有 σ键的数目为________________,1个CO(NH2)2分子中含有σ键的个数为___。123456789101112131415161718192NA1∶21∶15∶16NA(或3.612×1024)718.X、Y、Z是元素周期表中的短周期元素,其中X、Y同周期,Y、Z同主族,Y原子最外层p轨道上的电子数等于前一电子层电子总数,X原子最外层的p能级中只有一个轨道填充了2个电子,而且这三种元素可以形成化合物YX2、ZX2。根据上述信息回答下列问题:(1)写出下列元素符号:X____,Y____,Z____。OCSi(2)YX2分子中含___个σ键,含___个π键。22解析 X、Y、Z元素的符号分别是O、C、Si。解析 CO2分子的结构式为O==C==O,故其中含2个σ键,含2个π键。1234567891011121314151617181919.(1)在500 K和1.01×105 Pa时,它的蒸气密度(换算成标准状况时)为11.92 g·L-1,且已知它的结构中还含有配位键,氯化铝的化学式为_______,请在其结构式中标出配位键:Al2Cl6答案 1234567891011121314151617181912345678910111213141516171819答案 12345678910111213141516171819返回本课结束
相关资料
更多









