





苏教版 (2019)必修 第一册第一单元 氯气及氯的化合物精品ppt课件
展开氧化还原反应中电子转移的表示方法
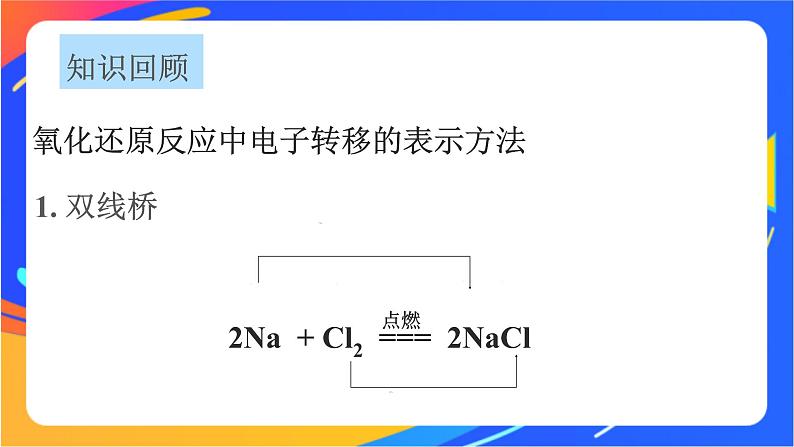
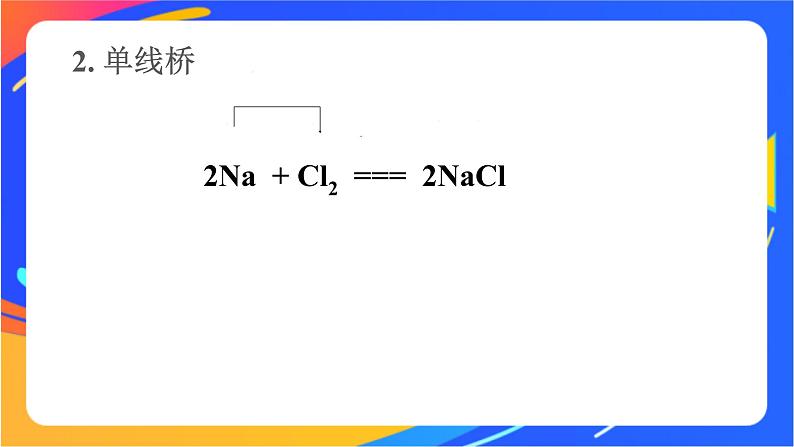
2Na + Cl2 === 2NaCl
双线桥法表示电子转移情况的步骤及特点:(1)标化合价,找变价。(2)画线桥:箭头从反应物指向生成物,起止为同一元素,箭头不代表电子转移方向。(3)写数目:电子转移的数目用 a×b e-的形式(a表示共有多少个原子得失电子,b表示每个原子得失电子数)。(4)检查:电子有得必有失,电子得失总数应相等(得电子总数=失电子总数,化合价升高总数=化合价降低总数)。
会判断氧化剂和还原剂,会比较氧化性、还原性的强弱。学会配平氧化还原反应方程式的方法。
反应物中失去电子(元素化合价升高)的物质—被氧化。
反应物中得到电子(元素化合价降低)的物质—被还原。
①氧化剂和还原剂均是指反应物质,是一种化学试剂,不是某一种元素。
②氧化剂本身被还原,发生还原反应,得到的产物是还原产物。
③还原剂本身被氧化,发生氧化反应,得到的产物是氧化产物。
二、氧化产物和还原产物氧化产物:还原剂失去电子生成的产物—(元素化合价升高)生成物。还原产物:氧化剂得到电子生成的物质—(元素化合价降低)生成物。
得到电子,化合价降低,被还原,发生还原反应
失去电子,化合价升高,被氧化,发生氧化反应
还原剂:(拥有还原性)失升氧(三点含义)。
氧化剂:(拥有氧化性)得降还(三点含义)。
三、氧化还原反应的基本概念
得失电子数相等,化合价升高与降低价数相等。
四、配平碳跟硝酸起反应的化学方程式
1. 写出反应物和生成物的化学式,列出发生氧化和还原反应的元素的化合价。
2. 列出元素的化合价的变化。
3. 求化合价升降的最小公倍数,使化合价的升高和降低的总数相等。
4. 配平其他物质的系数,把单线改成等号。
C + HNO3 NO2 + CO2 + H2O
(1)原子或离子的得电子能力越强,物质氧化性越强。(2)原子或离子的失电子能力越强,物质还原性越强。
五、 氧化性、还原性强弱判断
强调:物质氧化性或还原性的强弱由得失电子难易决定,与得失电子多少无关。
①最高价态:只具有氧化性。如:浓H2SO4、HNO3、FeCl3、KMnO4。②最低价态:只具有还原性。如: KI、H2S 、Zn、HCl 。③中间价态:既具有氧化性又有还原性。如: FeCl2 、S、SO2 、Cl2、CO 。
2. 单质的氧化性越强,对应的离子的还原性越弱。 单质的还原性越强,对应的离子的氧化性越弱。
K>Ca>Na>Mg>Al>Zn>Fe>Sn>Pb>(H)>Cu>Hg>Ag>Pt>Au
K+
1. 化合价升高的总数 = 化合价降低的总数。
氧化还原反应的配平步骤
2. 反应前后原子的总数相等。
1. 部份氧化(还原)反应,从生成物开始起配。
2. 多变,找整体配。
氧化剂+还原剂 === 还原产物 + 氧化产物
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
反应物,产物之间的关系判断:氧化剂+还原剂===还原产物+氧化产物。则氧化性:氧化剂>氧化产物,还原性:还原剂>还原产物。
1. 填空。(1) 2HCl + Fe === FeCl2 + H2↑ 氧化剂 还原剂。 元素被氧化 元素被还原。
+1 0 +2 0
(2)MnO2 + 4HCl(浓) === MnCl2 + Cl2↑ + 2H2O 氧化剂 还原剂。 被氧化 被还原 。 氧化产物 还原产物。
2. 指出下列氧化还原反应中的氧化剂、还原剂、氧化产物和还原产物
+4 -1 +2 0
氧化剂 还原剂 还原产物 氧化产物
(2)2NaCl + 2H2O === H2↑ + Cl2↑ + 2NaOH
-1 +1 0 0
还原剂 氧化剂 还原产物 氧化产物
(3)2Fe +3Cl2 === 2FeCl3
(4)Cl2 + 2NaOH === NaCl + NaClO +H2O
0 0 +3 -1
还原剂 氧化剂 既是还原产物又是氧化产物
0 -1 +1
既是还原剂又是氧化剂 还原产物 氧化产物
3. 已知K2CrO7 + 14HCl(浓) ====2KCl + CrCl3 + Cl2↑ + 7H2O, 判断在酸性条件下,氧化性:K2CrO7 Cl2 ,还原性:HCl CrCl3。
必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用优质课ppt课件: 这是一份必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用优质课ppt课件,共60页。PPT课件主要包含了学习目标,必备知识·自主学习,共用电子对,成稳定的电子层结构,N≡N,HC≡CH,将分子聚集在一起,沸点和溶解性,关键能力·合作学习,提示HC≡N等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物优秀课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册第二单元 金属钠及钠的化合物优秀课件ppt,共18页。PPT课件主要包含了学习目标,课程导入,学习探究,灯很亮,灯稍暗,弱酸水,强碱强酸,某些共价化合物,水合离子,离子反应等内容,欢迎下载使用。
高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第一单元 氯气及氯的化合物精品课件ppt: 这是一份高中化学苏教版 (2019)必修 第一册专题3 从海水中获得的化学物质第一单元 氯气及氯的化合物精品课件ppt,共16页。PPT课件主要包含了氯气泄漏事件,颜色黄绿色,密度比空气大,味道刺激性气味,物理性质,毒性有毒,状态气体,易得e-,强氧化性,Cl2等内容,欢迎下载使用。













