





还剩26页未读,
继续阅读
所属成套资源:苏教版化学必修第一册PPT课件整册
成套系列资料,整套一键下载
高中化学苏教版必修一 5.1.2 元素周期表 课件
展开
这是一份高中化学苏教版必修一 5.1.2 元素周期表 课件,共34页。
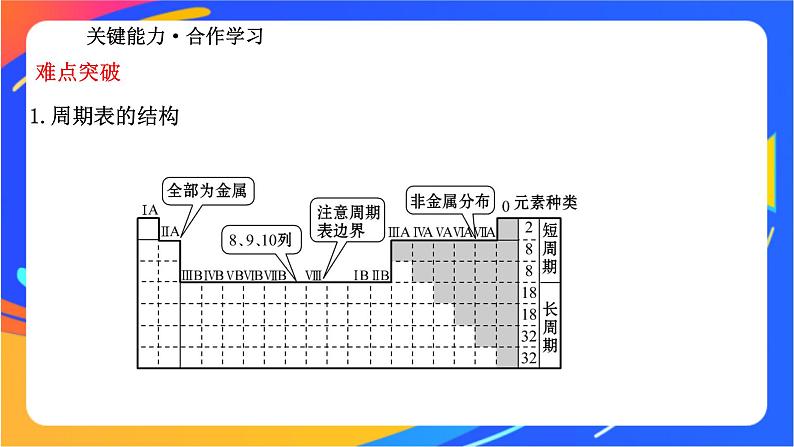
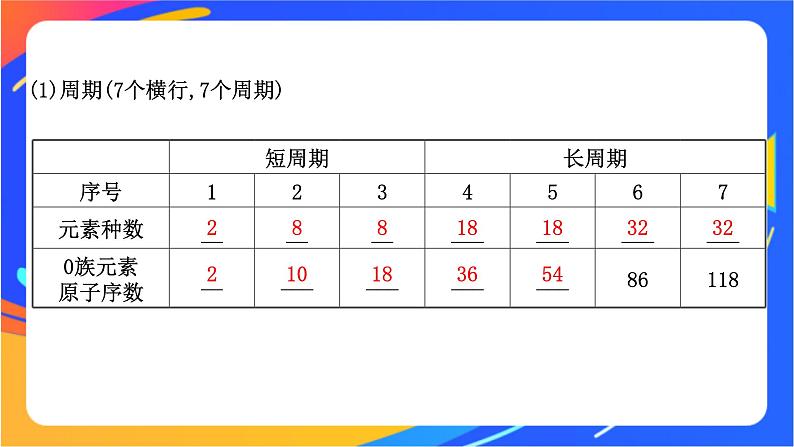
第2课时 元素周期表专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表学习目标1.认识元素周期表是元素周期律的具体体现。2.认识原子结构以及元素在元素周期表中位置的关系及元素周期表的结构。1.发展历程必备知识·自主学习知识梳理2.编排原则(1)横行:_____________,每个横行称为一个周期。(2)纵列:_________________,每个纵列称为一个族(第Ⅷ族除外)。3.周期表的结构(1)周期(即横行):__个横行,__个周期。(2)族:___个纵列,___个族,分为___族、___族、____族和__族。电子层数相同最外层电子数相同771816主副VⅢ04.常见族的别称【自主探索】1.在元素周期表中的七主七副一八一零族的含义是什么?提示:七个主族七个副族一个第八族一个零族。2.周期的序数、主族序数分别等于什么?提示:周期的序数等于元素原子的电子层数,主族序数等于元素原子的最外层电子数。3.在元素周期表中的第1、3、5、7、9、11、13、17纵列分别表示哪些族?提示:第1列是ⅠA,第3、5、7列分别是ⅢB、ⅤB、ⅦB,第9列是Ⅷ,第11列为ⅠB,第13、17列分别表示ⅢA、ⅦA。关键能力·合作学习1.周期表的结构难点突破(1)周期(7个横行,7个周期)28818183232210183654(2)族2.等量关系式(1)周期序数=原子的核外电子层数(2)主族序数=原子的核外最外层电子数=最高正价=8-|最低负价|。【合作探究】1.(思维升华)在元素周期表中,根据所学知识,以铝为例,你能从元素所在的单元格中获得该元素的哪些信息?并写出相应内容所代表的信息。(宏观辨识与微观探析)提示:能获得该元素的原子序数、元素名称、元素符号和相对原子质量等信息。2.(情境应用)在元素周期表中含元素种类最多的族是哪一族?形成化合物种类最多的族是哪一族?(证据推理与模型认知)提示:ⅢB ⅣA3.同一周期的第ⅡA族、第ⅢA族的两种元素的原子序数相差多少?(证据推理与模型认知)提示:第2、3周期时相差1;第4、5周期时相差11;第6、7周期时相差25。【典例示范】【典例】如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( ) A.5x+10 B.5xC.5x+14 D.5x+16【解题指南】解答本题需要注意以下两点:(1)熟记元素周期表的结构。(2)同主族元素的原子序数的差值。【解析】选A。分析如下:【方法导引】原子序数的奇偶关系(1)原子序数是奇数的主族元素,其所在主族序数必为奇数。(2)原子序数是偶数的主族元素,其所在主族序数必为偶数。(3)同主族元素的原子序数差的关系①位于过渡元素左侧的主族元素,即ⅠA族、ⅡA族元素,同主族、邻周期元素原子序数之差为上一周期元素的种数。②位于过渡元素右侧的主族元素,即ⅢA族~ⅦA族元素,同主族、邻周期元素原子序数之差为下一周期元素的种数。例如,氯和溴的原子序数之差为35-17=18(溴所在第4周期所含元素的种数)。(4)离子电子层结构相同的“阴上阳下”:具有相同电子层结构的离子,如a 、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中位置关系为:则它们的原子序数关系为a>b>d>c。【母题追问】(1)若A、B、C、D、E五种元素的最外层电子数之和是30,则元素A是__________。 (2)若D元素的原子最外层电子数是周期序数的2倍,则元素A的最高价氧化物对应的水化物的化学式是_____________。 提示:(1)磷或P (2)Al(OH)3【素养训练】1869年,俄国化学家门捷列夫给元素设计并建造了个新家——元素周期表,具有相同电子层数的元素被分在了同一个楼层上(同周期),具有相似性质的一个家族(同族)的元素分在了同一个单元。你瞧,元素们正在忙忙碌碌、高高兴兴地搬进新家呢!结合元素周期表回答下列问题:(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。(2)表中所列元素,属于短周期元素的有______(填字母,下同),属于主族元素的有______;g元素位于______周期_____族;i元素位于第______周期______族。 【解析】(1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期均有8种元素,分列于第1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列。由此可画出周期表的边界。(2)画出周期表的边界,对照周期表,很容易找出各元素在周期表中的位置。答案:(1)(2)a、b、c、d、e、f、ga、b、c、d、e、f 三 0 四 ⅡB【课堂小结】 三言两语话重点 (1)元素周期表结构:七个周期、18个纵列。(2)必记的性质:①随着原子序数的递增,碱金属元素的金属性逐渐增强。②随着原子序数的递增,卤族元素的非金属性逐渐减弱。③同主族的元素,随着原子序数的递增,金属性逐渐增强、非金属性逐渐减弱。1.下列原子序数所代表的元素中,全部属于主族元素的一组是 ( )A.22、26、11 B.13、15、35C.29、34、16 D.18、12、14【解析】选B。A项中22、26号元素和C项中的29号元素均为过渡元素;D项中的18号元素为0族元素。2.周期表中16号元素和4号元素的原子相比较,下列数据中前者是后者的3倍的是 ( )A.电子数 B.最外层电子数C.电子层数 D.周期数【解析】选B。原子序数等于核外电子数,周期数等于电子层数,故电子数倍数是4,最外层电子数倍数是3,电子层数即周期数的倍数是1.5。【素养新思维】 3.元素周期表中有多个分区,下图是元素周期表中的五个分区示意图。请根据此图示,完成下列几个思考问题:(1)d区和ds区属于过渡元素区,全部属于副族元素,这种说法正确吗?为什么?提示:不正确。d区和ds区属于过渡元素区的说法是正确的,但是并非均是副族元素,其中还含有Ⅷ族。(2)s区和p区均属于主族元素区的说法正确吗?提示:不正确。p区中最后一个纵列是0族元素,不是主族元素。(3)“s区全部都是金属元素”对吗?为什么?提示:不正确。s区中有H元素,属于非金属元素。(4)同周期第ⅡA族和第ⅢA族元素的原子序数一定相差1吗?提示:不一定,第2、3周期相差1;第4、5周期相差11;第6,7周期相差25。【补偿训练】 下表为元素周期表的一部分。(1)表中元素________的非金属性最强;元素__________的金属性最强;元素__________的单质在室温下呈液态(填写元素符号)。 (2)表中元素③的原子结构示意图是__________。(3)表中元素⑥、⑦氢化物的稳定性顺序为____________>____________(填写化学式,下同)。(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是________________。提示:(1)F K Br (2) (3)HCl HBr (4)HClO4 本节内容结束
第2课时 元素周期表专题5 微观结构与物质的多样性第一单元 元素周期律和元素周期表学习目标1.认识元素周期表是元素周期律的具体体现。2.认识原子结构以及元素在元素周期表中位置的关系及元素周期表的结构。1.发展历程必备知识·自主学习知识梳理2.编排原则(1)横行:_____________,每个横行称为一个周期。(2)纵列:_________________,每个纵列称为一个族(第Ⅷ族除外)。3.周期表的结构(1)周期(即横行):__个横行,__个周期。(2)族:___个纵列,___个族,分为___族、___族、____族和__族。电子层数相同最外层电子数相同771816主副VⅢ04.常见族的别称【自主探索】1.在元素周期表中的七主七副一八一零族的含义是什么?提示:七个主族七个副族一个第八族一个零族。2.周期的序数、主族序数分别等于什么?提示:周期的序数等于元素原子的电子层数,主族序数等于元素原子的最外层电子数。3.在元素周期表中的第1、3、5、7、9、11、13、17纵列分别表示哪些族?提示:第1列是ⅠA,第3、5、7列分别是ⅢB、ⅤB、ⅦB,第9列是Ⅷ,第11列为ⅠB,第13、17列分别表示ⅢA、ⅦA。关键能力·合作学习1.周期表的结构难点突破(1)周期(7个横行,7个周期)28818183232210183654(2)族2.等量关系式(1)周期序数=原子的核外电子层数(2)主族序数=原子的核外最外层电子数=最高正价=8-|最低负价|。【合作探究】1.(思维升华)在元素周期表中,根据所学知识,以铝为例,你能从元素所在的单元格中获得该元素的哪些信息?并写出相应内容所代表的信息。(宏观辨识与微观探析)提示:能获得该元素的原子序数、元素名称、元素符号和相对原子质量等信息。2.(情境应用)在元素周期表中含元素种类最多的族是哪一族?形成化合物种类最多的族是哪一族?(证据推理与模型认知)提示:ⅢB ⅣA3.同一周期的第ⅡA族、第ⅢA族的两种元素的原子序数相差多少?(证据推理与模型认知)提示:第2、3周期时相差1;第4、5周期时相差11;第6、7周期时相差25。【典例示范】【典例】如图为元素周期表中前四周期的一部分,若B元素的核电荷数为x,则这五种元素的核电荷数之和为( ) A.5x+10 B.5xC.5x+14 D.5x+16【解题指南】解答本题需要注意以下两点:(1)熟记元素周期表的结构。(2)同主族元素的原子序数的差值。【解析】选A。分析如下:【方法导引】原子序数的奇偶关系(1)原子序数是奇数的主族元素,其所在主族序数必为奇数。(2)原子序数是偶数的主族元素,其所在主族序数必为偶数。(3)同主族元素的原子序数差的关系①位于过渡元素左侧的主族元素,即ⅠA族、ⅡA族元素,同主族、邻周期元素原子序数之差为上一周期元素的种数。②位于过渡元素右侧的主族元素,即ⅢA族~ⅦA族元素,同主族、邻周期元素原子序数之差为下一周期元素的种数。例如,氯和溴的原子序数之差为35-17=18(溴所在第4周期所含元素的种数)。(4)离子电子层结构相同的“阴上阳下”:具有相同电子层结构的离子,如a 、bYn+、cZ(n+1)-、dMn-的电子层结构相同,在周期表中位置关系为:则它们的原子序数关系为a>b>d>c。【母题追问】(1)若A、B、C、D、E五种元素的最外层电子数之和是30,则元素A是__________。 (2)若D元素的原子最外层电子数是周期序数的2倍,则元素A的最高价氧化物对应的水化物的化学式是_____________。 提示:(1)磷或P (2)Al(OH)3【素养训练】1869年,俄国化学家门捷列夫给元素设计并建造了个新家——元素周期表,具有相同电子层数的元素被分在了同一个楼层上(同周期),具有相似性质的一个家族(同族)的元素分在了同一个单元。你瞧,元素们正在忙忙碌碌、高高兴兴地搬进新家呢!结合元素周期表回答下列问题:(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界。(2)表中所列元素,属于短周期元素的有______(填字母,下同),属于主族元素的有______;g元素位于______周期_____族;i元素位于第______周期______族。 【解析】(1)根据元素周期表的结构知:第一周期有2种元素,第二、三周期均有8种元素,分列于第1、2、13~18列,第四、五、六、七周期为长周期,包括1~18列。由此可画出周期表的边界。(2)画出周期表的边界,对照周期表,很容易找出各元素在周期表中的位置。答案:(1)(2)a、b、c、d、e、f、ga、b、c、d、e、f 三 0 四 ⅡB【课堂小结】 三言两语话重点 (1)元素周期表结构:七个周期、18个纵列。(2)必记的性质:①随着原子序数的递增,碱金属元素的金属性逐渐增强。②随着原子序数的递增,卤族元素的非金属性逐渐减弱。③同主族的元素,随着原子序数的递增,金属性逐渐增强、非金属性逐渐减弱。1.下列原子序数所代表的元素中,全部属于主族元素的一组是 ( )A.22、26、11 B.13、15、35C.29、34、16 D.18、12、14【解析】选B。A项中22、26号元素和C项中的29号元素均为过渡元素;D项中的18号元素为0族元素。2.周期表中16号元素和4号元素的原子相比较,下列数据中前者是后者的3倍的是 ( )A.电子数 B.最外层电子数C.电子层数 D.周期数【解析】选B。原子序数等于核外电子数,周期数等于电子层数,故电子数倍数是4,最外层电子数倍数是3,电子层数即周期数的倍数是1.5。【素养新思维】 3.元素周期表中有多个分区,下图是元素周期表中的五个分区示意图。请根据此图示,完成下列几个思考问题:(1)d区和ds区属于过渡元素区,全部属于副族元素,这种说法正确吗?为什么?提示:不正确。d区和ds区属于过渡元素区的说法是正确的,但是并非均是副族元素,其中还含有Ⅷ族。(2)s区和p区均属于主族元素区的说法正确吗?提示:不正确。p区中最后一个纵列是0族元素,不是主族元素。(3)“s区全部都是金属元素”对吗?为什么?提示:不正确。s区中有H元素,属于非金属元素。(4)同周期第ⅡA族和第ⅢA族元素的原子序数一定相差1吗?提示:不一定,第2、3周期相差1;第4、5周期相差11;第6,7周期相差25。【补偿训练】 下表为元素周期表的一部分。(1)表中元素________的非金属性最强;元素__________的金属性最强;元素__________的单质在室温下呈液态(填写元素符号)。 (2)表中元素③的原子结构示意图是__________。(3)表中元素⑥、⑦氢化物的稳定性顺序为____________>____________(填写化学式,下同)。(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是________________。提示:(1)F K Br (2) (3)HCl HBr (4)HClO4 本节内容结束
相关资料
更多









