




苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用优质ppt课件
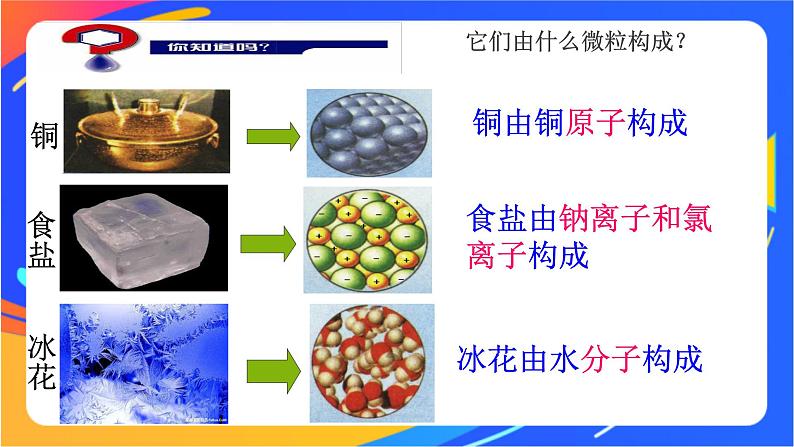
展开一百多种元素能形成了几千万种物质,构成这些物质的微粒有哪些?这些微粒是如何彼此结合而构成物质的呢?
食盐由钠离子和氯离子构成
1.通过NaCl的形成过程,理解离子键的形成过程与形成条件。2.知道离子键、离子化合物的概念。3.能用电子式表示离子化合物的形成过程。
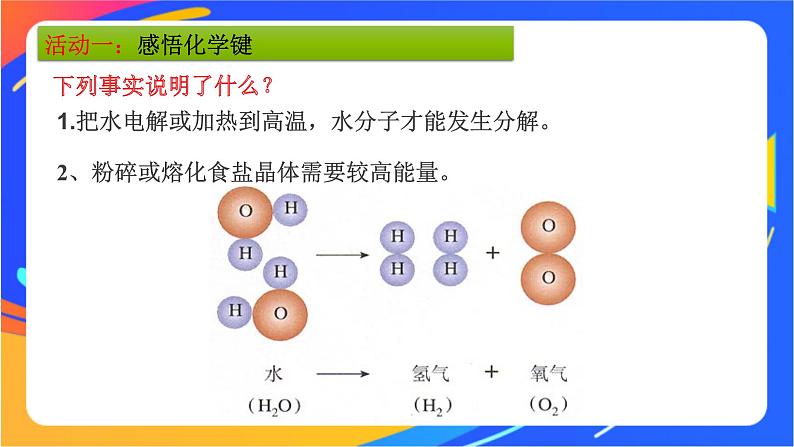
2、粉碎或熔化食盐晶体需要较高能量。
1.把水电解或加热到高温,水分子才能发生分解。
2.粉碎或熔化食盐晶体需要较高能量。
离子键和共价键是两种常见的化学键。
“键”现代汉语词典这样解释:插门的金属棍子,古称销钉。从中窥知: “键”的作用是连接物体 ,使之合而为一。
物质中直接相邻的原子或离子间强烈的相互作用。
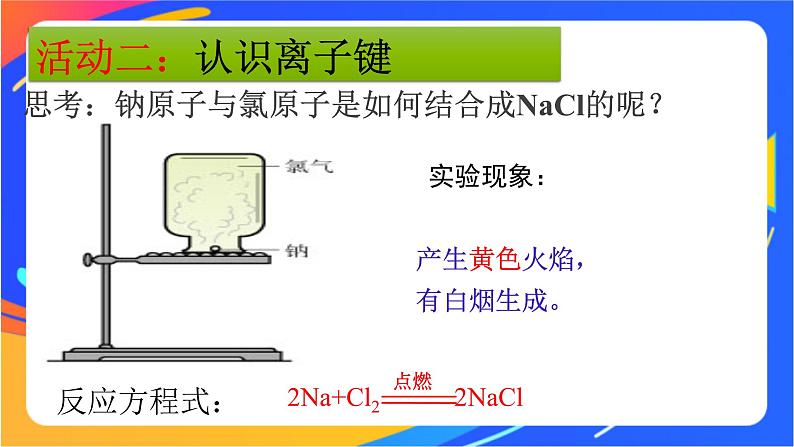
2Na+Cl2 2NaCl
思考:钠原子与氯原子是如何结合成NaCl的呢?
产生黄色火焰,有白烟生成。
你能画出图中的原子(离子)结构示意图?
问题1:在氯化钠晶体中,Na+和Cl- 之间存在哪些 作用力?
引力:Na+离子和Cl-离子间的静电相互吸引作用
斥力:电子与电子、原子核与原子核间的相互排斥作用
NaCl的晶体结构示意图
问题2:你能想象出氯化钠晶体中阴、阳离子的排列情况吗?
问题3:结合刚才的分析思考下列问题:(1)什么是离子键?(2)成键的微粒是什么?(3)离子键形成的条件是什么?(4)什么是离子化合物?(5)常见的物质中哪些是离子化合物?
使带相反电荷的阴、阳离子结合的相互作用
大多数的金属氧化物、盐和强碱
下列物质中哪些含有离子键?哪些属于离子化合物?
问题1:由钠原子变为钠离子、氯原子变为氯离子分析原子结构的哪部分发生变化?能否用更简便的方法表示?
问题2:请阅读课本并思考下列问题 (1)什么是电子式?(2)如何书写原子电子式? (3)如何书写离子电子式?
1.原子电子式的写法:
在元素符号周围用小黑点(或×)标出原子最外层电子个数(均匀分散)。
在元素符号周围用小黑点(或×)来表示原子或离子的最外层电子,这种式子叫电子式。
1.试写出Mg、Al、N、S的电子式。
2.试写出Li、C、P、Ar的电子式。
在元素符号周围标出最外层电子总数,再标 [ ] 和电荷数
阳离子的电子式就是其离子符号
试写出Na+、Al 3+、F-、S2-的电子式。
Na+、 Al 3+
3.离子化合物电子式的书写
注意:由于在离子化合物中阴阳离子是交替排列的。对于相同的离子不得合并。
离子键:使阴、阳离子结合成化合物的静电作用。
1.下列各数值表示有关元素的原子序数,其所表示的各 原子间能以离子键形成稳定化合物的是( ) A.10与12 B.6与16 C.14与8 D.11与17
2.下列微粒或化合物电子式错误的是( )
3.下列说法中正确的是 ( )A. 原子之间的相互作用叫做化学键B.阴阳离子间的相互吸引形成离子键C.只有金属元素和非金属元素化合时才能形成离子键D.离子化合物一定含有离子键
苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用教案配套课件ppt: 这是一份苏教版 (2019)必修 第一册第二单元 微粒之间的相互作用教案配套课件ppt,共34页。
苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用课前预习课件ppt: 这是一份苏教版 (2019)必修 第一册专题5 微观结构与物质的多样性第二单元 微粒之间的相互作用课前预习课件ppt,共34页。PPT课件主要包含了学业基础,阳离子,氯气分子,氯原子,空间网状,直接相邻的原子或离子,离子键,共价键,电子式,最外层电子等内容,欢迎下载使用。
高中化学必修一 专题4.3.1 离子键: 这是一份高中化学必修一 专题4.3.1 离子键,共17页。













