






所属成套资源:新苏教版化学选择性必修1课件PPT整册
高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动优秀课件ppt
展开
这是一份高中化学苏教版 (2019)选择性必修1第三单元 化学平衡的移动优秀课件ppt,共60页。PPT课件主要包含了内容索引,课时对点练,正反应,逆反应,吸热反应,放热反应,v′逆,正误判断,增大压强,加入催化剂等内容,欢迎下载使用。
1.变化观念与平衡思想:从变化的角度认识化学平衡的移动,即可逆反应达到平衡后,温度改变,平衡将会发生移动而建立新的平衡。
2.证据推理与模型认知:通过实验论证说明温度、催化剂的改变对化学平衡移动的影响,构建分析判断化学平衡移动方向的思维模型(勒夏特列原理)。
一、温度变化对化学平衡的影响
二、化学平衡移动原理(勒夏特列原理)
温度变化对化学平衡的影响
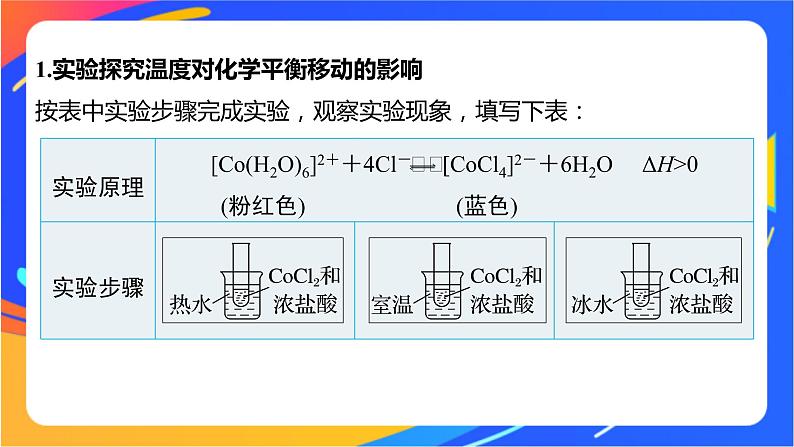
1.实验探究温度对化学平衡移动的影响按表中实验步骤完成实验,观察实验现象,填写下表:
2.温度变化对化学平衡移动的影响规律(1)任何化学反应都伴随着能量的变化(放热或吸热),所以任意可逆反应的化学平衡状态都受温度的影响。(2)当其他条件不变时:升高温度,化学平衡向 方向移动;降低温度,化学平衡向 方向移动。
3.用v—t图像分析温度对化学平衡移动的影响已知反应:mA(g)+nB(g) pC(g) ΔH<0,当反应达平衡后,若温度改变,其反应速率的变化曲线分别如图所示:
①t1时刻,升高温度,v′正、v′逆均 ,但吸热反应方向的 增大幅度大,则v′逆>v′正,平衡 移动。
②t1时刻,降低温度,v′正、v′逆均 ,但吸热反应方向的 减小幅度大。则v′正>v′逆,平衡 移动。
4.催化剂对化学平衡的影响(1)催化剂对化学平衡的影响规律当其他条件不变时:催化剂不能改变达到化学平衡状态时反应混合物的组成,但是使用催化剂能改变反应达到化学平衡所需的时间。(2)用v—t图像分析催化剂对化学平衡的影响t1时刻,加入催化剂,v′正、v′逆同等倍数增大,则v′正=v′逆,平衡不移动。
提醒 一般情况下,催化剂都是正催化剂,即可以加快反应速率,特殊情况下,也使用负催化剂,减慢反应速率。
(1)温度可以影响任意可逆反应的化学平衡状态( )(2)升高温度,反应速率加快,化学平衡正向移动( )(3)升高温度,反应速率加快,但反应物的转化率可能降低( )(4)化学平衡正向移动,反应物的转化率一定增大( )(5)C(s)+CO2(g) 2CO(g) ΔH>0,其他条件不变时,升高温度,CO2的平衡转化率增大( )(6)催化剂能加快反应速率,提高单位时间内的产量,也能提高反应物的转化率( )
1.已知反应:2NO2(g)(红棕色) N2O4(g)(无色) ΔH=-56.9 kJ·ml-1,设计实验探究温度对上述平衡有什么影响?
提示 (1)把NO2、N2O4的混合气体盛装在两个连通的烧瓶里,然后用弹簧夹夹住橡胶管,把烧瓶A放入热水中,把烧瓶B放入冰水中,与常温时烧瓶C内气体的颜色进行对比,如图所示:
(2)现象:放在热水中的气体颜色变深,放在冰水中的气体颜色变浅。(3)结论:其他条件不变时,升高温度,化学平衡向吸热反应方向移动,降低温度,化学平衡向放热反应方向移动。
2.已知反应:mA(g)+nB(g) pC(g) m+nnB.Q0,B、D错;
温度不变,容器体积增大,即由1 L变为2 L,若平衡不移动,此时c(Y)应减小为原来的一半,现c(Y)比原来的一半大,即减压,平衡向右移动,即向气体体积增大的方向移动,所以mT2,则K15.00 ml·L-1
A项,500 s内,N2O5的浓度变化量为(5.00-3.52) ml·L-1=1.48 ml·L-1,v(N2O5)= =2.96×10-3 ml·L-1·s-1;
B项,分析如下: 2N2O5(g) 4NO2(g)+O2(g)起始/(ml·L-1) 5.00 0 0转化/(ml·L-1) 2.50 5.00 1.25平衡/(ml·L-1) 2.50 5.00 1.25
C项,该反应的正反应为吸热反应,升高温度,平衡常数增大,故K1>K2;D项,达到平衡后,其他条件不变,将容器的体积压缩到原来的 ,相当于增大压强,平衡向左移动,则c(N2O5)>5.00 ml·L-1。
15.2021年1月,中国按照国际标准研制的拥有自主知识产权的大型客机C919完成了高寒试验试飞任务,科学家在实验室中研究的利用催化技术将飞机尾气中的NO和CO转变成CO2和N2的反应为2NO(g)+2CO(g) N2(g)+2CO2(g) ΔH<0。(1)假设在密闭容器中发生上述反应,达到平衡时,下列措施能提高NO转化率的是______(填字母)。A.选用更有效的催化剂B.升高反应体系的温度C.降低反应体系的温度D.缩小容器的容积
使用催化剂不能改变平衡状态,不影响反应物的转化率,故A不符合题意;该反应正向为放热反应,升高温度,平衡逆向移动,NO的转化率降低,故B不符合题意;降低反应体系的温度,平衡正向移动,NO的转化率提高,故C符合题意;该反应的正反应是气体体积减小的反应,缩小容器的容积,相当于加压,平衡正向移动,NO的转化率提高,故D符合题意。
(2)若将1 ml NO和2 ml CO通入2 L的恒容密闭容器中,在一定条件下发生上述反应,反应中生成的N2的物质的量浓度随时间的变化情况如图所示。则NO从反应开始到平衡时的平均反应速率v(NO)=___________________,4 min末CO的浓度为_____ml·L-1。
0.05 ml·L-1·min-1
NO从反应开始到平衡时的平均反应速率v(NO)=2v(N2)= ×2=0.05 ml·L-1·min-1;4 min末CO的浓度为(1-0.2) ml·L-1=0.8 ml·L -1。
16.(1)亚硝酰氯(ClNO)是有机合成中常用的试剂,已知:2NO(g)+Cl2(g) 2ClNO(g) ΔHT2>T3。
①与实验Ⅰ相比,实验Ⅱ除温度不同外,还改变的条件是____________________。
ΔH
相关课件
这是一份高中化学专题2 化学反应速率与化学平衡第三单元 化学平衡的移动图文课件ppt,共25页。PPT课件主要包含了勒夏特列原理,要点二勒夏特列原理等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动作业ppt课件,共24页。PPT课件主要包含了C加入催化剂,加入催化剂等内容,欢迎下载使用。
这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动优秀课件ppt,共60页。PPT课件主要包含了内容索引,课时对点练,原有的平衡状态,新的平衡状态,溶液由黄色变为橙色,正反应,逆反应,逆反应方向,正反应方向,正误判断等内容,欢迎下载使用。










