






苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt
展开类型1 c(Mn+)、c(An-)型图像如图为BaSO4沉淀溶解平衡曲线(温度一定):
(1)曲线上的任意一点均为达到沉淀溶解平衡的平衡点,可利用曲线上点的坐标来计算Ksp(BaSO4)。(2)曲线上方的点为过饱和溶液,c(Ba2+)·c( )>Ksp(BaSO4),有沉淀生成。(3)曲线下方的点为不饱和溶液,c(Ba2+)·c( )<Ksp(BaSO4),无沉淀生成,加入BaSO4可继续溶解。
类型2 S—pH或c(Mn+)—pH图像Fe(OH)3和Cu(OH)2的c—pH关系如图(温度一定):
图中曲线为相应金属离子氢氧化物的沉淀溶解平衡曲线,可利用图像判断有关氢氧化物的Ksp的大小以及离子分离方法的选择。
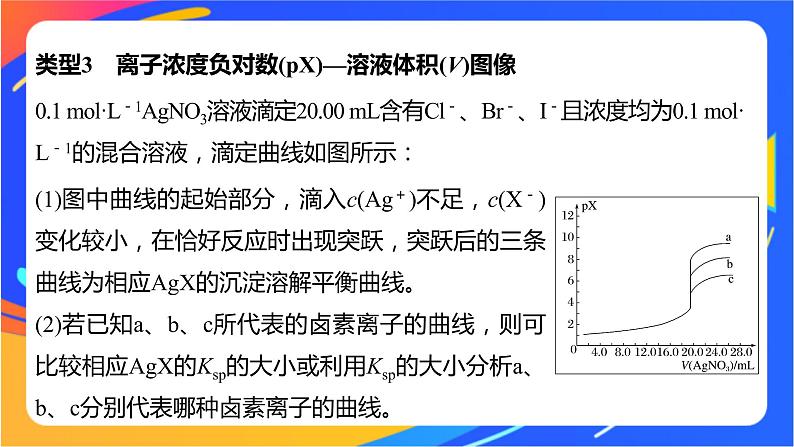
类型3 离子浓度负对数(pX)—溶液体积(V)图像
0.1 ml·L-1AgNO3溶液滴定20.00 mL含有Cl-、Br-、I-且浓度均为0.1 ml·L-1的混合溶液,滴定曲线如图所示:
(1)图中曲线的起始部分,滴入c(Ag+)不足,c(X-)变化较小,在恰好反应时出现突跃,突跃后的三条曲线为相应AgX的沉淀溶解平衡曲线。(2)若已知a、b、c所代表的卤素离子的曲线,则可比较相应AgX的Ksp的大小或利用Ksp的大小分析a、b、c分别代表哪种卤素离子的曲线。
类型4 离子浓度对数或负对数曲线解题时要理解pH、pOH、pC的含义,以及图像横、纵坐标代表的含义,通过曲线的变化趋势,找到图像与已学化学知识间的联系。(1)pH(或pOH)—pC图横坐标:将溶液中c(H+)取负对数,即pH=-lg c(H+),反映到图像中是c(H+)越大,pH越小,pOH则相反。纵坐标:将溶液中某一微粒浓度[如c(A)]或某些微粒浓度的比值取负对数,即pC=-lg c(A),反映到图像中是c(A-)越大,pC越小。
例如:常温下,几种难溶氢氧化物的饱和溶液中金属离子浓度的负对数与溶液的pH关系如图所示。①直线上的任意一点都达到沉淀溶解平衡。②由图像可得Fe3+、Al3+、Fe2+、Mg2+完全沉淀的pH分别为3.7、4.8、8.3、11.2。
(2)pC—pC图纵、横坐标均为一定温度下,溶解平衡粒子浓度的负对数。例如:已知p(Ba2+)=-lg c(Ba2+),p(酸根离子)=-lg c(酸根离子),酸根离子为 。某温度下BaSO4、BaCO3的沉淀溶解关系如图所示,
①直线上的任意一点都达到沉淀溶解平衡。②p(Ba2+)=a,即c(Ba2+)=10-a ml·L-1时,p( )>p( ),从而可知Ksp(BaSO4)
1.在t ℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是A.t ℃时,Ag2CrO4的Ksp为1×10-8B.饱和Ag2CrO4溶液中加入K2CrO4不能 使溶液由Y点变为X点C.t ℃时,Y点和Z点Ag2CrO4的Ksp相等D.t ℃时,将0.01 ml·L-1 AgNO3溶液滴入20 mL 0.01 ml·L-1 KCl和0.01 ml· L-1 K2CrO4的混合溶液中,Cl-先沉淀
Y点、Z点溶液的温度相同,则Ksp相同,C项正确;
2.25 ℃时,FeS饱和溶液中,Fe2+与S2-的物质的量浓度的负对数关系如图所示。对于图中的a点,下列说法正确的是A.a点表示FeS的饱和溶液,且c(Fe2+)
a点c(Fe2+)=10-10 ml·L-1>c(S2-)=10-12 ml·L-1,表示FeS的不饱和溶液,B项正确。
3.常温下,用0.100 ml·L-1AgNO3溶液滴定50.0 mL 0.050 0 ml·L-1KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lg c(Cl-)、pAg=-lg c(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5ml·L-1,则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是A.AgCl的沉淀溶解平衡常数Ksp的数量级为10-10B.为防止指示剂失效,溶液应维持中性或弱碱性C.滴定中指示剂的有效浓度应维持在2.0× 10-2ml·L-1D.滴定完后加入1 mL 0.01 ml·L-1 H2SO4会产生新的沉淀
根据图像,当pCl=pAg时,溶液中c(Ag+)=c(Cl-)=10-5ml·L-1,则AgCl的沉淀溶解平衡常数Ksp的数量级为10-10,故A正确;
指示剂使用的是K2CrO4,溶液中存在Ag+,如果溶液呈酸性,则 易形成 ,如果溶液呈碱性,则易生成Ag2O,因此溶液需维持中性或弱碱性,故B正确;溶液中Ag+沉淀完全时c(Ag+)=10-5 ml·L-1,形成Ag2CrO4时,所需 =2.0×10-2 ml·L-1,故C正确;
滴定完后,溶液中c(Ag+)=10-5ml·L-1,加入1 mL 0.01 ml·L-1H2SO4,则产生Ag2SO4时需要 =1.4×105 ml·L-1,显然H2SO4的量是不够的,所以不能产生新的沉淀,故D错误。
4.25 ℃时,PbR(R2-为 )的沉淀溶解平衡关系如图所示。已知25 ℃时,Ksp(PbCO3)
向X点对应的饱和溶液中加入少量Pb(NO3)2固体,溶液中c(Pb2+)增大,由图可知,Y点c(Pb2+)小于X点,故D错误。
5.一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示。已知:pM=-lg c(M),p( )=-lg c( )。下列说法正确的是A.MgCO3、CaCO3、MnCO3的Ksp依次增大B.a点可表示MnCO3的饱和溶液,且c(Mn2+) =c( )C.b点可表示CaCO3的饱和溶液,且c(Ca2+)
6.向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl-,降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq) 2Cu+(aq) ΔH1=a kJ·ml-1Cl-(aq)+Cu+(aq) CuCl(s) ΔH2=b kJ·ml-1实验测得电解液pH对溶液中残留c(Cl-)的影响如图所示。下列说法正确的是
A.向电解液中加入稀硫酸,有利于Cl-的去除B.溶液pH越大,Ksp(CuCl)越大C.反应达到平衡,增大c(Cu2+),c(Cl-)减小
根据图像,溶液的pH越小,溶液中残留c(Cl-)越大,因此向电解液中加入稀硫酸,不利于Cl-的去除,故A错误;
Ksp(CuCl)只与温度有关,与溶液pH无关,故B错误;
根据Cu(s)+Cu2+(aq) 2Cu+(aq),增大c(Cu2+),平衡正向移动,使得c(Cu+)增大,促进Cl-(aq)+Cu+(aq) CuCl(s)右移,c(Cl-)减小,故C正确;
7.金属氢氧化物在酸中的溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属的氢氧化物在不同pH下的溶解度[S/(ml·L-1)]如图所示。
(1)pH=3时溶液中铜元素的主要存在形式是______。
据图知pH=4~5时,Cu2+开始沉淀为Cu(OH)2,因此pH=3时,溶液中铜元素主要以Cu2+的形式存在。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH为_____(填字母)。A.<1 B.4左右 C.>6
若要除去CuCl2溶液中的Fe3+,应保证Fe3+完全沉淀,而Cu2+还未沉淀,据图知pH为4左右。
(3)在Ni(OH)2溶液中含有少量的C2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是__________________________________。
C2+和Ni2+沉淀的
据图知,C2+和Ni2+沉淀的pH范围相差太小,无法通过调节溶液pH的方法除去Ni(OH)2溶液中的C2+。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水,生成[Cu(NH3)4]2+,写出反应的离子方程式:_____________________________________________________。
Cu(OH)2+4NH3·H2O===
[Cu(NH3)4]2++2OH-+4H2O
(5)已知一些难溶物的溶度积常数如下表:
某工业废水中含有Cu2+、Pb2+、Hg2+,最适宜向此工业废水中加入过量的______(填字母)除去它们。A.NaOH B.FeS C.Na2S
在FeS、CuS、PbS、HgS四种硫化物中,FeS的溶度积最大,且与其他三种物质的溶度积差别较大,在废水中加入FeS,Cu2+、Pb2+、Hg2+均可分别转化为溶度积更小的沉淀,过量的FeS也可一起过滤除去,且不会引入新的杂质。
苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第四单元 沉淀溶解平衡背景图课件ppt: 这是一份苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第四单元 沉淀溶解平衡背景图课件ppt,共13页。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡作业课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡作业课件ppt,共12页。
高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt: 这是一份高中化学苏教版 (2019)选择性必修1第四单元 沉淀溶解平衡一等奖课件ppt,共60页。PPT课件主要包含了内容索引,沉淀转化原理,沉淀转化的应用,课时对点练,AgCl>,AgI>Ag2S,解的AgI,的方向移动,沉淀溶解平衡的移动,溶解能力相对较强等内容,欢迎下载使用。













