


2019届湖南省三湘名校教育联盟高三上学期第二次大联考化学试题 PDF版
展开化学试卷答案
.一、单项选择题(本题共16小题,每小题3分,共48分)
题号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 |
答案 | D | B | B | C | A | C | C | D | B | D | C | B | B | D | C | B |
二、填空题(本题包括4小题,共52分,除标注外每空2分)
17、(11分)
(1). 分液漏斗(1分) 防止Cl2与KOH反应生成KClO3
(2). HCl (1分) 吸收Cl2,防止污染空气(1分)
(3). 3ClO-+2Fe3++10OH-==2FeO42-+3Cl-+5H2O
(4). 将滤液置于冰水浴中,向滤液中加入饱和KOH溶液
(5). 90%
18、(14分)
(1)250 mL容量瓶、胶头滴管
(2)升高温度(加热)、搅拌、增大硫酸浓度(答案合理即可)(1分)
(3)2Cr3++3H2O2+H2OCr2O72-+8H+ A(1分)
(4)Na+、Ca2+、Mg2+
pH超过8会使部分Al(OH)3溶解生成AlO2-,最终影响Cr(Ⅲ)回收与再利用
(5)Ca2+、Mg2+
(6)3SO2+2Na2CrO4+12H2O2CrOH(H2O)5SO4↓+Na2SO4+2NaOH
或者:4SO2+2Na2CrO4+11H2O2CrOH(H2O)5SO4↓+Na2SO4+Na2SO3
19、(12分)
(1)①ac(2分)
② CO(g)+H2O(g) CO2(g)+H2(g) ΔH = -41.2 kJ/mol (2分)
<(2分)
(2)①ab(2分) ②O2+4H++4e-=2H2O(2分) 11.2L(2分)
20、(共15分)
(1)碳碳双键、羧基 (2)酯化反应(1分)
(3)
(4)①
②(5)①5
【答案详解】
3、解析:能氧化成醛的醇必须含—CH2OH,剩下—C3H5基团有四种情况,分别为丙烯基3种,环丙基1种。答案:B
4、解析:从化合价分析,CuSO4作氧化剂,FeS2既作氧化剂又作还原剂;每生成7molCu2S转移的电子数21mol,每生成1molCu2S转移的电子数3mol; 1 mol硫酸铜可以氧化1/7mol的-1价的硫。答案C
6、解析:选项A,反应到达终点时:c(CH3COO—)+c(CH3COOH)=0. 05 mol/L。选项B,滴加BOH的过程中,水的电离程度先增大后减小,选项A,无法判断一元碱BOH的碱性强弱,所以也无法判断pH=7时,溶液中的酸是否反应完,答案:C
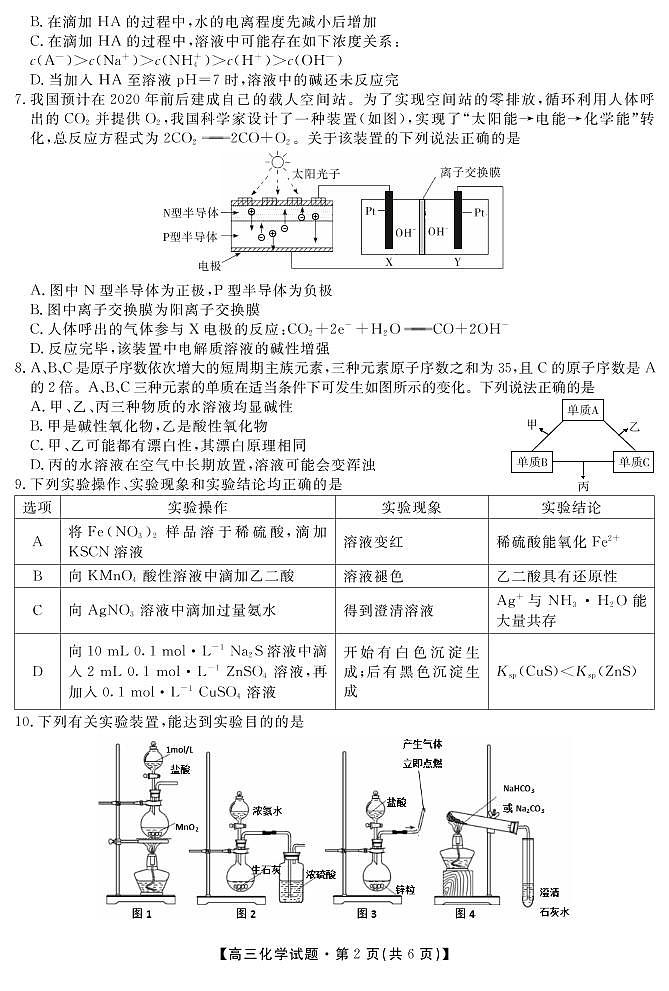
7、【解析】题图中左边为原电池,由原电池中阳离子移向正极,阴离子移向负极,可以判断N型半导体为负极,P型半导体为正极,A错误。电极X接原电池的负极,为电解池的阴极,则电极Y为阳极,OH-在阳极发生氧化反应,电极反应式为4OH--4e-===2H2O+O2↑;CO2在阴极发生还原反应,电极反应式为2CO2+4e-+2H2O===2CO+4OH-,可以看出OH-在阳极消耗,在阴极生成,故离子交换膜为阴离子交换膜,B错误。电解过程中OH-的数目基本不变,故电解质溶液的碱性不变,D错误。CO2在X电极上发生得电子的还原反应,C正确。
16、由题意可知,生成的n(CO2)=n(CaCO3)=
5.00g |
100g/mol |
=0.05mol,n(CO)=
1.12L |
22.4L/mol |
=0.05mol,
A.生成的n(CO2)=n(CaCO3)=
5.00g |
100g/mol |
=0.05mol,n(CO)=
1.12L |
22.4L/mol |
=0.05mol,根据C守恒可知,参加反应的C的质量=(0.05mol+0.05mol)×12g/mol=1.2g,故还有2g-1.2g=0.8g碳未参与反应,故A正确;
B.假设CuO完全被还原为Cu,根据Cu守恒生成Cu的质量=
16g |
80g/mol |
×64g/mol=12.8g,由产物中CO2、CO中的O原子守恒可知失去氧的质量=(0.05mol×2+0.05mol)×16g/mol=2.4g,故CuO反应后的总质量=16g-2.4g=13.6g,故反应后固体中Cu的质量小于12.8g,故B错误;
C.反应后固体总质量=16g+2g-0.05mol×(44g/mol+28g/mol)=14.4g,故C正确;
D.反应后m(O)=13.6g-12.8g=0.8g,Cu2O、CuO均含有1个氧原子,根据氧原子守恒可知反应后的固体混合物中氧化物的物质的量=
0.8g |
16g/mol |
=0.05 mol,故D正确,故选B.
17、【分析】根据实验装置图可知,A装置中用二氧化锰与浓盐酸加热制得氯气,氯气中有挥发出的来的氯化氢,所以B装置中饱和食盐水是除去氯气中的氯化氢,装置C中用氯气与氢氧化钾溶液应制得次氯酸钾,为防止在较高温度下生成KClO3,C装置中用冰水浴,反应的尾气氯气用D装置中氢氧化钠吸收,(1)根据装置图可知仪器名称;Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,据此判断冰水浴的原因;(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收;(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,据此书写该反应的离子方程式;(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥,据此答题;(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,利用(NH4)2Fe(SO4)2的物质的量可计算得高铁酸钾的质量,进而确定K2FeO4样品的纯度。
【详解】(1)根据装置图可知仪器a的名称是分液漏斗,Cl2与KOH溶液在20℃以下反应生成KClO,在较高温度下则生成KClO3,所以冰水浴的目的是防止Cl2与KOH反应生成KClO3;
(2)氯气中有氯化氢需要除去,氯气有毒,需要进行尾气吸收,所以装置B吸收的气体是HCl,装置D的作用是吸收Cl2,防止污染空气;
(3)足量KClO中依次加入KOH溶液、Fe(NO3)3溶液,发生氧化还原反应生成K2FeO4、KCl和水等,反应的离子方程式为3ClO-+2Fe3++10OH-═2FeO42-+3Cl-+5H2O;
(4)K2FeO4易溶于水、微溶于浓KOH溶液,所以提纯K2FeO4粗产品时可以①将一定量的K2FeO4粗产品溶于冷的3 mol/L KOH溶液中,②过滤,③将滤液置于冰水浴中,向滤液中加入饱和KOH溶液,④搅拌、静置、过滤,用乙醇洗涤2~3次,⑤在真空干燥箱中干燥;
(5)根据反应Cr(OH)4-+FeO42-═Fe(OH)3↓+CrO42-+OH-和Cr2O72-+6Fe2++14H+═6Fe3++2Cr3++7H2O,可得关系式2FeO42-~Cr2O72-~6Fe2+,根据题意可知,(NH4)2Fe(SO4)2的物质的量为0.03L×0.01000 mol/L=0.0003mol,所以高铁酸钾的质量为0.0003mol×× =0.198g,所以K2FeO4样品的纯度为×100%=90.0%。
【点睛】本题考查实验制备方案、氧化还原反应的离子方程式的书写、物质的分离提纯、对条件与操作的分析评价、纯度的计算等,是对学生综合能力的考查,注意题目信息的迁移运用,难度中等。
18、【解析】(1)设需要浓硫酸的体积为V mL,则18.4 mol·L-1×V mL=250 mL×4.8 mol·L-1,解得V≈65。(2)为了提高酸浸的浸出率,可以延长浸取时间、加快溶解速率等。(3)H2O2具有强氧化性,能氧化Cr3+为Cr2O72-。(4)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入过氧化氢氧化铬离子为Cr2O72-,加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。溶液pH=8,Fe3+、Al3+沉淀完全,滤液Ⅱ中阳离子主要是Na+、Ca2+和Mg2+;超过pH=8,氢氧化铝是两性氢氧化物会溶解于强碱溶液中,影响铬离子的回收利用。(5)钠离子交换树脂交换的离子是钙离子和镁离子。(6)二氧化硫具有还原性,被Na2CrO4氧化为SO42-,Na2CrO4被还原为CrOH(H2O)5SO4,依据原子守恒写出反应的化学方程式:3SO2+2Na2CrO4+12H2O2CrOH(H2O)5SO4↓+Na2SO4+2NaOH。
19、【解析】(1)①H2SO4在常温下很稳定不易分解,所以H2SO4分解肯定需要加热,故a对;H2SO4仅仅是反应过程中的中间产物,由反应Ⅱ是一可逆反应,可判断HI不太稳定,d选项未指明气体在标准状况下。
②根据离子积Qc= (2.0×2.53)/(2.0×5.0)>1.0,故反应仍需向逆方向进行才能达到平衡,即v正<v逆。
(2) ①CO(g)+2H2(g)CH3OH(g)是一个反应前后气体体积减小的反应,故当压强不变时表明反应达到平衡,a对。CO与H2的体积比保持不变时,说明平衡不再移动故b对;根据质量守恒,体系中碳元素的百分含量不会变化故错对;任何情况下,单位时间内消耗1 mol CO,同时生成l mol CH3OH,d错。
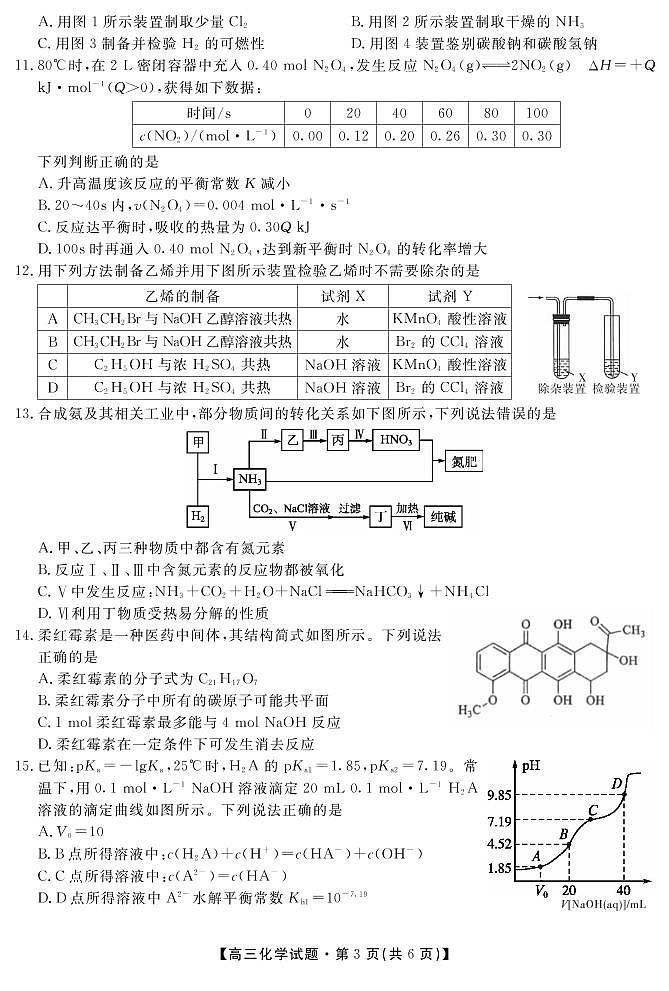
②由达到平衡所需要的时间长短知,T1<T2,当温度由T2→T1(降温)时,CO的转化率增大,说明降低温度时平衡向右移动,故正反应是放热反应,ΔH <0,K1> K2。
③根据H+运动方向及d口排出H2O知,从b口进入的物质是甲醇、从c口进入的物质是O2,由于电解质溶液是酸,故正极反应为O2+4H++4e-=2H2O,当有3mol电子发生转移时,有0.5mol甲醇反应,生成二氧化碳为0.5mol在标准状况下的气体 11.2L。
2021届湖南省三湘名校教育联盟教改共同体高三12月第二次大联考化学试卷 PDF版: 这是一份2021届湖南省三湘名校教育联盟教改共同体高三12月第二次大联考化学试卷 PDF版,文件包含化学试卷pdf、化学参考答案pdf等2份试卷配套教学资源,其中试卷共10页, 欢迎下载使用。
2022届湖南省三湘名校教育联盟高三上学期第二次大联考 化学试题(PDF版): 这是一份2022届湖南省三湘名校教育联盟高三上学期第二次大联考 化学试题(PDF版),文件包含化学试题-PDF原版pdf、化学答案-Word版doc等2份试卷配套教学资源,其中试卷共11页, 欢迎下载使用。
2023湖南省三湘名校教育联盟高三上学期第一次大联考化学试卷word含答案: 这是一份2023湖南省三湘名校教育联盟高三上学期第一次大联考化学试卷word含答案,共16页。试卷主要包含了可能用到的相对原子质量,设为阿伏加德罗常数的值,山奈酚,甲硫醇,化学上常用标准电极电势,可以制取黄钠铁矾【化学式为】和等内容,欢迎下载使用。












