





新高考化学一轮复习课件 第5章 第28讲 元素推断与无机物的性质
展开1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
元素推断与无机物的性质
1.了解元素推断常见题型,掌握各种题型的解题策略。2.能依据原子结构及其在元素周期表中的位置、元素周期律、物质结构或特性等 分析解决问题。
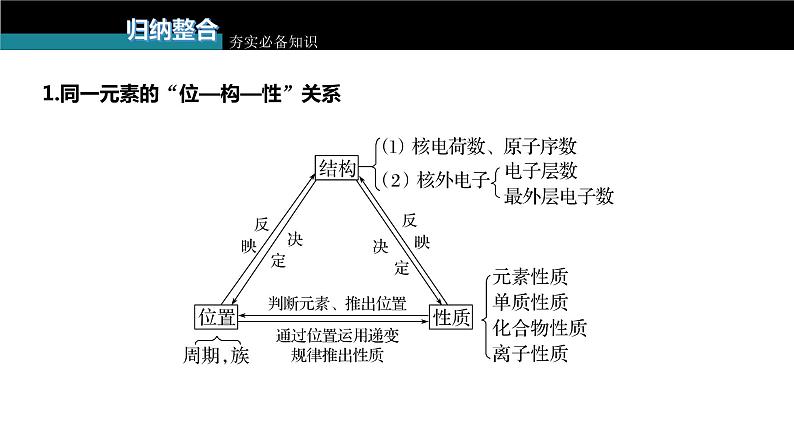
1.同一元素的“位—构—性”关系
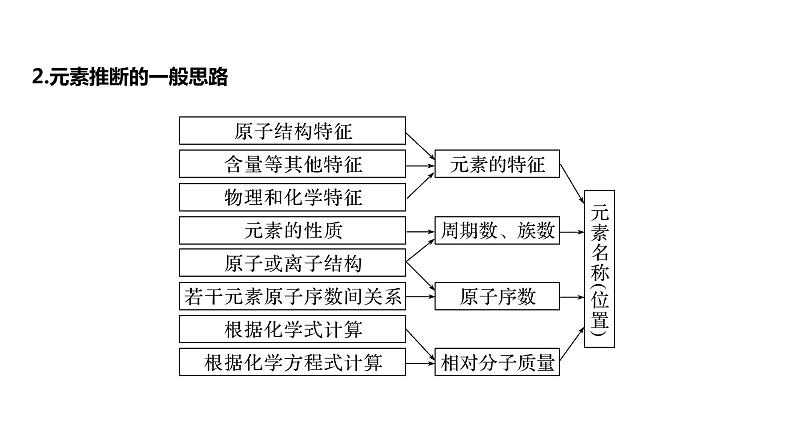
2.元素推断的一般思路
3.推断题要点总结(1)结构与位置互推是解题的核心①掌握四个关系式a.电子层数=周期数;b.质子数=原子序数;c.最外层电子数=主族序数;d.主族元素的最高正价=主族序数(O、F除外),负价=主族序数-8。②熟练掌握周期表的结构及周期表中的一些特殊规律a.“凹”型结构的“三短四长,七主七副八零完”;b.各周期元素种类;c.稀有气体元素的原子序数及在周期表中的位置;d.同主族上下相邻元素原子序数的关系。
(2)熟记常见元素及其化合物的特性①形成化合物种类最多的元素、单质是自然界中存在的硬度最大的物质的元素、气态氢化物中氢的质量分数最大的元素:C。②空气中含量最多的元素、气态氢化物水溶液呈碱性的元素:N。③地壳中含量最多的元素:O。④常见的具有漂白性的物质:氯水、SO2、Na2O2、双氧水等。⑤单质是最活泼的非金属元素、无正价的元素或无含氧酸的非金属元素、气态氢化物的水溶液可腐蚀玻璃的元素、气态氢化物最稳定的元素、阴离子还原性最弱的元素:F。
⑥单质密度最小的元素:H;密度最小的金属元素:Li。⑦常温下单质呈液态的非金属元素:Br;金属元素:Hg。⑧最高价氧化物及其水化物既能与强酸又能与强碱反应的元素:Al。⑨元素的气态氢化物和它的最高价氧化物对应的水化物能化合的元素:N;能发生氧化还原反应的元素:S。⑩元素的单质在常温下能与水反应放出气体的短周期元素:Li、Na、F。
例1 W、X、Y、Z是原子序数依次增大的短周期元素,X、Y、Z原子的最外层电子数之和为15,X、Y、Z三种元素在周期表中的相对位置如图所示。W与X以原子个数比为2∶1形成的化合物常用作火箭燃料。下列说法正确的是
题型一 元素周期表片断结构型推断
A.简单离子半径:Y>X>WB.热稳定性:W2Y>XW3C.Z的最高价氧化物是酸性氧化物,不能与任何酸反应D.ZY2的化学键类型与MgCl2相同
变式 短周期元素m、n、p、q在元素周期表中的相对位置如图所示,其中m的气态氢化物与其最高价氧化物对应的水化物能反应。下列说法正确的是
A.非金属性:m>nB.氢化物的稳定性:n
元素周期表片断结构型推断题一般给出两种信息:一是给出局部的元素周期表,展示出几种不同元素的相对位置。二是给出某种元素的位置特征、原子结构特征或由该元素形成的单质或化合物的特殊性质。解答此类题目时,要先根据给出的某种元素的特殊结构或性质,确定该元素在周期表中的位置,然后以此为“坐标原点”,根据其他元素与该元素的位置关系,进而确定其他未知的元素。
例2 (2022·广东珠海模拟)W、X、Y、Z、R是五种原子序数依次增大的短周期主族元素,其中,W和Y同主族,X和Z同主族,X离子和Y离子电子层结构相同。W和X形成的最简单气态化合物在水中呈碱性,Y和R形成化合物YR。下列说法正确的是A.原子半径:r(Z)>r(Y)>r(X)>r(W)B.X、Z、R三种元素简单气态氢化物稳定性最差的是ZC.R元素最高价氧化物对应水化物的化学式为H2RO4D.Y的单质在空气中燃烧生成的物质化学式为Y2O
题型二 文字叙述型推断
变式 (2019·全国卷Ⅲ,9)X、Y、Z均为短周期主族元素,它们原子的最外层电子数之和为10。X与Z同族,Y最外层电子数等于X次外层电子数,且Y原子半径大于Z。下列叙述正确的是A.熔点:X的氧化物比Y的氧化物高B.热稳定性:X的氢化物大于Z的氢化物C.X与Z可形成离子化合物ZXD.Y的单质与Z的单质均能溶于浓硝酸
例3 X、Y、Z、W是同周期原子序数依次增大的主族元素,且原子序数总和为28,四种元素与锂组成的盐是一种新型锂离子电池的电解质,结构如图,下列说法错误的是A.该化合物中,X、Y、Z、W之间均为共价键B.在该物质中X原子满足8电子稳定结构C.W的氢化物易溶于水,且水溶液是强酸D.Z与Y形成的化合物不一定与碱反应
变式 科学家利用四种原子序数依次递增的短周期元素W、X、Y、Z“组合”成一种超分子,该超分子具有高效的催化性能,其分子结构如图所示。W、X、Z分别位于不同周期,Z的原子半径在同周期元素中最大。(注:实线代表共价键,其他重复单元的W、X未标注)下列说法不正确的是A.Y单质的氧化性在同主族中最强B.离子半径:Z>YC.Z与Y可组成两种离子化合物D.简单氢化物的热稳定性:Y>X
注意陌生物质中各原子的成键情况和化合价等信息。①化学键信息:如能形成4个共价键的元素为C、Si,能形成2个共价键的元素为O、S,能形成1个共价键的元素为H。②根据形成的简单阴、阳离子可确定原子的最外层电子数,如X2+和Y2-,即X、Y原子最外层电子数分别为2和6。③化合价信息:化合物中各元素化合价代数和为0,结合某些常见元素的化合价或化学键等,可确定未知元素的化合价,间接确定最外层电子数目。
1.(2021·全国甲卷,11)W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是A.原子半径:Z>Y>X>WB.W与X只能形成一种化合物C.Y的氧化物为碱性氧化物,不与强碱反应D.W、X和Z可形成既含有离子键又含有共价键的化合物
2.(2021·全国乙卷,11)我国嫦娥五号探测器带回1.731 kg的月球土壤,经分析发现其构成与地球土壤类似,土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是A.原子半径大小顺序为W>X>Y>ZB.化合物XW中的化学键为离子键C.Y单质的导电性能弱于Z单质的D.Z的氧化物的水化物的酸性强于碳酸
3.(2021·广东,13)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法不正确的是A.XEZ4是一种强酸B.非金属性:W>Z>YC.原子半径:Y>W>ED.ZW2中,Z的化合价为+2价
4.(2021·湖南,7)W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2∶1的18e-分子。下列说法正确的是A.简单离子半径:Z>X>YB.W与Y能形成含有非极性键的化合物C.X和Y的最简单氢化物的沸点:X>YD.由W、X、Y三种元素所组成化合物的水溶液均显酸性
5.(2021·浙江6月选考,15)已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如下所示,其中Y的最高化合价为+3。下列说法不正确的是A.还原性:ZQ2
7.(2016·全国卷Ⅰ,13)短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物,n是元素Z的单质,通常为黄绿色气体,q的水溶液具有漂白性,0.01 ml·L-1 r溶液的pH为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是A.原子半径的大小:W
1.(2022·辽宁模拟)短周期主族元素X、Y、Z、W的原子序数依次增大,X的气态氢化物极易溶于Y的氢化物中。常温下Z单质能溶于W的最高价氧化物对应水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是A.元素Y的最高化合价为+6价B.最简单氢化物的沸点:Y>WC.原子半径的大小顺序:W>Z>X>YD.X、Z、W分别与Y均能形成多种二元化合物
2.短周期元素W、X、Y、Z位于不相邻主族,它们的原子序数及最外层电子数均依次增大且其中只有一种金属元素,W处在第一周期。下列说法错误的是A.X为金属元素B.原子半径:X>Y>Z>WC.Y与Z可形成2种化合物D.Y的最高价氧化物对应的水化物是强酸
3.A、B、C、D、E五种短周期主族元素,原子序数依次增大。A是元素周期表中原子半径最小的元素;C元素最高价氧化物对应的水化物是一种强碱;B、D、E的最外层电子数之和为19,且B的一种单质可用于饮用水消毒。下列说法错误的是A.B、C、D的简单离子半径:D>B>CB.B与A、C、D、E四种元素均可形成两种或两种以上化合物C.由B、C、E三种元素形成的化合物溶于水均能促进水的电离D.分子D2E2中原子均满足8电子稳定结构,则分子中存在非极性键
4.(2022·江苏模拟)元素周期表的一部分如图所示,W、X、Y、Z均为短周期主族元素,X与Z的最高正价之和与W的相等。下列说法错误的是A.原子半径:X>Y>Z>WB.X2W2中含有离子键和共价键C.Y的最高价氧化物对应的水化物难溶于水D.将由X、Z的单质组成的混合物放入冷水中,Z的单质不发生反应
5.短周期主族元素W、X、Y、Z的原子序数依次增大,它们的原子最外层电子数总和等于Z的原子序数,由这四种元素组成的一种化合物M具有如下性质,下列推断正确的是A.原子半径:Z>Y>X>W B.最高价氧化物对应水化物的酸性: Y>X C.简单阴离子的还原性:Z>W D.W、Y、Z组成的化合物只含共价键
6.X、Y、Z、R、W是原子序数依次递增的五种短周期主族元素,它们所在周期数之和为11,其中Y元素最高与最低化合价的代数和为2,Y和Z的单质生成的化合物是一种传递神经信息的“信使分子”,R的原子半径是五种元素中最大的,Y和W是同族元素。下列说法错误的是A.简单离子的还原性:Y>ZB.R的单质可能是金属或非金属C.由X、Z和W构成的酸一定是三元酸D.标准状况下,1 ml YZ与0.5 ml Z2混合后所得气体的体积一定小于22.4 L
7.X、Y、Z、W为原子序数依次增大的四种短周期主族元素,A、B、C、D、E为上述四种元素中的两种或三种所组成的化合物。已知A的相对分子质量为28,B分子中含有18电子,五种化合物间的转化关系如图所示。下列说法错误的是A.X、Y组成化合物的沸点一定比X、Z组成化合物的沸点低B.Y的最高价氧化物的水化物为弱酸C.Y、Z组成的分子可能为非极性分子D.W是所在周期中原子半径最小的元素
8.(2019·全国卷Ⅰ,13)科学家合成出了一种新化合物(如图所示),其中W、X、Y、Z为同一短周期元素,Z核外最外层电子数是X核外电子数的一半。下列叙述正确的是A.WZ的水溶液呈碱性B.元素非金属性的顺序为X>Y>ZC.Y的最高价氧化物的水化物是中强酸D.该新化合物中Y不满足8电子稳定结构
9.短周期元素T、X、Y、Z、W在元素周期表中的相对位置如图所示,其中T的单质在一定条件下能与W的最高价氧化物对应水化物的浓溶液反应并生成两种酸性气体,则下列相关说法正确的是A.离子半径:X
11.如表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是A.原子半径:W
13.(2020·浙江7月选考,16)X、Y、Z、M、Q五种短周期元素,原子序数依次增大。Y元素的最高正价为+4价,Y元素与Z、M元素相邻,且与M元素同主族;化合物Z2X4的电子总数为18个;Q元素的原子最外层电子数比次外层少一个电子。下列说法不正确的是A.原子半径:Z<Y<MB.最高价氧化物对应水化物的酸性:Z>Y>MC.X2Z—ZX2易溶于水,其水溶液呈碱性D.X、Z和Q三种元素形成的化合物一定是共价化合物
14.南京理工大学合成出的一种离子化合物的局部结构如图所示,该物质由两种阳离子和两种阴离子构成,其中有两种10电子离子和一种18电子离子。X、Y、Z、M均为短周期元素,且均不在同一族。下列说法不正确的是A.X与Y形成的化合物的沸点高于Y的同族元素与X形成 的化合物的沸点B.Z的最高价氧化物对应水化物的酸性比M的强C.Y的气态氢化物的稳定性比Z的强D.在该盐中,存在极性共价键和非极性共价键
15.短周期元素X、Y、Z的原子序数依次增大,其中Y元素的原子半径最大。已知A、B、C分别是X、Y、Z三种元素的单质,A和C常温下为气体。在适宜的条件下,A、B、C可以发生如图所示的反应。下列说法正确的是A.化合物YX中含离子键B.Z的含氧酸均为强酸C.非金属性:X>ZD.离子半径:Y>Z
第35讲 元素推断与元素性质-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT: 这是一份第35讲 元素推断与元素性质-2024年高考化学一轮复习高频考点精讲(新教材新高考)课件PPT,共46页。PPT课件主要包含了高考化学一轮复习策略等内容,欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第5章 第27讲 元素周期表、元素的性质: 这是一份2024年高考化学一轮复习课件(鲁科版)第5章 第27讲 元素周期表、元素的性质,文件包含第5章第27讲元素周期表元素的性质pptx、第5章第27练元素周期表元素的性质docx、第5章第27讲元素周期表元素的性质docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
2024年高考化学一轮复习课件(鲁科版)第5章 热点强化12 元素推断与元素性质: 这是一份2024年高考化学一轮复习课件(鲁科版)第5章 热点强化12 元素推断与元素性质,文件包含第5章热点强化12元素推断与元素性质pptx、第5章热点强化12元素推断与元素性质docx等2份课件配套教学资源,其中PPT共18页, 欢迎下载使用。












