






所属成套资源:2023年高考化学一轮复习课件(新高考)
新高考化学一轮复习课件 第8章 第46讲 弱电解质的电离平衡
展开
这是一份新高考化学一轮复习课件 第8章 第46讲 弱电解质的电离平衡,共60页。PPT课件主要包含了高考化学一轮复习策略,弱电解质的电离平衡,电离平衡常数及应用,真题演练明确考向,课时精练等内容,欢迎下载使用。
1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
1.理解弱电解质在水溶液中的电离平衡。2.理解电离平衡常数,掌握电离平衡常数的相关计算。3.理解电离平衡常数的相关应用。
弱电解质的电离平衡及影响因素
1.弱电解质的电离平衡概念(1)电离平衡的建立在一定条件下(如温度、压强等),当弱电解质分子电离产生离子的速率和离子结合成分子的速率相等时,电离过程达到了平衡。(2)电离平衡的建立与特征
①开始时,v(电离) ,而v(结合)为 。②平衡的建立过程中,v(电离) v(结合)。③当v(电离) v(结合)时,电离过程达到平衡状态。
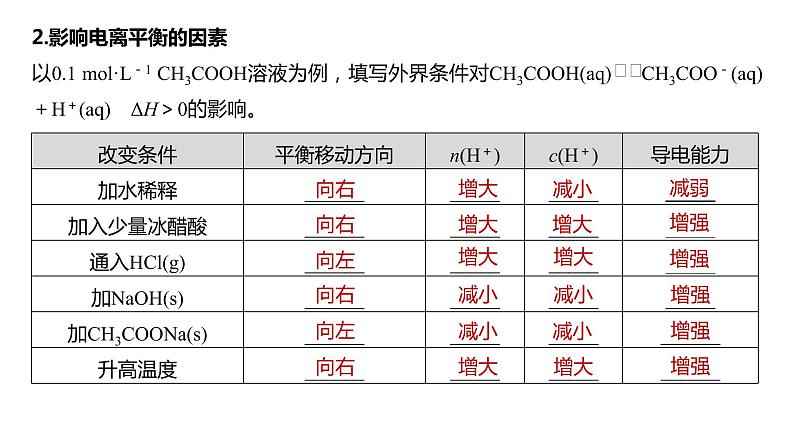
2.影响电离平衡的因素以0.1 ml·L-1 CH3COOH溶液为例,填写外界条件对CH3COOH(aq) CH3COO-(aq)+H+(aq) ΔH>0的影响。
1.弱电解质溶液中至少存在两种共价化合物分子( )2.氨气溶于水,当NH3·H2O电离出的c(OH-)= 时,表明NH3·H2O电离处于平衡 状态( )3.电离平衡右移,电解质分子的浓度一定减小,离子浓度一定增大( )4.25 ℃时,0.1 ml·L-1 CH3COOH加水稀释,各离子浓度均减小( )5.电离平衡向右移动,弱电解质的电离度一定增大( )6.电离平衡向右移动,电解质分子的浓度一定减小( )
1.分别画出冰醋酸加水稀释过程中溶液的电导率和pH随加水体积变化的曲线。
电离平衡移动结果的分析
2.常温下,①100 mL 0.01 ml·L-1的CH3COOH溶液,②10 mL 0.1 ml·L-1的CH3COOH溶液。用“>”“=”或“<”填写下列问题。(1)c(CH3COO-):①_____②。(2)电离程度:①____②。(3)在上述两种溶液中加入足量锌片。开始时的反应速率:①____②,反应结束生成相同状况下H2的体积:①____②。(4)与同浓度的NaOH溶液完全反应消耗NaOH溶液的体积:①_____②。
3.H2S水溶液中存在电离平衡:H2S H++HS-和HS- H++S2-。若向H2S溶液中A.加水,平衡向右移动,溶液中氢离子浓度增大B.通入过量SO2气体,平衡向左移动,溶液pH增大C.滴加新制氯水,平衡向左移动,溶液pH减小D.加入少量硫酸铜固体(忽略体积变化),溶液中所有离子浓度都减小
1.概念在一定条件下,弱电解质达到电离平衡时,溶液中电离所生成的各种离子浓度(幂次方)的乘积与溶液中未电离的分子浓度的比值是一个常数,这个常数叫做电离平衡常数,简称电离常数,用K(弱酸用Ka,弱碱用Kb)表示。2.表达式
3.特点(1)电离平衡常数与温度有关,与浓度无关,升高温度,K增大。(2)电离平衡常数反映弱电解质的相对强弱,K越大,表示弱电解质越易电离,酸性或碱性越强。(3)多元弱酸的各步电离常数的大小关系是K1≫K2≫K3……,故其酸性取决于第一步的电离。4.电离度(1)概念在一定条件下的弱电解质达到电离平衡时,已经电离的电解质分子数占原电解质分子总数的百分比。
(3)影响因素①相同温度下,同一弱电解质,浓度越大,其电离度(α)越 。②相同浓度下,同一弱电解质,温度越高,其电离度(α)越 。
1.弱电解质的电离平衡右移,电离常数一定增大( )2.电离常数大的酸溶液中的c(H+)一定比电离常数小的酸溶液中的c(H+)大( )3.某一弱电解质,电离度越大,电离常数就越大( )4.相同温度下,向1 ml·L-1的醋酸溶液中加入少量冰醋酸,其电离度变小( )5.稀醋酸中加入少量醋酸钠能增大醋酸的电离程度( )
1.部分弱酸的电离平衡常数如下表:
一、利用电离常数判断弱电解质的相对强弱
按要求回答下列问题:(1)HCOOH、H2S、H2CO3、HClO的酸性由强到弱的顺序为_______________________________。
HCOOH>H2CO3>H2S
二、判断微粒浓度比值的大小
3.常温下,将0.1 ml·L-1的CH3COOH溶液加水稀释,请填写下列表达式中的数据变化情况(填“变大”“变小”或“不变”)。
(1)将浓度之比转化为物质的量之比进行比较,这样分析起来可以忽略溶液体积的变化,只需分析微粒数目的变化即可。(2)“假设法”,如上述问题(3),假设无限稀释,c(CH3COO-)趋近于0,c(H+)趋于10-7ml·L-1,故比值变小。(3)“凑常数”,解题时将某些粒子的浓度比值乘以或除以某种粒子的浓度,转化为一个常数与某种粒子浓度的乘积或相除的关系。
判断溶液中微粒浓度比值的三种方法
三、根据电离度求电离常数
4.已知25 ℃时,某浓度为c的一元弱酸HA的电离度为α,求该温度下的HA的电离常数(Ka)。
1.(2020·北京,11)室温下,对于1 L 0.1 ml·L-1醋酸溶液。下列判断正确的是A.该溶液中CH3COO-的粒子数为6.02×1022B.加入少量CH3COONa固体后,溶液的pH降低C.滴加NaOH溶液过程中,n(CH3COO-)与n(CH3COOH)之和始终为0.1 mlD.与Na2CO3溶液反应的离子方程式为 +2H+===H2O+CO2↑
2.(2021·河北1月选考模拟,14)H3PO4的电离是分步进行的,常温下Ka1=7.6×10-3,Ka2=6.3×10-8,Ka3=4.4×10-13。下列说法正确的是A.浓度均为0.1 ml·L-1的NaOH溶液和H3PO4溶液按照体积比2∶1混合,混合液的 pHc(OH-)
1.一定温度下,将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示,下列说法正确的是
A.a、b、c三点溶液的pH:c
相关课件
这是一份2024年高考化学一轮复习课件(鲁科版)第8章 第46讲 弱电解质的电离平衡,文件包含第8章第46讲弱电解质的电离平衡pptx、第8章第46练弱电解质的电离平衡docx、第8章第46讲弱电解质的电离平衡docx等3份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份2024年高考化学一轮复习(新高考版) 第8章 第46讲 化学平衡状态与平衡常数,文件包含2024年高考化学一轮复习新高考版第8章第46讲化学平衡状态与平衡常数pptx、2024年高考化学一轮复习新高考版第8章第46讲化学平衡状态与平衡常数docx、第8章第46讲化学平衡状态与平衡常数docx、第8章第46练化学平衡状态与平衡常数docx等4份课件配套教学资源,其中PPT共60页, 欢迎下载使用。
这是一份新高考化学一轮复习课件 第8章 第46讲 热点强化15 电离常数的计算,共17页。PPT课件主要包含了高考化学一轮复习策略,电离常数的计算,热点强化15等内容,欢迎下载使用。









