





还剩52页未读,
继续阅读
所属成套资源:2023年高考化学一轮复习课件(新高考)
成套系列资料,整套一键下载
新高考化学一轮复习课件 第10章 第65讲 物质性质、化学反应综合实验探究
展开
这是一份新高考化学一轮复习课件 第10章 第65讲 物质性质、化学反应综合实验探究,共60页。PPT课件主要包含了高考化学一轮复习策略,第65讲,复习目标,归纳整合,专项突破,真题演练明确考向,课时精练等内容,欢迎下载使用。
1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
物质性质、化学反应综合实验探究
1.培养探究意识,掌握研究物质性质的一般程序和方法。2.建立解答性质探究综合实验题的思维模型。
物质性质探究实验综合题
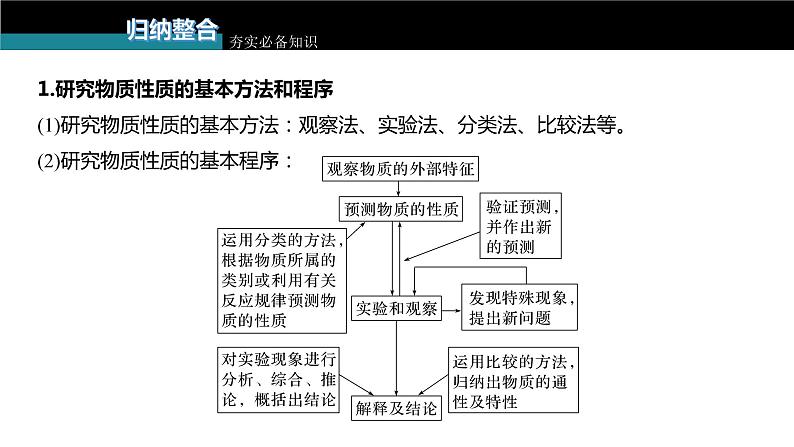
1.研究物质性质的基本方法和程序(1)研究物质性质的基本方法:观察法、实验法、分类法、比较法等。(2)研究物质性质的基本程序:
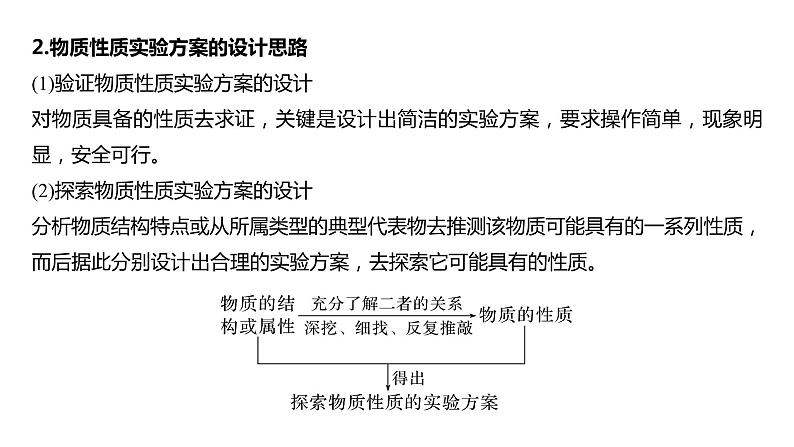
2.物质性质实验方案的设计思路(1)验证物质性质实验方案的设计对物质具备的性质去求证,关键是设计出简洁的实验方案,要求操作简单,现象明显,安全可行。(2)探索物质性质实验方案的设计分析物质结构特点或从所属类型的典型代表物去推测该物质可能具有的一系列性质,而后据此分别设计出合理的实验方案,去探索它可能具有的性质。
1.某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证Fe3+、Cl2、SO2氧化性的强弱。根据题目要求回答下列问题:(1)检查装置气密性后,关闭K1、K3、K4,打开K2,旋开旋塞a,加热A,则B中发生反应的离子方程式为__________________________。(2)B中溶液变黄时,停止加热A,关闭K2。打开旋塞b,使约2 mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是____________________________________________。
Cl2+2Fe2+===2Fe3+
向试管D中滴加KSCN溶液,试管D中溶液变红色
验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序:Cl2>Fe3+>SO2的是________(填“甲”“乙”或“丙”)。
(3)若要继续证明Fe3+和SO2氧化性的强弱,需要进行的操作是____________________________________________________________________________________________________________________________。(4)甲、乙、丙三位同学分别完成了上述实
(5)验证结束后,将D换成盛有NaOH溶液的烧杯,打开K1、K2、K3和K4,关闭旋塞a、c,打开旋塞b,从两端鼓入N2,这样做的目的是____________________________________________________。
除去A和C中分别产生的氯气和二氧化硫,防止污染大气
2.资料表明,氧化性:浓硝酸>稀硝酸。基于以下事实:Ⅰ.稀硝酸不能氧化NO,而浓硝酸能将NO氧化成NO2Ⅱ.稀硝酸与磷化物反应时,只能将磷元素氧化成单质磷,而浓硝酸与磷化物反应时,能将磷元素氧化成Ⅲ.稀硝酸只能将HI氧化成单质碘,而浓硝酸能把HI氧化成HIO3Ⅳ.……
回答下列问题:(1)某同学通过实验验证事实Ⅰ,所用实验装置(夹持装置略)如图(实验前用N2将装置中空气排尽):
已知:氢氧化钠溶液不与NO反应,能与NO2反应生成NaNO3和NaNO2。①B的作用是_______________,B中反应的离子方程式为__________________________________。
3NO2+H2O===2H++
②实验时,首先将a和b相连接,C中的试剂为________,C中观察到的现象是_______________________________。然后将a与c相连接,其目的是___________________________,E中观察到的现象是____________________________。
上方气体由无色变为红棕色
E装置液面上方气体仍为无色
(2)根据事实Ⅱ,写出稀硝酸与磷化亚铜(Cu3P)反应的化学方程式:_______________________________________________。
Cu3P+8HNO3(稀)
===3Cu(NO3)2+2NO↑+P+4H2O
(3)根据事实Ⅲ,将HI气体通入浓HNO3中至过量,一段时间后溶液由无色变为黄褐色,写出生成使溶液显黄褐色的物质的离子方程式:_____________________________________________________________________。
(4)请你举出一例事实将Ⅳ补充完整:_______________________________________________________________________。
常温下,浓硝酸与Cu反应速率快,而稀硝酸
与Cu反应速率慢(或其他合理答案)
探索化学反应实验综合题
1.某化学兴趣小组为探究高锰酸钾与铜的反应,设计实验如下:
资料:a.Cu+在酸性溶液中不能稳定存在:2Cu+===Cu+Cu2+;b.MnS为粉红色沉淀、溶于强酸;CuS为黑色沉淀、不溶于强酸。
(1)Cu被氧化成______,依据是_____________________________________________________________________________________________。
Cu被氧化可能生成Cu+或Cu2+,根据资料a,Cu+在
酸性溶液中不能稳定存在,所以其氧化产物为Cu2+
(2)为探究 的还原产物,取A区中溶液___________________________________________________________________(填操作和现象),证明有Mn2+生成。(3)A区中KMnO4与Cu反应的离子方程式是_____________________________________________。
通入足量H2S后,取上层清液,加入足量
的Na2S溶液,观察到粉红色沉淀
(4)经检验,B区的棕黑色固体是MnO2,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:________________________________________________________________________________________________________________________________________________。
(5)小组同学又进行了以下定量实验:
通过计算,分析溶液紫色变浅而未完全褪色的原因:____________________________________________________________________________________________________________________________________________________________________。
2.某小组为探究Mg与NH4Cl溶液的反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5 g,分别加入选取的实验试剂中,资料:①CH3COONH4溶液呈中性。②Cl-对该反应几乎无影响。
(1)经检验实验2中刺激性气味气体为NH3,检验方法是___________________________________________。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
将湿润的红色石蕊试纸放在
(2)已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有_____,灰白色固体可能是___________(填化学式)。
已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊,说明灰白色固体表面没有能使AgNO3溶液变浑浊的杂质,将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀,说明灰白色沉淀含有Cl-,结合已知灰白色沉淀中含有Mg2+、OH-和化合物中各元素化合价代数和为0,可推测灰白色固体可能是Mg(OH)Cl。
(3)甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是___________________________。
(4)乙同学通过实验3证明甲同学的说法不合理。
①试剂X是________________________________。
5 mL 1.0 ml·L-1 CH3COONH4溶液
②由实验3获取的证据为_________________________。
两试管反应剧烈程度相当
(5)为进一步探究实验2反应剧烈的原因,进行实验4。
依据上述实验,可以得出Mg能与 反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是___________________________________________。
取5 mL 无水乙醇,加入0.5 g Mg粉无明显变化
(6)由以上实验可以得出的结论是____________________________________________________。
1.(2021·北京,19)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。①反应的离子方程式是___________________________________________。②电极反应式:i.还原反应:MnO2+2e-+4H+===Mn2++2H2Oii.氧化反应:___________________。
2Cl--2e-===Cl2↑
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。ii.随c(Cl-)降低,_______________。④补充实验证实了③中的分析。
a是___________,b是_____________________________。
MnSO4固体(或其他合理答案)
(2)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________________________,从原子结构角度说明理由:___________________________________________________________________________________________________________。(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是__________________。
c(H+)KCl>c(H+)KBr>
Cl、Br、I为同主族元素,电子层数:I>Br>Cl,
离子半径:I->Br->Cl-,失电子能力:I->Br->Cl-,还原性:I->Br->Cl-
AgNO3(或Ag2SO4)
(4)Ag分别与1 ml·L-1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:________________________________________________________________________________________________________________________________________________。(5)总结:物质氧化性和还原性变化的一般规律是___________________________________________________________________________________________________________________________________。
溶解度:AgI 还原反应中,增大反应物浓度或降低生成物浓度,氧化剂的氧化性增强;氧化反应中,增大反应物浓度或降低生成物浓度,还原剂的还原性增强
2.[2020·全国卷Ⅰ,27(2)(3)(4)(5)(6)]为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择______作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 ml·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=_____________。
0.09 ml·L-1
假设两个烧杯中溶液体积均为V L,铁电极反应式为Fe-2e-===Fe2+,一段时间后,铁电极溶液中c(Fe2+)增加0.02 ml·L-1,则电路中通过电子为0.02 ml·L-1×V L×2=0.04V ml。石墨电极上未见Fe析出,则石墨电极反应式为Fe3++e-===Fe2+,据得失电子守恒可知,石墨电极生成Fe2+为0.04V ml,故石墨电极溶液中c(Fe2+)=
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_________________,铁电极的电极反应式为_______________。因此,验证了Fe2+氧化性小于______,还原性小于_____。
Fe3++e-===Fe2+
Fe-2e-===Fe2+
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是______________________________________________________________________________。
取活化后溶液少许于试管中,加入KSCN溶液,若溶液不出现红色,说明活化反应完成
1.某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸,能观察到发生明显反应的是________(填序号,下同),无明显反应现象的是________。
(2)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸,能观察到随即发生剧烈反应的是______,开始不反应,加热后发生反应的是______,加热也不发生反应的是______,能缓慢发生反应或微热时能发生反应的是______,反应的离子方程式为_________________________________________;先将铜与浓硫酸反应的气体X持续通入右图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括_____(填字母)。a.通入X气体后先产生白色沉淀后溶解b.通入X气体后溶液中无明显现象c.通入Y气体后有沉淀产生d.通入Y气体后沉淀溶解e.通入Y气体后溶液中无明显现象
(3)若将(2)的Ba(OH)2溶液换为硫化氢溶液,则通入X气体的现象为________________,反应的化学方程式为__________________________。
2H2S+SO2===3S↓+2H2O
2.兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。[提出问题]它们溶液的酸碱性及与酸反应时溶液的pH如何变化?[实验探究1]向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
[得出结论1]三种溶液的碱性由强到弱的顺序为________________________________________。
氢氧化钠溶液>碳酸钠溶液>碳酸氢
[实验探究2]甲同学在试管中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由____色变为____色,向其中加入稀盐酸,发生反应的化学方程式为____________________________。乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示,a点表示的意义是_________________________。[得出结论2]从微观角度分析,该反应的实质是________________________________。
无 红
HCl===NaCl+H2O
pH=7,二者恰好完全反应
氢离子和氢氧根离子结合生成水分子
[实验探究3]向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。
[交流与反思]b点的溶质为___________(写化学式,下同),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质为________________。[得出结论3]通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:_____________________________、_________________________________。[结论与反思]探究溶液的酸碱性及反应pH的变化,可以认识反应的原理及进行的过程。
NaCl、NaHCO3
Na2CO3+HCl===NaCl+NaHCO3 NaHCO3+HCl===NaCl+H2O+CO2↑
3.某研究小组为探究SO2和Fe(NO3)3溶液反应的实质,设计了如图所示装置进行实验。已知:1.0 ml·L-1的Fe(NO3)3溶液的pH=1。请回答下列问题:(1)装置A中用于滴加浓硫酸的仪器名称为__________,装置A中发生反应的化学方程式是___________________________________________。
Na2SO3+H2SO4(浓)===Na2SO4
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______________________________________________________。(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
打开弹簧夹,向装置中通入一段时间的N2,再关闭弹簧夹
(4)分析B中产生白色沉淀的原因。观点1:SO2与Fe3+反应;观点2:在酸性条件下SO2与 反应;观点3:___________________________________________;①若观点1正确,装置B中反应的离子方程式是______________________________________________,证明该观点应进一步确认生成的新物质,其实验操作及现象是______________________________________________________________________________________。
SO2既与Fe3+反应,在酸性条件下
SO2+2Fe3++Ba2++2H2O===BaSO4↓
取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液,产生蓝色沉淀,则溶液中有Fe2+
②按观点2,装置B中反应的离子方程式是________________________________________________。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2。此时应选择的最佳试剂是______(填字母)。A.3.0 ml·L-1NaNO3溶液和0.1 ml·L-1硫酸 等体积混合的溶液B.6.0 ml·L-1NaNO3溶液和0.2 ml·L-1盐酸等体积混合的溶液C.1.5 ml·L-1Fe(NO3)3溶液D.1.0 ml·L-1稀硝酸
4.某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验,已知固液反应速率与离子迁移速率有关。
(1)实验ⅰ中产生丁达尔效应的原因是____________________________。
Fe3+水解生成了Fe(OH)3胶体
(2)实验ⅱ中发生了多个反应,它们所属的基本反应类型是______________________。(3)根据物质性质,推测体系中可能发生的氧化还原反应的离子方程式: __________________________________________________________________________________________________________________(至少写三个)。
===Zn2++2Fe2+、Zn+2H+===Zn2++H2↑、Zn+Fe2+===Zn2++Fe、2Zn+4H++O2===2Zn2++2H2O(答案合理即可)
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化,甲同学认为产生该现象的原因可能是此实验条件下氧化性:H+>Fe3+。①乙同学根据已有知识____________________________________________(结合化学用语说明),判断氧化性:H+2Fe3++Cu===2Fe2++Cu2+,而铜不与盐酸反应
②乙同学认为产生实验ⅰ和ⅱ现象的原因是H+的迁移速率大于Fe3+的迁移速率,因此改用锌粉进行实验,证明氧化性:H+
1、全面、系统复习回顾基本知识。了解知识规律的来龙去脉,透彻理解概念的内涵外延,让学生经历教材由薄变厚的过程。要正确理解基础,不是会做几个简单题就叫基础扎实。对于一轮复习,基础就是像盖房子一样,需要着力做好两件大事:一是夯实地基,二是打好框架。2、扎实训练学科基本技能、理解感悟学科基本方法。一轮复习,要以教材为本,全面细致的回顾课本知识,让学生树立“教材是最好的复习资料”的观点,先引导学生对教材中所涉及的每个知识点进行重新梳理,对教材中的概念、定理、定律进一步强化理解。3、培养学生积极的学习态度、良好的复习习惯和运用科学思维方法、分析解决问题的能力。落实解题的三重境界:一是“解”,解决问题。二是“思”,总结解题经验和方法。三是“归”,回归到高考能力要求上去。解题上强化学生落实三个字:慢(审题),快(书写),全(要点全面,答题步骤规范)。 4、有计划、有步骤、有措施地指导学生补齐短板。高三复习要突出重点,切忌主次不分,无的放矢。要在“精讲”上下足功夫。抓住学情,讲难点、重点、易混点、薄弱点;讲思路、技巧、规范;讲到关键处,讲到点子上,讲到学生心里去。
物质性质、化学反应综合实验探究
1.培养探究意识,掌握研究物质性质的一般程序和方法。2.建立解答性质探究综合实验题的思维模型。
物质性质探究实验综合题
1.研究物质性质的基本方法和程序(1)研究物质性质的基本方法:观察法、实验法、分类法、比较法等。(2)研究物质性质的基本程序:
2.物质性质实验方案的设计思路(1)验证物质性质实验方案的设计对物质具备的性质去求证,关键是设计出简洁的实验方案,要求操作简单,现象明显,安全可行。(2)探索物质性质实验方案的设计分析物质结构特点或从所属类型的典型代表物去推测该物质可能具有的一系列性质,而后据此分别设计出合理的实验方案,去探索它可能具有的性质。
1.某小组用如图所示装置进行实验(夹持仪器和A中加热装置已略),以验证Fe3+、Cl2、SO2氧化性的强弱。根据题目要求回答下列问题:(1)检查装置气密性后,关闭K1、K3、K4,打开K2,旋开旋塞a,加热A,则B中发生反应的离子方程式为__________________________。(2)B中溶液变黄时,停止加热A,关闭K2。打开旋塞b,使约2 mL的溶液流入试管D中,关闭旋塞b,检验实验中B生成离子的方法是____________________________________________。
Cl2+2Fe2+===2Fe3+
向试管D中滴加KSCN溶液,试管D中溶液变红色
验,结论如表所示,他们的检测结果一定能够证明氧化性强弱顺序:Cl2>Fe3+>SO2的是________(填“甲”“乙”或“丙”)。
(3)若要继续证明Fe3+和SO2氧化性的强弱,需要进行的操作是____________________________________________________________________________________________________________________________。(4)甲、乙、丙三位同学分别完成了上述实
(5)验证结束后,将D换成盛有NaOH溶液的烧杯,打开K1、K2、K3和K4,关闭旋塞a、c,打开旋塞b,从两端鼓入N2,这样做的目的是____________________________________________________。
除去A和C中分别产生的氯气和二氧化硫,防止污染大气
2.资料表明,氧化性:浓硝酸>稀硝酸。基于以下事实:Ⅰ.稀硝酸不能氧化NO,而浓硝酸能将NO氧化成NO2Ⅱ.稀硝酸与磷化物反应时,只能将磷元素氧化成单质磷,而浓硝酸与磷化物反应时,能将磷元素氧化成Ⅲ.稀硝酸只能将HI氧化成单质碘,而浓硝酸能把HI氧化成HIO3Ⅳ.……
回答下列问题:(1)某同学通过实验验证事实Ⅰ,所用实验装置(夹持装置略)如图(实验前用N2将装置中空气排尽):
已知:氢氧化钠溶液不与NO反应,能与NO2反应生成NaNO3和NaNO2。①B的作用是_______________,B中反应的离子方程式为__________________________________。
3NO2+H2O===2H++
②实验时,首先将a和b相连接,C中的试剂为________,C中观察到的现象是_______________________________。然后将a与c相连接,其目的是___________________________,E中观察到的现象是____________________________。
上方气体由无色变为红棕色
E装置液面上方气体仍为无色
(2)根据事实Ⅱ,写出稀硝酸与磷化亚铜(Cu3P)反应的化学方程式:_______________________________________________。
Cu3P+8HNO3(稀)
===3Cu(NO3)2+2NO↑+P+4H2O
(3)根据事实Ⅲ,将HI气体通入浓HNO3中至过量,一段时间后溶液由无色变为黄褐色,写出生成使溶液显黄褐色的物质的离子方程式:_____________________________________________________________________。
(4)请你举出一例事实将Ⅳ补充完整:_______________________________________________________________________。
常温下,浓硝酸与Cu反应速率快,而稀硝酸
与Cu反应速率慢(或其他合理答案)
探索化学反应实验综合题
1.某化学兴趣小组为探究高锰酸钾与铜的反应,设计实验如下:
资料:a.Cu+在酸性溶液中不能稳定存在:2Cu+===Cu+Cu2+;b.MnS为粉红色沉淀、溶于强酸;CuS为黑色沉淀、不溶于强酸。
(1)Cu被氧化成______,依据是_____________________________________________________________________________________________。
Cu被氧化可能生成Cu+或Cu2+,根据资料a,Cu+在
酸性溶液中不能稳定存在,所以其氧化产物为Cu2+
(2)为探究 的还原产物,取A区中溶液___________________________________________________________________(填操作和现象),证明有Mn2+生成。(3)A区中KMnO4与Cu反应的离子方程式是_____________________________________________。
通入足量H2S后,取上层清液,加入足量
的Na2S溶液,观察到粉红色沉淀
(4)经检验,B区的棕黑色固体是MnO2,从溶液中离子扩散的角度,结合离子方程式解释B区和C区中的现象:________________________________________________________________________________________________________________________________________________。
(5)小组同学又进行了以下定量实验:
通过计算,分析溶液紫色变浅而未完全褪色的原因:____________________________________________________________________________________________________________________________________________________________________。
2.某小组为探究Mg与NH4Cl溶液的反应机理,常温下进行以下实验。实验中所取镁粉质量均为0.5 g,分别加入选取的实验试剂中,资料:①CH3COONH4溶液呈中性。②Cl-对该反应几乎无影响。
(1)经检验实验2中刺激性气味气体为NH3,检验方法是___________________________________________。用排水法收集一小试管产生的气体,经检验小试管中气体为H2。
将湿润的红色石蕊试纸放在
(2)已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊。将洗涤后的固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀。推测沉淀中含有_____,灰白色固体可能是___________(填化学式)。
已知灰白色沉淀中含有Mg2+、OH-。为研究固体成分,进行实验:将生成的灰白色固体洗涤数次,至洗涤液中滴加AgNO3溶液后无明显浑浊,说明灰白色固体表面没有能使AgNO3溶液变浑浊的杂质,将洗涤后固体溶于稀HNO3,再滴加AgNO3溶液,出现白色沉淀,说明灰白色沉淀含有Cl-,结合已知灰白色沉淀中含有Mg2+、OH-和化合物中各元素化合价代数和为0,可推测灰白色固体可能是Mg(OH)Cl。
(3)甲同学认为实验2比实验1反应剧烈的原因是NH4Cl溶液中c(H+)大,与Mg反应快。用化学用语解释NH4Cl溶液显酸性的原因是___________________________。
(4)乙同学通过实验3证明甲同学的说法不合理。
①试剂X是________________________________。
5 mL 1.0 ml·L-1 CH3COONH4溶液
②由实验3获取的证据为_________________________。
两试管反应剧烈程度相当
(5)为进一步探究实验2反应剧烈的原因,进行实验4。
依据上述实验,可以得出Mg能与 反应生成H2。乙同学认为该方案不严谨,需要补充的实验方案是___________________________________________。
取5 mL 无水乙醇,加入0.5 g Mg粉无明显变化
(6)由以上实验可以得出的结论是____________________________________________________。
1.(2021·北京,19)某小组探究卤素参与的氧化还原反应,从电极反应角度分析物质氧化性和还原性的变化规律。(1)浓盐酸与MnO2混合加热生成氯气。氯气不再逸出时,固液混合物A中仍存在盐酸和MnO2。①反应的离子方程式是___________________________________________。②电极反应式:i.还原反应:MnO2+2e-+4H+===Mn2++2H2Oii.氧化反应:___________________。
2Cl--2e-===Cl2↑
③根据电极反应式,分析A中仍存在盐酸和MnO2的原因。i.随c(H+)降低或c(Mn2+)浓度升高,MnO2氧化性减弱。ii.随c(Cl-)降低,_______________。④补充实验证实了③中的分析。
a是___________,b是_____________________________。
MnSO4固体(或其他合理答案)
(2)利用c(H+)对MnO2氧化性的影响,探究卤素离子的还原性。相同浓度的KCl、KBr和KI溶液,能与MnO2反应所需的最低c(H+)由大到小的顺序是___________________________,从原子结构角度说明理由:___________________________________________________________________________________________________________。(3)根据(1)中结论推测:酸性条件下,加入某种化合物可以提高溴的氧化性,将Mn2+氧化为MnO2。经实验证实了推测,该化合物是__________________。
c(H+)KCl>c(H+)KBr>
Cl、Br、I为同主族元素,电子层数:I>Br>Cl,
离子半径:I->Br->Cl-,失电子能力:I->Br->Cl-,还原性:I->Br->Cl-
AgNO3(或Ag2SO4)
(4)Ag分别与1 ml·L-1的盐酸、氢溴酸和氢碘酸混合,Ag只与氢碘酸发生置换反应,试解释原因:________________________________________________________________________________________________________________________________________________。(5)总结:物质氧化性和还原性变化的一般规律是___________________________________________________________________________________________________________________________________。
溶解度:AgI
2.[2020·全国卷Ⅰ,27(2)(3)(4)(5)(6)]为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择______作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入________电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 ml·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=_____________。
0.09 ml·L-1
假设两个烧杯中溶液体积均为V L,铁电极反应式为Fe-2e-===Fe2+,一段时间后,铁电极溶液中c(Fe2+)增加0.02 ml·L-1,则电路中通过电子为0.02 ml·L-1×V L×2=0.04V ml。石墨电极上未见Fe析出,则石墨电极反应式为Fe3++e-===Fe2+,据得失电子守恒可知,石墨电极生成Fe2+为0.04V ml,故石墨电极溶液中c(Fe2+)=
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为_________________,铁电极的电极反应式为_______________。因此,验证了Fe2+氧化性小于______,还原性小于_____。
Fe3++e-===Fe2+
Fe-2e-===Fe2+
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是______________________________________________________________________________。
取活化后溶液少许于试管中,加入KSCN溶液,若溶液不出现红色,说明活化反应完成
1.某同学欲探究浓硫酸、稀硫酸、浓硝酸、稀硝酸分别与铁、铜反应的实验中的有关问题。(1)在常温下,分别向盛有等量铁片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸,能观察到发生明显反应的是________(填序号,下同),无明显反应现象的是________。
(2)分别向盛有等量铜片的四支试管中加入等体积的①浓硫酸、②稀硫酸、③浓硝酸、④稀硝酸,能观察到随即发生剧烈反应的是______,开始不反应,加热后发生反应的是______,加热也不发生反应的是______,能缓慢发生反应或微热时能发生反应的是______,反应的离子方程式为_________________________________________;先将铜与浓硫酸反应的气体X持续通入右图装置中,一段时间后再将铜与浓硝酸反应产生的大量气体Y也持续通入该装置中,可观察到的现象包括_____(填字母)。a.通入X气体后先产生白色沉淀后溶解b.通入X气体后溶液中无明显现象c.通入Y气体后有沉淀产生d.通入Y气体后沉淀溶解e.通入Y气体后溶液中无明显现象
(3)若将(2)的Ba(OH)2溶液换为硫化氢溶液,则通入X气体的现象为________________,反应的化学方程式为__________________________。
2H2S+SO2===3S↓+2H2O
2.兴趣小组的同学对碳酸氢钠、碳酸钠、氢氧化钠的某些性质进行相关探究。[提出问题]它们溶液的酸碱性及与酸反应时溶液的pH如何变化?[实验探究1]向等体积、等浓度的碳酸氢钠、碳酸钠、氢氧化钠溶液中,分别加入几滴紫甘蓝汁液,同时用蒸馏水进行对比实验,观察并记录现象如下:
[得出结论1]三种溶液的碱性由强到弱的顺序为________________________________________。
氢氧化钠溶液>碳酸钠溶液>碳酸氢
[实验探究2]甲同学在试管中加入约5 mL稀氢氧化钠溶液,滴入几滴酚酞溶液,此时溶液由____色变为____色,向其中加入稀盐酸,发生反应的化学方程式为____________________________。乙同学向一定体积、一定浓度的氢氧化钠溶液中,逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图1所示,a点表示的意义是_________________________。[得出结论2]从微观角度分析,该反应的实质是________________________________。
无 红
HCl===NaCl+H2O
pH=7,二者恰好完全反应
氢离子和氢氧根离子结合生成水分子
[实验探究3]向等体积、含等碳原子数的碳酸氢钠和碳酸钠溶液中,分别逐滴加入一定浓度的盐酸,得到pH变化与时间的关系如图2、图3所示。
[交流与反思]b点的溶质为___________(写化学式,下同),将图2和图3的阴影部分进行叠加,发现两者基本重合,c点的溶质为________________。[得出结论3]通过上述分析,碳酸钠和盐酸反应过程,可以依次用以下两个化学方程式表示:_____________________________、_________________________________。[结论与反思]探究溶液的酸碱性及反应pH的变化,可以认识反应的原理及进行的过程。
NaCl、NaHCO3
Na2CO3+HCl===NaCl+NaHCO3 NaHCO3+HCl===NaCl+H2O+CO2↑
3.某研究小组为探究SO2和Fe(NO3)3溶液反应的实质,设计了如图所示装置进行实验。已知:1.0 ml·L-1的Fe(NO3)3溶液的pH=1。请回答下列问题:(1)装置A中用于滴加浓硫酸的仪器名称为__________,装置A中发生反应的化学方程式是___________________________________________。
Na2SO3+H2SO4(浓)===Na2SO4
(2)为排除空气对实验的干扰,滴加浓硫酸之前应进行的操作是______________________________________________________。(3)装置B中产生了白色沉淀,其成分是________,说明SO2具有________性。
打开弹簧夹,向装置中通入一段时间的N2,再关闭弹簧夹
(4)分析B中产生白色沉淀的原因。观点1:SO2与Fe3+反应;观点2:在酸性条件下SO2与 反应;观点3:___________________________________________;①若观点1正确,装置B中反应的离子方程式是______________________________________________,证明该观点应进一步确认生成的新物质,其实验操作及现象是______________________________________________________________________________________。
SO2既与Fe3+反应,在酸性条件下
SO2+2Fe3++Ba2++2H2O===BaSO4↓
取少量B中溶液于试管中,加入少量铁氰化钾[K3Fe(CN)6]溶液,产生蓝色沉淀,则溶液中有Fe2+
②按观点2,装置B中反应的离子方程式是________________________________________________。
③有人认为,如将装置B中的Fe(NO3)3溶液替换为等体积的下列溶液,在相同条件下进行实验,也可验证观点2。此时应选择的最佳试剂是______(填字母)。A.3.0 ml·L-1NaNO3溶液和0.1 ml·L-1硫酸 等体积混合的溶液B.6.0 ml·L-1NaNO3溶液和0.2 ml·L-1盐酸等体积混合的溶液C.1.5 ml·L-1Fe(NO3)3溶液D.1.0 ml·L-1稀硝酸
4.某小组同学为探究Zn与FeCl3溶液的反应,设计并完成了如下实验,已知固液反应速率与离子迁移速率有关。
(1)实验ⅰ中产生丁达尔效应的原因是____________________________。
Fe3+水解生成了Fe(OH)3胶体
(2)实验ⅱ中发生了多个反应,它们所属的基本反应类型是______________________。(3)根据物质性质,推测体系中可能发生的氧化还原反应的离子方程式: __________________________________________________________________________________________________________________(至少写三个)。
===Zn2++2Fe2+、Zn+2H+===Zn2++H2↑、Zn+Fe2+===Zn2++Fe、2Zn+4H++O2===2Zn2++2H2O(答案合理即可)
(4)实验ⅰ和ⅱ均先有气体生成,后有溶液颜色的变化,甲同学认为产生该现象的原因可能是此实验条件下氧化性:H+>Fe3+。①乙同学根据已有知识____________________________________________(结合化学用语说明),判断氧化性:H+
②乙同学认为产生实验ⅰ和ⅱ现象的原因是H+的迁移速率大于Fe3+的迁移速率,因此改用锌粉进行实验,证明氧化性:H+












