








沪教版九年级上册第1节 常见的化学反应——燃烧获奖课件ppt
展开第4章 认识化学变化
第1节 常见的化学反应——燃烧
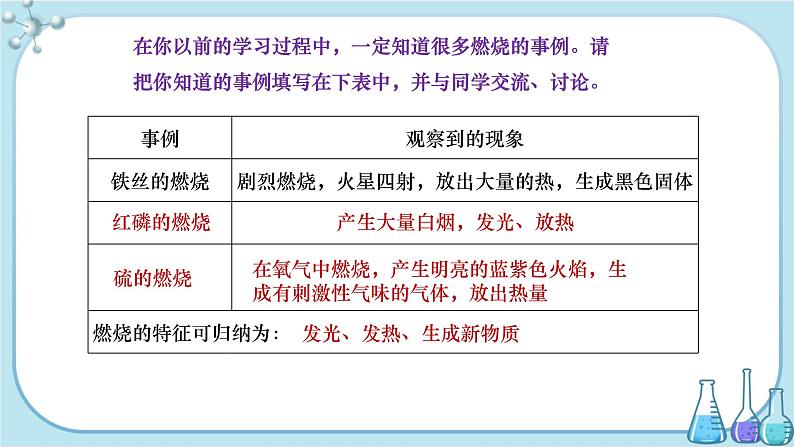
设计说明 本节教材主要介绍了燃烧及燃烧条件、完全燃烧与不完全燃烧、燃烧引起的爆炸现象以及防火与灭火四个部分。燃烧是生活中常见的一种化学变化,在前面学习中接触了一些燃烧的实例,也知道了二氧化碳能用于灭火。本节内容的学习不仅有利于回顾已学知识,还有利于以后对金属锈蚀及防护的学习,在初中化学的学习中起到了承前启后的作用。 本节从两幅有关燃烧的图片引入,说明燃烧能造福于人类,燃烧也会给人类带来灾难,进一步说明事物的两面性。我们了解了部分物质的燃烧情况,对燃烧的条件已有一定的感性认识。学生的脑海里已经对燃烧的定义有了模糊的印象,很多生活经验也使学生了解了燃烧是有条件的,但是他们还没有形成系统和规范的概念。通过学生实验探究和教师的演示实验,再加上教师的引导,比较容易掌握燃烧的条件。[来源:Zxxk.Com][ 在燃烧引起的爆炸现象的学习中,让学生了解爆炸和燃烧还是有区别的;关于易燃物和易爆物的安全知识,也是通过一个有趣的实验,来说明为什么会发生爆炸,并通过一些注意安全的图标来加强对安全的认识,说明随时注意防火、防爆,采取安全措施的重要性。通过学习让学生在日常生活中建立起防火、防爆的安全意识。在前面认识的基础上理解灭火的方法,燃烧需要三个条件,破坏燃烧的三个条件中的一个就能达到灭火的目的。 教学目标 【知识与技能】 1.认识燃烧的条件,能用控制变量法对燃烧条件进行探究。 2.认识燃料完全燃烧的重要性。 3.了解灭火的原理和防范爆炸的措施。 4.掌握从火灾中逃生的方法。 【过程与方法】 1.通过对燃烧条件、灭火原理等的探究活动,进一步认识与体验科学探究的过程。 2.通过活动和探究,体会对获得的事实运用比较归纳等方法进行分析得出结论的科学方法。 【情感、态度与价值观】 1.燃烧可造福人类,又会给人类带来灾害,学会用辨证的观点看问题。 2.通过认识燃烧条件和灭火原理,掌握一切事物均有规律可寻,认识规律、掌握规律可以使事物按照一定的方向进展,从而达到趋利避害的目的。 重点难点 教学重点 1.燃烧需要的条件。 2.燃料完全燃烧的条件和重要性。 教学难点 1.燃烧需要的条件。 2.燃料完全燃烧的条件和重要性。 教学方法 1.学会用辩证的方法看待事物,认识事物的两面性。 2.学会用控制变量法探究燃烧的条件。 教具、学具 坩埚钳、酒精、酒精灯、火柴、玻璃片、石棉网、蜡烛、棉花、木条、煤块、剪刀、塑料瓶、硬纸板、乳胶管、水、湿抹布、沙土、镊子、面粉、多媒体课件等。 授课时数 2课时 第1课时 教学过程 导入新课 在人类发展的历史长河中,燃烧燃尽了茹毛饮血的历史,燃烧点燃了现代社会的辉煌。生活中处处离不开燃烧。请同学们谈谈生活中哪些地方有燃烧的现象。你能否从燃烧的事例和现象中找出燃烧共同的特征是什么,并试着给燃烧下一个定义呢? 讲授新课 【教师点拨】 说到火,我们就会想到燃烧,火是物质燃烧时的一种现象。燃烧能造福于人类,也可能给人类带来灾难。 【教师提问】 在你以前的学习过程中,一定知道很多燃烧的事例。请把你知道的事例填写在下表中,并与同学交流、讨论。
【学生回答】
【教师讲述】 一、燃烧 1.燃烧的定义 燃烧是一种发光、发热的剧烈的化学反应。 2.对燃烧的理解 (1)通常所说的燃烧是可燃物与氧气发生的发光、发热的剧烈的氧化反应。其实燃烧不一定要有氧气参加,如H2能在Cl2中燃烧,镁条(Mg)能在CO2中燃烧等。 (2)物质在燃烧过程中一定有发光、发热现象产生,但有发光、发热现 象产生的变化不一定是燃烧,如电灯通电后发光、发热。 (3)并不是所有物质燃烧都会有火焰产生,气体或蒸气燃烧时才会有火焰,如CO、H2在空气(或O2)中燃烧会产生火焰。有些可燃物受热后会气化为蒸气(如酒精、汽油、硫等),它们燃烧时也会产生火焰。熔、沸点很高的固体,如木炭、铁丝等燃烧时就没有火焰。 【教师点拨】 加热、点燃和燃烧的区别 (1)“加热”是指利用热源放出的热量使某个体系达到一定的温度范围,一般用酒精灯作为热源,且热源一般不与被加热物质直接接触。 (2)“点燃”是指物质能发生燃烧所必需的温度条件,点燃时热源与可燃物直接接触。 (3)“燃烧”是一种发光、发热的剧烈的化学反应,描述的是一种现象。 【教师讲述】 3.燃烧与人类生产、生活的关系 人们利用可燃物燃烧时发出的光和热来照明、取暖、烧煮食物、冶炼钢铁等,燃烧能够造福于人类,但一旦失控,也会给人类带来灾难。因此,我们要正确认识燃烧,科学地利用和控制燃烧,使燃烧更好地为人类服务。 【教师提问】 在日常生活中,燃烧现象屡见不鲜。你知道燃烧发生的条件吗? 【学生回答】 燃烧需要同时满足三个条件:(1)物质具有可燃性;(2)与氧气接触;(3)达到燃烧所需要的最低温度。 【教师提问】 所有的物质都能燃烧吗? 【学生回答】 不是所有的物质都能燃烧。如纸张可以燃烧,而水却不能燃烧。 【教师提问】 具有可燃性的物质在什么条件下能燃烧?用玻璃杯罩住燃着的小蜡烛,小蜡烛能长时间持续燃烧吗? 【学生回答】 具有可燃性的物质在空气或氧气中,温度达到燃烧所需的最低温度时就会燃烧。 用玻璃杯罩住燃着的小蜡烛,一段时间后,小蜡烛会因氧气不足而熄灭。 【教师提问】 火柴、蜡烛、木条和煤,哪个比较容易被点燃?点燃它们的方式有什么差异?“点燃”在引发燃烧中起了什么作用? 【学生回答】 火柴最容易被点燃;火柴摩擦就能被点燃,蜡烛需要明火才能燃烧,木条需要持续加热,而煤则需要更高的温度;“点燃”在引发燃烧中的作用是使可燃物达到燃烧所需要的最低温度。 【教师提问】 为什么在高温干燥的季节里,在没有明火的情况下,森林里也可能发生火灾? 【学生回答】 在高温干燥的季节,暴露在空气中的枯枝落叶达到了燃烧所需要的最低温度。 【多媒体展示】 教师展示“火三角”图片,强调燃烧必须同时满足三个条件,缺一不可。
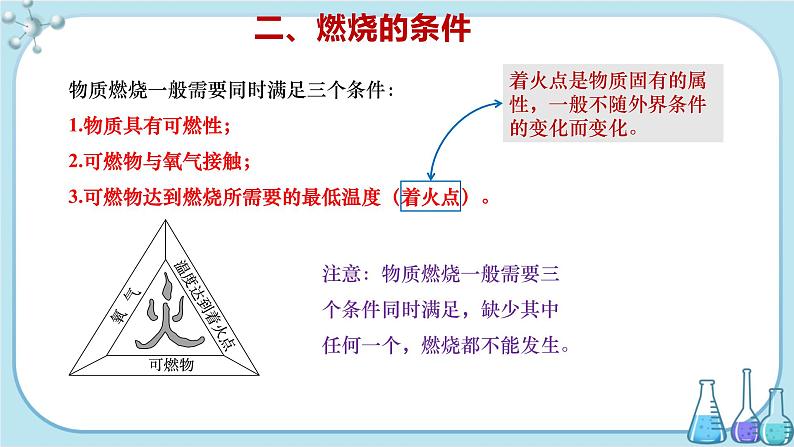
【教师讲述】 二、燃烧的条件 物质燃烧一般需要同时满足三个条件:(1)物质具有可燃性;(2)可燃物与氧气接触;(3)可燃物达到燃烧所需要的最低温度(着火点)。 注意:物质燃烧一般需要三个条件同时满足,缺少其中任何一个,燃烧都不能发生。 【教师点拨】 着火点是物质固有的属性,一般不随外界条件的变化而变化。 【多媒体展示】 【实验演示】 将20 mL 95%的酒精和10 mL水混合。将一块棉布手绢浸入配好的混合液中,浸透后取出,轻轻拧干,用坩埚钳夹持,在酒精灯上点燃,并轻轻抖动手绢。 实验现象:火焰熄灭后,手绢没有变化。 实验解释:因为酒精燃烧释放的热量被手绢上的水吸收,水变成水蒸气带走大量热使手绢的温度达不到着火点,故手绢没有变化。
【教师点拨】 构成物质的微粒是不断运动的,微粒的运动速率与温度有关。温度越高,微粒运动速率越快。例如湿衣服在夏天比在冬天干得快。 【教师拓展】 控制变量法探究燃烧条件 当有多种因素的变化都可能影响实验结果时,应明确哪种因素真正起了作用,这就必须控制其他因素不变而只改变这种因素,从而考查该因素对实验结果所起的作用,这种方法在科学探究中称为控制变量法。若要探究燃烧需要与氧气接触,则需要使用相同的可燃物白磷并控制温度相同,采用与氧气接触和不与氧气接触两种形式;若要探究燃烧需要达到可燃物的着火点,则需要控制温度相同并都与氧气接触,采用着火点不同的红磷和白磷。 【教师讲述】 三、完全燃烧与不完全燃烧 1.完全燃烧与不完全燃烧 (1)完全燃烧:当氧气充足时,可燃物完全燃烧,燃烧得快,放出的热量多。当含碳、氢元素的可燃物完全燃烧时,可燃物中的碳、氢元素分别生成二氧化碳和水。 如:碳 + 氧气(充足)二氧化碳 C O2 CO2 (2)不完全燃烧:当氧气不充足时,可燃物不完全燃烧,燃烧得慢,放出的热量少。当含碳、氢元素的可燃物不完全燃烧时,可燃物中的部分碳、氢元素主要生成一氧化碳、碳氢化合物等有毒气体和微小的炭黑颗粒等物质。 如:碳 + 氧气(不充足)一氧化碳 C O2 CO 2.物质完全燃烧的条件 (1)增大氧气的浓度; (2)增大可燃物跟氧气的接触面积。 3.燃料完全燃烧的意义 (1)使有限的能源发挥最大的作用。通过计算煤、石油、天然气的使用年限,知道节约能源的必要性。 (2)降低环境污染的程度。现在使用的燃料中含有碳元素,这些燃料燃烧不充分时会产生大量的一氧化碳气体。一氧化碳气体有毒,会污染环境,危害人体健康。当固体燃料不充分燃烧时,还会增加烟尘的排放而加重环境污染。 【教师提问】 在日常生活中,你也许见过这样的情景:液化气灶、煤炉等燃具都留有空气进口,且空气进口大小可以调节;学校、工厂等单位使用的锅炉要用风机鼓风。你知道其中的道理吗? 【学生回答】 液化气灶、煤炉等燃具都留有空气进口,且空气进口大小可以调节,目的是保证氧气充足,使燃料充分燃烧。 用风机给锅炉鼓风能加速空气流动,增大煤与氧气的接触面积,使煤燃烧更充分。 【教师提问】 请观察老师演示的蜡烛不完全燃烧的实验(教材第94页图4-3),并与同学交流你的看法。 【学生回答】 玻璃片上有黑色物质生成,蜡烛不完全燃烧有炭黑生成。 【教师提问】 燃料的不完全燃烧、汽车排放出的废气、管道煤气泄漏等都会增加空气中一氧化碳的含量。那么一氧化碳具有哪些性质呢? 【教师讲述】 4.一氧化碳的性质 (1)一氧化碳的物理性质 无色、无味的气体,难溶于水,标准状况下密度是1.25 g/L,比空气略小。不能用排空气法收集一氧化碳。 (2)一氧化碳的化学性质 ①可燃性:一氧化碳燃烧火焰呈蓝色,燃烧放出大量的热。反应的文字表达式:一氧化碳+氧气二氧化碳 CO O2 CO2 ②还原性:一氧化碳在加热的条件下能将金属氧化物还原为金属单质,是冶炼金属的原料。 ③毒性:一氧化碳能与人体血液中的血红蛋白结合,使血红蛋白失去输氧能力而中毒。 课堂小结 今天,我们学习了燃烧及燃烧的条件、完全燃烧与不完全燃烧,燃烧是一种发光、发热的剧烈的化学反应。物质燃烧一般需要同时满足三个条件:(1)物质具有可燃性;(2)可燃物与氧气接触;(3)可燃物达到燃烧所需要的最低温度(着火点)。物质完全燃烧的条件包括:(1)增大氧气的浓度;(2)增大可燃物跟氧气的接触面积。 当堂达标 1.关于燃烧的叙述正确的是( ) A.燃烧一定有发光、发热的现象产生 B.燃烧一定有气体生成 C.有发光、发热的变化一定是燃烧 D.凡是燃烧的物质,一定有火焰产生 答案:A 2.下列有关一氧化碳的说法错误的是( ) A.一氧化碳可以燃烧,可作气体燃料 B.一氧化碳有剧毒 C.一氧化碳能溶于水生成酸 D.一氧化碳能与血液中的血红蛋白结合 答案:C 3.为探究物质的燃烧条件,某同学进行了如下图所示的实验,下列说法错误的是( ) A.白磷是可燃物,红磷不是可燃物 B.热水中的白磷不燃烧是因为没有与氧气接触 C.铜片上的红磷不燃烧是因为温度未达到它的着火点 D.实验中水的作用是提供热量及隔绝氧气 答案:A 4.在下列蜡烛燃烧的实验中,对有关实验现象的描述错误的是( )
实验1 实验2 实验3 实验4 A.实验1中蜡烛火焰逐渐熄灭 B.实验2中白瓷板表面无明显变化 C.实验3中外焰部分的火柴杆最先炭化 D.实验4中烧杯内有气泡生成,蜡烛火焰熄灭 答案:B 5.为了探究燃烧的条件,小军查阅资料得知:白磷的着火点为40 ℃,红磷的着火点为240 ℃,五氧化二磷能刺激人的呼吸道。他设计了如图所示的实验装置。将分别盛有少量白磷和少量红磷的两支试管,放到盛水的烧杯中,另将少量白磷直接投入烧杯的水中。观察到的实验现象如下: ①试管中的白磷燃烧,产生大量的白烟;②试管中的红磷不燃烧;③烧杯中的白磷不燃烧。 (1)白磷燃烧的文字表达式为 。 (2)分析实验现象,得出结论: 由现象①②得到的燃烧条件是 。 由现象①③得到的燃烧条件是 。 (3)请举一例说明燃烧必须有可燃物参加: 。 (4)请你根据小军查阅的资料和实验现象,指出他设计的装置的不足: 。 答案:(1)磷+氧气五氧化二磷 (2)温度达到着火点 与氧气(或空气)接触 (3)关闭燃气灶阀门,火焰熄灭(或打火机没燃料后打不着火,合理即可) (4)白磷燃烧没有在密闭装置中进行,生成的五氧化二磷会污染空气 板书设计 第4章 认识化学变化 第1节 常见的化学反应——燃烧 第1课时 一、燃烧 1.燃烧的定义 2.对燃烧的理解 3.燃烧与人类生产、生活的关系 二、燃烧的条件 物质燃烧一般需要同时满足三个条件: (1)物质具有可燃性; (2)可燃物与氧气接触; (3)可燃物达到燃烧所需要的最低温度(着火点)。 注意:物质燃烧一般需要三个条件同时满足,缺少其中任何一个,燃烧都不能发生。 三、完全燃烧与不完全燃烧 1.完全燃烧与不完全燃烧 (1)完全燃烧 (2)不完全燃烧 2.物质完全燃烧的条件 (1)增大氧气的浓度; (2)增大可燃物跟氧气的接触面积。 3.燃料完全燃烧的意义 4.一氧化碳的性质 (1)一氧化碳的物理性质 (2)一氧化碳的化学性质 ①可燃性 ②还原性 ③毒性
| ||||||||||||||||||||
沪教版九年级上册第1节 常见的化学反应——燃烧教课内容ppt课件: 这是一份沪教版九年级上册第1节 常见的化学反应——燃烧教课内容ppt课件,共30页。PPT课件主要包含了学习目标,新课讲解,燃烧的条件,物质具有可燃性,三者缺一不可,燃烧条件,该物质的着火点,常见物质的着火点,完全燃烧与不完全燃烧,一氧化碳的化学性质等内容,欢迎下载使用。
初中化学沪教版九年级上册第4章 认识化学变化第1节 常见的化学反应——燃烧试讲课课件ppt: 这是一份初中化学沪教版九年级上册第4章 认识化学变化第1节 常见的化学反应——燃烧试讲课课件ppt,共52页。PPT课件主要包含了观察到的现象,燃烧的特征可归纳为,蜡烛不完全燃烧,常见气体的爆炸极限,清除隔离可燃物,隔绝氧气,灭火的原理,完成课后习题等内容,欢迎下载使用。
沪教版九年级上册第1节 常见的化学反应——燃烧教学课件ppt: 这是一份沪教版九年级上册第1节 常见的化学反应——燃烧教学课件ppt,文件包含41常见的化学反应燃烧第1课时课件pptx、41常见的化学反应燃烧第1课时练习含答案解析docx、41常见的化学反应燃烧第1课时练习docx、01燃烧条件的探究实验wmv、02紫日wmv等5份课件配套教学资源,其中PPT共27页, 欢迎下载使用。













