





所属成套资源:人教版高中化学选修性必修1同步PPT课件+练习(含答案)全册
人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡优质ppt课件
展开
这是一份人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡优质ppt课件,共29页。PPT课件主要包含了学习目标,一可逆反应,二化学平衡状态,四化学平衡常数等内容,欢迎下载使用。
1.理解可逆反应与不可逆反应的概念,学会判断反应的不可逆性及可逆性大小。2.能描述化学平衡建立的过程。3.掌握化学平衡状态的特征,并能判断在一定条件下,可逆反应已达到平衡状态。4.理解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。
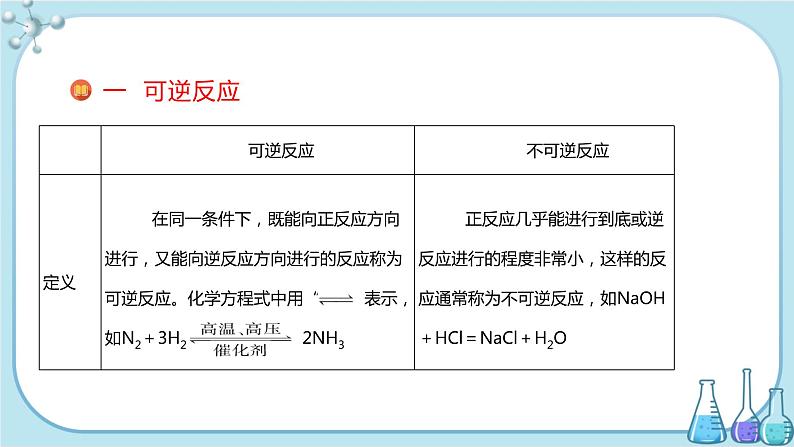
(2)可逆反应的特征:①可逆反应必须是在同一条件下,在正反应进行的同时,逆反应也在进行。②可逆反应不能进行到底,也就是说可逆反应无论进行到何种程度,反应物和生成物并存,即任何物质的量都不可能为0。注意:判断一个反应是否为可逆反应的关键是可逆反应必须是在同一条件下。例如,2H2+O2 2H2O和2H2O2H2↑+O2↑不是可逆反应,因为反应条件不一样,而2SO2+O2 2SO3则是可逆反应。
【例1】 密闭容器中发生可逆反应:X2(g)+Y2(g) 2Z(g)。已知起始时X2、Y2、Z各物质的浓度分别为0.1 ml·L-1、0.3ml·L-1、0.2ml·L-1,反应在一定条件下达到平衡时,各物质的物质的量浓度可能是( )A.c(Z)=0.3 ml·L-1、B.c(Y2)=0.35 ml·L-1C.c(Y2)=0.2 ml·L-1D.c(Z)=0.4 ml·L-1
[解析] 若反应向右进行,则X2、Y2、Z三种物质的物质的量浓度范围依次是:0~0.1 ml·L-1、0.2 ml·L-1~0.3 ml·L-1、0.2 ml·L-1~0.4 ml·L-1;若反应向左进行,则X2、Y2、Z三种物质浓度范围依次是:0.1 ml·L-1~0.2 ml·L-1、0.3 ml·L-1~0.4 ml·L-1、0~ 0.2 ml·L-1。[答案] AB[点拨] 可逆反应总是不能进行到底,得到的总是反应物与生成物的混合物。
【例2】 在密闭容器中进行N2+3H2 2NH3反应,起始时N2和H2分别为10 ml 和30 ml,当达到平衡时,N2的转化率为30%。若以NH3作为起始反应物,反应条件与上述反应相同时,要使其反应达到平衡时各组成成分的物质的量分数与前者相同,则NH3的起始物质的量和它的转化率正确的是( )A.40 ml,35% B.20 ml,30%C.20 ml,70% D.10 ml,50%
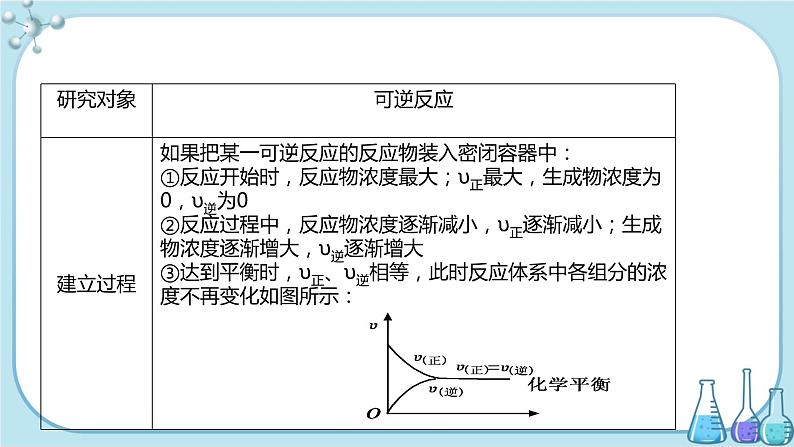
根据题意:可推算出反应达到平衡时各组成成分的物质的量。 N2+ 3H2 2NH3起始量10 ml 30 ml 0变化量10×30%=3 ml 9 ml 6 ml平衡量7 ml 21 ml 6 ml从逆向思维考虑,若正反应进行到底,可求得生成NH3 20 ml,此NH3的物质的量就是从逆向进行上述反应时,NH3的起始反应量。
在同温和同一容器中进行逆向反应达到平衡时,各组成成分的物质的量与上述反应相同。 N2 + 3H2 2NH3起始量0 0 20 ml平衡量7 ml 21 ml 20-14=6 ml可见NH3起始量20 ml NH3的转化率 ×100%=70%。 [答案] C
1.直接判断法(1)正反应速率=逆反应速率>0。(2)同一物质的消耗速率与生成速率相等。(3)各组分的浓度保持不变。2.间接判断法(1)各组分的百分含量保持不变。(2)各组分的物质的量保持不变。(3)各气体的体积不随时间的改变而改变。
三 判断可逆反应是否达到平衡的方法
3.以反应mA(g)+nB(g) pC(g)+qD(g)为例来说明
注意:可逆反应达到平衡状态时有两个核心判断依据:(1)正反应速率和逆反应速率相等。(2)反应混合物中各组成成分的百分含量保持不变。依据其他有关的量判断可逆反应是否达到平衡状态时,最终都要回归到这两个核心依据上来。
【例3】 下列方法中可以证明2HI(g) H2(g)+I2(g)已达平衡状态的是________。①单位时间内生成n ml H2的同时生成n ml HI②一个H—H键断裂的同时有两个H—I键断裂③百分组成 HI%=I2%④反应速率ν(H2)=ν(I2)= ν(HI)时⑤c(HI) ∶ c(H2) ∶ c(I2)=2 ∶ 1 ∶ 1时⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时容器内压强不再变化⑧条件一定,混合气体的平均相对分子质量不再变化⑨温度和体积一定时,混合气体的颜色不再变化⑩温度和压强一定时,混合气体的密度不再化变讨论:在上述⑥~⑩的说法中能说明2NO2 N2O4达到平衡状态的是________。
[解析] 化学平衡状态是指在一定条件下的可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。化学平衡状态的标志(1)微观标志:ν正=ν逆≠0规律:①同一物质的生成速率等于消耗速率;②在方程式同一边的不同物质生成速率与消耗速率之比(或消耗速率与生成速率之比,前后比较项必须相反)等于方程式系数之比;③方程式两边的不同物质生成速率与生成速率之比(或消耗速率与消耗速率之比,前后比较必须相同)等于方程式系数之比。
(2)宏观标志、反应混合物中各组分百分含量一定。规律:①各组分的质量分数不变;②各气体组分的体积分数不变;③各组分的物质的量分数不变;④各组分的分子数之比不变;⑤各组分的物质的量浓度不变时一定平衡(变化时不一定);⑥各组分的转化率或产率不变;⑦若某组分有色,体系的颜色不再改变时一定平衡(变化时不一定)。[答案] ②⑥⑨;⑥⑦⑧⑨⑩
说明:①对于一个可逆反应,浓度平衡常数的表达式不是唯一的,它与化学反应方程式的书写有关。化学反应方程式的书写不同,各反应物、生成物的化学计量数不同,平衡常数的表达式就不同。②对于有固体、水参加或生成的反应来说,固体、水的浓度视为常数,不应包含在化学平衡常数的表达式中。③K只受温度影响,当温度不变时,K值不变;温度升高时,对ΔH<0的反应,K值变小;ΔH>0的反应,K值增大。如果由于浓度、压强的改变而引起化学平衡的移动,但温度恒定,则K值一定不变。
例4 将固体NH4I置于密闭容器中,在一定温度下发生下列反应:①NH4I(s) NH3(g)+HI(g);②2HI(g) H2(g)+I2(g)。达到平衡时,c(H2)=0.5 ml·L-1 c(HI)=4 ml·L-1,则此温度下反应①的平衡常数为( )A.9 B.16 C.20 D.25
[解析] 由H2和HI的平衡浓度可推算出①反应生成的HI和NH3的浓度都为0.5×2+4=5 ml·L-1,由于NH3没有转化,其平衡浓度仍为5 ml·L-1,而HI的平衡浓度由题意可知为4 ml·L-1,则①的平衡常数K1=[NH3]平·[HI]平=5×4=20,C正确。[答案] C
相关课件
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡课文配套课件ppt,共34页。
这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡课文配套ppt课件,共56页。PPT课件主要包含了目录索引,探究一化学平衡状态,探究二化学平衡常数等内容,欢迎下载使用。
这是一份人教版 (2019)选择性必修1第二节 化学平衡作业ppt课件,共44页。PPT课件主要包含了答案A,ABCE,ΔH1-ΔH2等内容,欢迎下载使用。









