




高中化学第一节 原电池备课课件ppt
展开1.了解常见化学电源的种类及其工作原理。2. 了解一次电池、二次电池、燃料电池的工作原理。
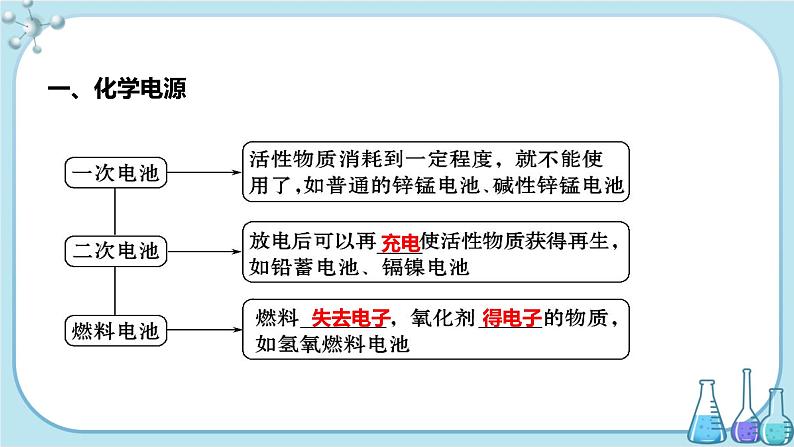
化学电源:将化学能转化为电能的装置
二、一次电池只能使用一次,不能充电复原继续使用1.碱性锌锰干电池总反应:Zn+2MnO2+2H2O===2MnOOH+Zn(OH)2。负极材料: 。电极反应: 。正极材料:碳棒。电极反应: 。
Zn+2OH--2e-===Zn(OH)2
2MnO2+2H2O+2e-===2MnOOH+2OH-
2.锂电池Li-SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4-SOCl2。电池的总反应可表示为8Li+3SOCl2===6LiCl+Li2SO3+2S。(1)负极材料为 ,电极反应为 。(2)正极的电极反应为 。
8Li-8e-===8Li+
四、燃料电池1.氢氧燃料电池2.乙醇燃料电池(电解质溶液为KOH溶液)负极:C2H5OH+16OH--12e- =2CO32-+11H2O 正极:3O2+6H2O+12e- = 12OH- 总反应式:C2H5OH+3O2+4OH- = 2CO32-+5H2O
3.甲烷燃料电池(固体电解质)一个电极通入空气,另一个电极通入甲烷,电池的电解质为掺杂了Y2O3(三氧化二钇)的ZrO2(二氧化锆)晶体,它在高温下能传导O2-。该电池的电极反应可表示如下负极:CH4+4O2--8e- = CO2+2H2O 正极:2O2+8e- = 4O2- 总反应式:CH4+2O2 = CO2+2H2O 4.甲醇燃料电池(电解质溶液为H2SO4溶液)负极:2CH3OH+2H2O-12e- = 2CO2↑+12H+ 正极:3O2+12H++12e- = 6H2O 总反应式:2CH3OH+3O2 = 2CO2+4H2O
燃料电池电极反应式书写的常用方法第一步,写出电池总反应式。燃料电池的总反应与燃料燃烧的反应一致,若产物能和电解质反应,则总反应为加合后的反应。如甲烷燃料电池(电解质溶液为NaOH溶液)的反应如下:CH4+2O2===CO2+2H2O ①CO2+2NaOH===Na2CO3+H2O ②①+②可得甲烷燃料电池的总反应式:CH4+2O2+2NaOH===Na2CO3+3H2O。
第二步,写出电池的正极反应式。根据燃料电池的特点,一般在正极上发生还原反应的物质都是O2,因电解质溶液不同,故其电极反应也会有所不同:(1)酸性电解质:O2+4H++4e-===2H2O。(2)碱性电解质:O2+2H2O+4e-===4OH-。(3)固体电解质(高温下能传导O2-):O2+4e-===2O2-。(4)熔融碳酸盐(如熔融K2CO3):O2+2CO2+4e-===2CO。第三步,电池的总反应式-电池的正极反应式=电池的负极反应式。
人教版 (2019)选择性必修1第一节 原电池教学演示课件ppt: 这是一份人教版 (2019)选择性必修1第一节 原电池教学演示课件ppt,共42页。
化学选择性必修1第四章 化学反应与电能第一节 原电池教学ppt课件: 这是一份化学选择性必修1第四章 化学反应与电能第一节 原电池教学ppt课件,共48页。PPT课件主要包含了课前·新知导学,能量转化率,MnO2,KOH,PbO2,H2SO4,课堂·重难探究,重难突破,典例精练,课堂小结等内容,欢迎下载使用。
高中人教版 (2019)第一节 原电池背景图ppt课件: 这是一份高中人教版 (2019)第一节 原电池背景图ppt课件,文件包含选择性必修1第四章第一节第2课时化学电源1-教学课件pptx、选择性必修1第四章第一节第2课时化学电源1-教学设计docx、选择性必修1第四章第一节第2课时化学电源1-学案docx、选择性必修1第四章第一节第2课时化学电源1-作业docx等4份课件配套教学资源,其中PPT共36页, 欢迎下载使用。













