





高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文课件ppt
展开
这是一份高中化学人教版 (2019)必修 第二册第二节 化学反应的速率与限度图文课件ppt,共22页。PPT课件主要包含了学习目标,①③④⑤⑥,②③⑤⑥⑦⑨等内容,欢迎下载使用。
你看到过建筑物的定向爆破吗?观察下图,你从中得到什么启示?
控制反应条件,可使化学反应按人们的预期进行。
第3课时 化学反应的限度和调控
知道化学平衡状态的特征,判断反应是否达到化学平衡状态
初步了解化学反应达到平衡状态的标志。培养科学探究与创新意识的学科核心素养
常用于判断反应达到平衡的依据
VA耗 = VA生VA耗 : VC耗 = x : zVB生 : VC生 = y : z VA耗 : VB生 = x : y
学习任务一 化学平衡状态的判断
b、反应物与生成物浓度不再改变:各物质的物质的量、百分含量、体积分数等保持恒定;
C、方程式左右两边气体系数之和不同的反应,压强、气体密度、气体的总物质的量、气体平均分子质量、容器压强(恒容条件)、容器体积(恒压条件)不变。
d、有色物质参加或生成的反应,颜色不再变时,或绝热容器中的温度不再改变。
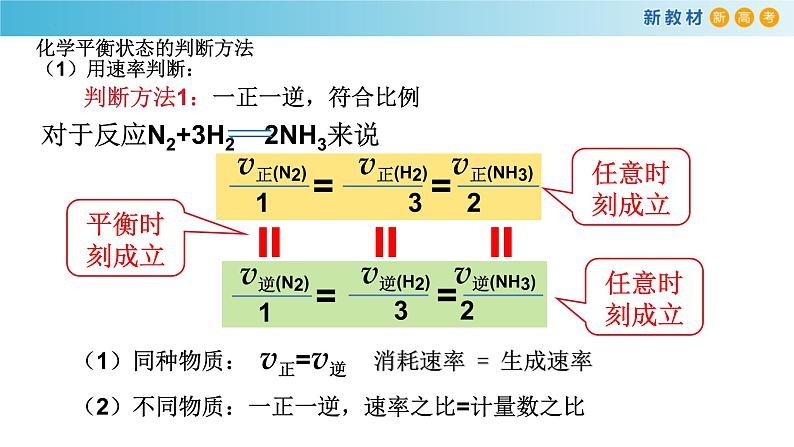
化学平衡状态的判断方法(1)用速率判断:
判断方法1:一正一逆,符合比例
(1)同种物质: v正=v逆 消耗速率 = 生成速率(2)不同物质:一正一逆,速率之比=计量数之比
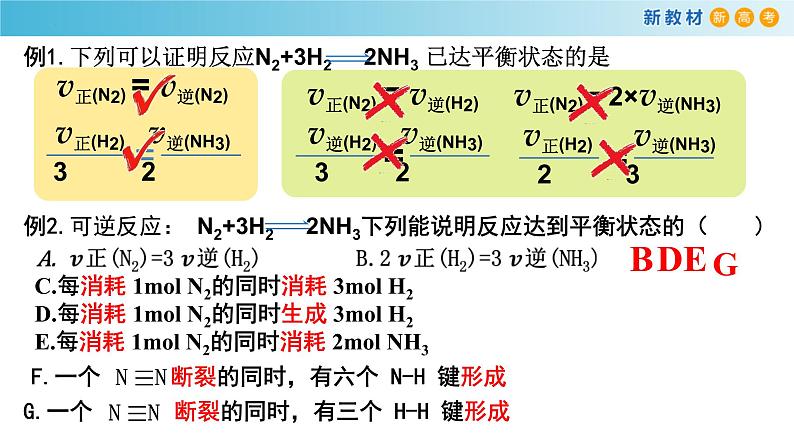
C.每消耗 1ml N2的同时消耗 3ml H2D.每消耗 1ml N2的同时生成 3ml H2E.每消耗 1ml N2的同时消耗 2ml NH3
v正(N2) = v逆(N2)
v正(N2) = v逆(H2)
v正(N2) = 2×v逆(NH3)
①:温度 绝热的恒容反应体系中温度保持不变,说明已达平衡
② :颜色(针对有颜色变化的反应)
若反应中有颜色变化,则颜色不变时,可认为已达平衡
(2)反应混合物中各组分的含量保持不变 (注意不是相等,也不是成一定的比值)
能作为判断平衡标志的物理量的特征:
变化 不变
判断方法2:变量不变,平衡出现
A.各组成成分的质量、质量分数、物质的量、物质的量分数、气体的体积及体积分数、物质的量浓度、分子数、反应物的转化率、产物的产率保持不变时为平衡状态。
B.反应体系中的总物质的量、总体积、总压强、平均摩尔质量、混合气体的密度、颜色等保持不变时,要根据具体情况判断是否为平衡状态。
3、特殊判据:针对有气体参与或生成的反应
若m+n≠p+q
注意:若m+n = p+q,则上述判据不成立
4、特殊判据:针对有气体参与或生成的反应
① m(g)不变 ⇒ 达到平衡
③ 若b = c+d,
则判据:n(g) 、p总 不适用
以下情况可作为反应达到平衡的标志的是
①反应混合物中各气体的体积分数
②混合气体的颜色不再改变
③混合气体的密度不再改变
④混合气体的压强不再改变
例3:在两个恒容密闭容器中进行如下两个反应
⑤混合气体的平均相对分子质量不再改变
例4:在恒温恒容密闭容器中,当①混合气体的密度(②混合气体的平均相对分子质量)不再发生变化时,能否说明以下反应已达到平衡状态:(1) 2SO2(g)+O2(g) 2SO3(g)。① ②(2) I2(g)+H2(g) 2HI(g)。 ① ②(3) 2NO2(g) N2O4(g) ① ②(4) C(s)+CO2(g) 2CO(g) ① ②(5) A(s)+2B(g) C(g)+D(g) ① ② (6) NH2COONH4(s) 2NH3(g)+CO2(g) ① ②(7) 5CO(g)+I2O5(s) 5CO2(g)+I2(s) ① ②
例5、在一恒容密闭容器中,发生反应:2SO2(g)+O2(g) ⇋2SO3(g)下列说法能够证明上述反应已达平衡状态的是: 。
①各物质的物质的量浓度不再改变②SO2 、O2、SO3的浓度之比为2:1:2③ SO2的转化率不再改变 ④ SO3的体积分数不再改变 ⑤混合物的总质量不再改变 ⑥混合气体的密度不再改变 ⑦混合物的颜色不再改变⑧混合物的平均摩尔质量不再改变⑨绝热容器中反应体系的温度不再改变 ⑩恒温容器中混合气体的压强一定
其他有颜色变化的反应: I2(g)+H2(g) ⇋2HI(g)(紫色)
【思维建模】解答有关化学平衡标志的思维流程如下:
“三关注”“一等一不变”(1)三关注:①关注反应条件,是恒温恒容,恒温恒压,还是绝热恒容容器;②关注反应特点,是等体积反应,还是非等体积反应;③关注特殊情况,是否有固体参加或生成,或固体的分解反应。
1.在恒温、恒容下,可逆反应:A(g)+ 3B(g)=== 2C(g)达到平衡的标志是 A.C的生成速率与C的分解速率相等。 B.单位时间生成n mlA,同时生成3n mlB。 C.A、B、C的物质的量浓度保持不变。 D.A、B、C的分子数之比为1 :3 :2 。 E.容器中气体的密度保持不变。 F.容器中气体的总压强保持不变。
2、在恒温恒容下,下列叙述是可逆反应A(气)+3B(气) 2C(气)+2D(固)达到平衡的标志的是 ( ①C的生成 速率与C的分解速率相等 ②单位时间内生成amlA,同时生成3amlB ③A、B、C的浓度不再变化④混合气体的总压强不再变化
⑤混合气体的物质的量不再变化⑥单位时间内消耗amlA,同时生成 3amlB⑦A、B、C、D的分子数之比为1:3:2:2
高炉炼铁过程中发生的反应包括了可逆反应,而可逆反应存在一定的限度,当反应达到其限度以后,各物质的量就不变了,因此炼铁过程中,原料是不可能完全转化为产物的。
对炼铁的反应进行深入研究还有没有意义?
对炼铁的反应进行深入研究的意义:
可逆反应的限度是建立在一定条件的基础上的,改变反应条件可以在一定程度上改变反应的限度。
所以通过对反应条件的控制,可以促进有利的化学反应,抑制有害的化学反应。
①控制反应速率的措施:改变温度、溶液的浓度、气体压强(或浓度)、 固体表面积及使用催化剂
②控制转化率的措施:改变温度、溶液浓度、气体压强(或浓度)
学习任务二 化学反应条件的控制
2.控制反应条件的基本措施
提高速率、提高转化率及原料利用率等
降低速率、控制副反应、减少或消除有害物等
3.化工生产中控制反应条件的原则
①原则:在化工生产中,为了提高反应进行的程度而调控反应条件时,需要考虑控制反应条件的成本和实际可能性
达到平衡时平衡混合物中NH3的含量(体积分数)
压强增大,氨的含量增大
温度升高,氨的含量降低
例.下图所示为工业合成氨的流程图。下列有关生产条件的调控作用分析正确的是___________(填序号)。
(1)步骤①中“净化”可以防止催化剂中毒(2)步骤②中“加压”可以加快反应速率(3)步骤②采用的压强是2×107 Pa,因为在该压强下铁触媒的活性最大(4)步骤③,选择高效催化剂是合成氨反应的重要条件(5)目前,步骤③一般选择控制反应温度为700 ℃左右(6)步骤④⑤有利于提高原料的利用率,能节约生产成本
(1)(2)(4)(6)
相关课件
这是一份化学人教版 (2019)第七章 有机化合物第二节 乙烯与有机高分子材料授课课件ppt,共27页。PPT课件主要包含了学习目标,聚合反应,加成聚合反应等内容,欢迎下载使用。
这是一份高中化学人教版 (2019)必修 第二册第一节 认识有机化合物教课内容课件ppt,共25页。PPT课件主要包含了碳+氢,tànqīng,tīng,学习目标等内容,欢迎下载使用。
这是一份人教版 (2019)必修 第二册第二节 化学反应的速率与限度示范课课件ppt,共24页。PPT课件主要包含了S18O2,S16O18O,学习目标等内容,欢迎下载使用。










