
所属成套资源:各地区2023年高考化学模拟题汇编
广东省2023年高考化学模拟题汇编-17化学平衡(选择题)
展开这是一份广东省2023年高考化学模拟题汇编-17化学平衡(选择题),共15页。试卷主要包含了单选题,多选题等内容,欢迎下载使用。
广东省2023年高考化学模拟题汇编-17化学平衡(选择题)
一、单选题
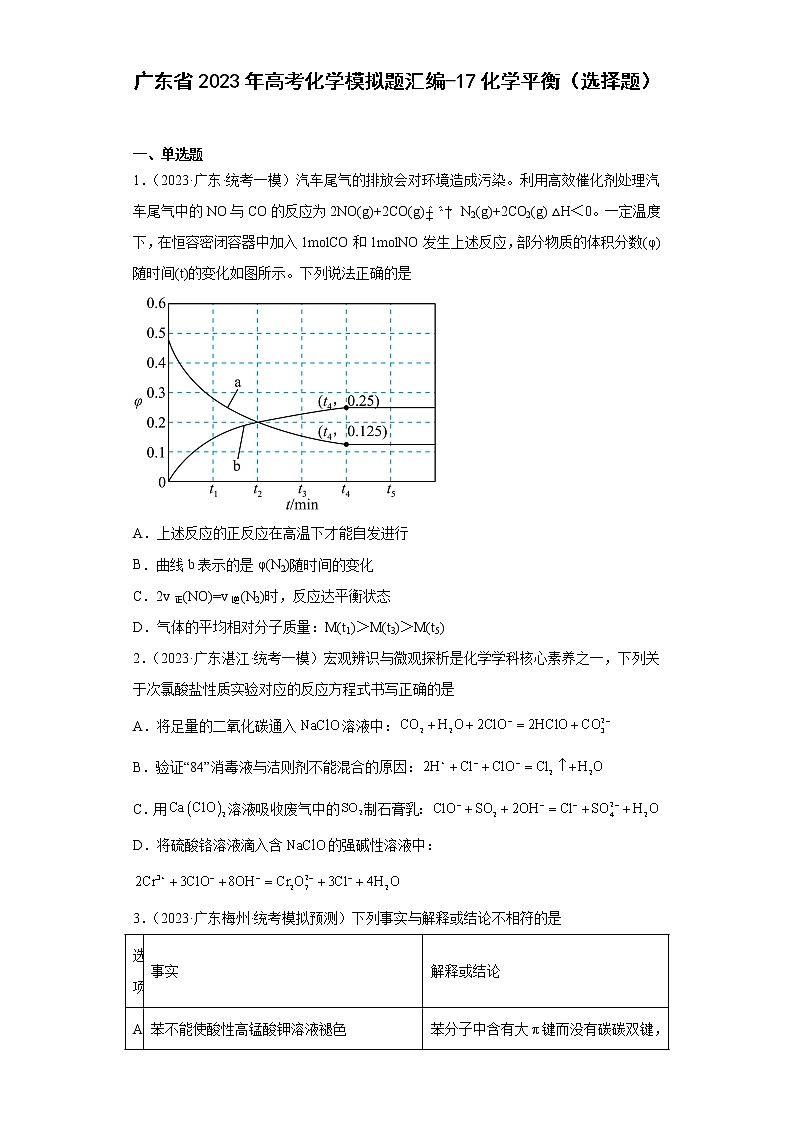
1.(2023·广东·统考一模)汽车尾气的排放会对环境造成污染。利用高效催化剂处理汽车尾气中的NO与CO的反应为2NO(g)+2CO(g)N2(g)+2CO2(g) △H<0。一定温度下,在恒容密闭容器中加入1molCO和1molNO发生上述反应,部分物质的体积分数(φ)随时间(t)的变化如图所示。下列说法正确的是
A.上述反应的正反应在高温下才能自发进行
B.曲线b表示的是φ(N2)随时间的变化
C.2v正(NO)=v逆(N2)时,反应达平衡状态
D.气体的平均相对分子质量:M(t1)>M(t3)>M(t5)
2.(2023·广东湛江·统考一模)宏观辨识与微观探析是化学学科核心素养之一,下列关于次氯酸盐性质实验对应的反应方程式书写正确的是
A.将足量的二氧化碳通入溶液中:
B.验证“84”消毒液与洁则剂不能混合的原因:
C.用溶液吸收废气中的制石膏乳:
D.将硫酸铬溶液滴入含的强碱性溶液中:
3.(2023·广东梅州·统考模拟预测)下列事实与解释或结论不相符的是
选项 | 事实 | 解释或结论 |
A | 苯不能使酸性高锰酸钾溶液褪色 | 苯分子中含有大π键而没有碳碳双键,大π键稳定性较强 |
B | 是极性分子 | 中只含有极性键 |
C | 键角: | 水分子中O的孤电子对数比氨分子中N的多 |
D | 取2mL 0.5 溶液于试管中,进行加热,发现溶液颜色变为黄绿色;后将试管置于冷水中,溶液颜色又由黄绿色转变为蓝绿色 | 溶液中存在以下平衡: ,在其他条件不变时,升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动 |
A.A B.B C.C D.D
4.(2023·广东湛江·统考一模)氨气在工业上应用广泛,已知反应 ,反应相同时间,的体积百分数随温度的变化情况如图所示,下列相关描述正确的是
A.线上的点均代表平衡时刻的点 B.逆反应速率:
C.b点时 D.平衡常数值:
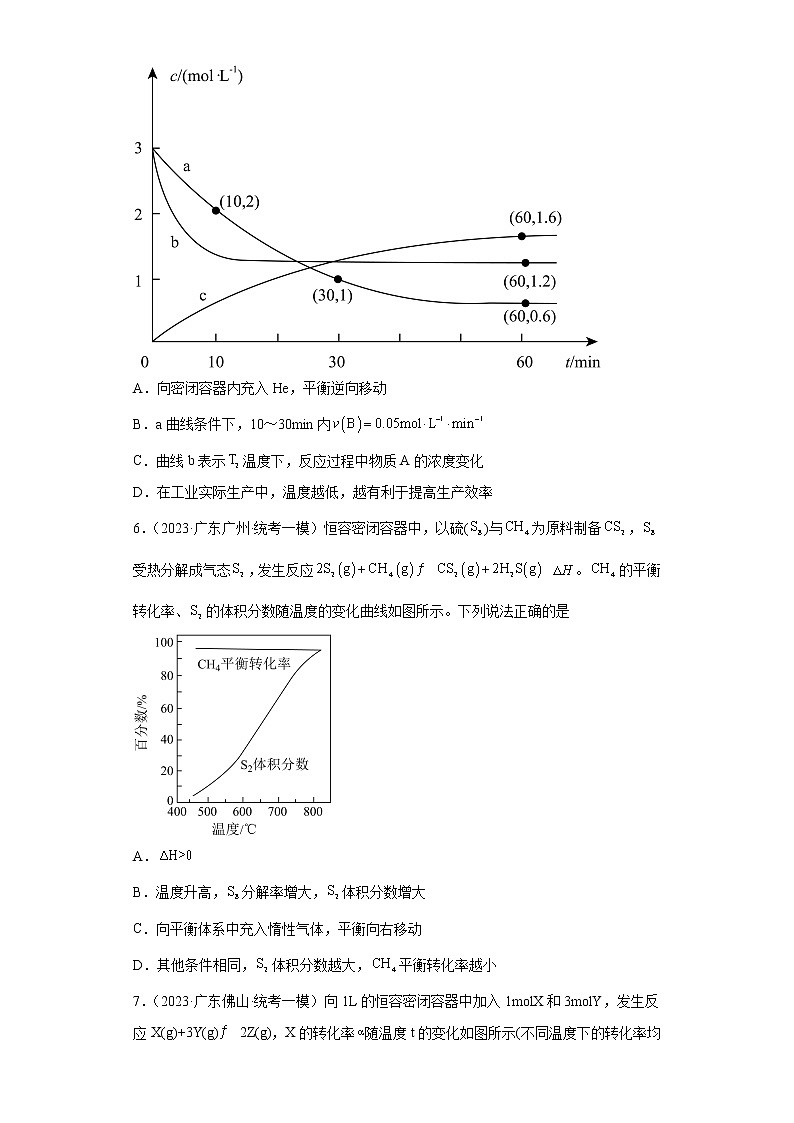
5.(2023·广东梅州·统考模拟预测)在恒容密闭容器中,分别在、温度下,发生反应 ,反应体系中各物质的浓度c随时间t的部分变化曲线如图所示。下列说法正确的是
A.向密闭容器内充入He,平衡逆向移动
B.a曲线条件下,10~30min内
C.曲线b表示温度下,反应过程中物质A的浓度变化
D.在工业实际生产中,温度越低,越有利于提高生产效率
6.(2023·广东广州·统考一模)恒容密闭容器中,以硫()与为原料制备,受热分解成气态,发生反应 。的平衡转化率、的体积分数随温度的变化曲线如图所示。下列说法正确的是
A.
B.温度升高,分解率增大,体积分数增大
C.向平衡体系中充入惰性气体,平衡向右移动
D.其他条件相同,体积分数越大,平衡转化率越小
7.(2023·广东佛山·统考一模)向1L的恒容密闭容器中加入1molX和3molY,发生反应X(g)+3Y(g)2Z(g),X的转化率随温度t的变化如图所示(不同温度下的转化率均为反应第10min数据)。下列说法正确的是
A.a点的反应速率
B.a、b、c点对应的大小关系为:
C.c点时,每消耗的同时,消耗
D.若将容器体积扩大为2倍,则c点对应温度下的增大
8.(2023·广东·校联考一模)一定温度下,向2L恒温密闭容器中加入足量活性炭和2 mol NO2,发生反应,部分物质的物质的量随反应时间t的变化曲线如图所示,下列说法正确的是
A.曲线Ⅱ表示c(CO2)随t的变化
B.0~2 min内,
C.3 min时,加入催化剂可同时增大NO2的生成速率和消耗速率
D.3 min时。充入N2增大压强,该容器的气体颜色不变
9.(2023·广东深圳·统考一模)恒容密闭容器中,与在不同温度下发生反应:,达到平衡时,各组分的物质的量浓度(c)随温度(T)变化如图所示:
下列说法正确的是
A.该反应的平衡常数随温度升高而增大
B.曲线Y表示随温度的变化关系
C.提高投料比,可提高的平衡转化率
D.其他条件不变,与在℃下反应,达到平衡时
10.(2023·广东江门·校联考模拟预测)氢还原辉钼矿并用碳酸钠作固硫剂的原理为MoS2(s)+4H2(g)+2Na2CO3(s)Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H。平衡时的有关变化曲线如图。下列说法正确的是
A.该反应在低温下可以自发进行
B.粉碎矿物和增大压强都有利于辉钼矿的还原
C.图2中T1对应图1中的温度为1300℃
D.若图1中A点对应温度下体系压强为10MPa,则H2O(g)的分压为5MPa
11.(2023·广东·惠州一中模拟预测)溶液中存在如下平衡:。已知蓝色与黄色的复合色为绿色,蓝色的溶液加热后会变为绿色,下列说法正确的是
A.上述平衡的正反应为放热反应
B.的空间构型为正四面体
C.为研究对平衡的影响,可向溶液中加入少量固体,充分搅拌后观察溶液颜色变化
D.加热蒸干溶液,最终会得到固体
12.(2023·广东·深圳市光明区高级中学校联考模拟预测)Xe和形成的氟化物有、、三种,已知:在低温下主要发生,随着温度升高、依次发生分解反应。下图表述的是以和为始态得到的生成物在平衡体系内的分压与反应温度的关系。下列说法中错误的是。
A.由图可知Xe的三种氟化物中最稳定
B.反应的
C.制备的合适温度约为550K
D.与NaOH溶液反应产生的化学方程式为
13.(2023·广东广州·广州市第二中学校考模拟预测)现有下列四个图象,下列反应中全部符合上述图象的反应是
A.N2(g)+3H2(g) 2NH3(g);△H<0 B.2SO3(g) 2SO2(g)+O2(g);△H>0
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g);△H<0 D.H2(g)+ CO(g) C(s)+H2O(g);△H>0
14.(2023·广东广州·广东实验中学校考模拟预测)常压下羰基化法精炼镍的原理为:。230℃时,该反应的平衡常数。已知:的沸点为42.2℃,固体杂质不参与反应。
第一阶段:将粗镍与反应转化成气态;
第二阶段:将第一阶段反应后的气体分离出来,加热至230℃制得高纯镍。
下列判断正确的是
A.升高温度,该反应的平衡常数减小
B.该反应达到平衡时,
C.第一阶段,在30℃和50℃两者之间选择反应温度,选30℃
D.第二阶段,分解率较低
15.(2023·广东广州·广东实验中学校考模拟预测)下列关于实验仪器和操作说法不正确的是
A.研究浓度对化学平衡的影响 B.制备并检验乙烯
C.用盐酸溶液滴定氢氧化钠溶液 D.除去溴苯中的苯
16.(2023·广东广州·广州市第二中学校考模拟预测)一定条件下,在容积为10 L的固定容器中发生反应:N2(g)+3H2(g)2NH3(g) ΔH<0,反应过程如下图。下列说法正确的是
A.t1 min时,正、逆反应速率相等
B.曲线X表示NH3的物质的量随时间变化的关系
C.0~8 min,H2的化学反应速率v(H2)=0.75 mol·L-1·min-1
D.10~12 min,N2的化学反应速率v(N2)=0.25 mol·L-1·min-1
二、多选题
17.(2023·广东湛江·统考一模)氨气在工业上应用广泛,已知反应N2(g)+3H2(g)2NH3(g) △H<0,反应相同时间,NH3的体积百分数随温度的变化情况如图所示,下列相关描述正确的是
A.线上的点均代表平衡时刻的点 B.逆反应速率:va>vb
C.b点时v正<v逆 D.平衡常数值:Kc>Kd
参考答案:
1.B
【详解】A.反应为放热的熵减反应,则上述反应的正反应在低温下才能自发进行,A错误;
B.由化学方程式可知,一氧化氮、一氧化碳、二氧化碳的系数相同,且为氮气系数的2倍,结合图像比较物质的体积分数的变化量可知,曲线b表示物质的变化量较小,故b表示的是φ(N2)随时间的变化,B正确;
C.2v正(NO)=v逆(N2)时,此时正逆反应速率不相等,反应没有达平衡状态,C错误;
D.混合气体的平均摩尔质量为M= m/n,气体质量不变,但是气体的总物质的量随反应进行而减小,故气体平均相对分子质量逐渐变大,故气体的平均相对分子质量:M(t1)<M(t3)<M(t5),D错误;
故选B。
2.B
【详解】A.足量二氧化碳通入溶液生成的是,离子方程式为:,A错误;
B.“84”消毒液与洁厕剂混合的离子方程式为,因生成有毒的氯气,因此两者不能混合使用,B正确;
C.生成的微溶于水不能拆,离子反应为:,C错误;
D.强碱性溶液不生成,离子反应为:,D错误;
故选:B。
3.B
【详解】A.苯分子中含有大π键而没有碳碳双键,大π键稳定性较强,不能被酸性高锰酸钾溶液氧化,故A正确;
B.是极性分子,其中含有极性键H-O键和非极性键O-O键,故B错误;
C.H2O和NH3的中心原子O和N都是sp3杂化,杂化轨道都是正四面体构型,但孤电子对间的排斥力比成键电子对间的排斥力大,且孤电子对越多,斥力越大,键角被压缩得越小,而H2O有两对孤电子对,NH3有一对孤电子对,所以H2O的键角比NH3的键角
小,故C正确;
D.溶液中存在以下平衡: ,该反应是吸热反应,升高温度,平衡正向移动,转化为,溶液颜色变为黄绿色;降低温度,平衡逆向移动,转化为,溶液颜色又由黄绿色转变为蓝绿色,故D正确;
故选B。
4.D
【分析】由图可知,c点氨气的体积百分数最大,说明反应达到平衡,则c点以前为平衡的形成过程,c点以后为平衡的移动过程。
【详解】A.由分析可知,c点以前均未达到平衡,故A错误;
B.温度越高,反应速率越快,则d点逆反应速率大于a点,故B错误;
C.由分析可知,b点反应未达到平衡,正反应速率大于逆反应速率,故C错误;
D.该反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,由分析可知,c点以后为平衡的移动过程,则c点平衡常数大于d点,故D正确;
故选D。
5.C
【分析】曲线a、b都在下降,说明a、b都是A物质的浓度变化情况,且b先达到平衡,反应速率更快,故b对应的是T2温度。根据物质的量浓度的变化量,结合反应比例可知曲线c为T1温度下的B的浓度随时间的变化曲线。
【详解】A.恒容条件下充入He,各物质的分压没有发生改变,平衡不移动,A错误;
B.a曲线条件下,10~30min内,反应速率比等于化学计量数之比,则,B错误;
C.结合分析可知,a、b都是A物质的浓度变化情况,b对应的是T2温度,C正确;
D.降低温度,平衡正向移动,反应物的转化率提升,但温度过低会导致反应速率过慢,不利于提高生产效率,D错误;
答案选C。
6.B
【详解】A.由图像可看出,温度升高,CH4的平衡转化率降低,S2的体积分数升高说明升温时,平衡向左移动,所以正反应方向是放热的,即<0,选项A错误;
B.因为S8分解成S2需要吸收热量,S8(g) 4S2(g) >0,所以升温时,平衡右移,S8分解率增大,S2体积分数增大,选项B正确;
C.向恒温恒容的平衡体系中,通入惰性气体,由于与反应有关的气体物质的物质的量浓度均未变化,所以Q=K,平衡不移动,选项C错误;
D.其他条件不变时,S2体积分数增大,即c(S2)越大,则平衡向右进行的程度越大,CH4的平衡转化率越大,选项D错误;
答案选B。
7.C
【详解】A.由题干图像信息可知,a点X的转化率为30%,故a点X的反应速率为:=0.03,根据反应速率之比等于化学计量系数之比,故a点的反应速率,A错误;
B.由题干图像信息可知,a、b两点10min时未达到平衡,而c点10min时达到平衡,温度越高正、逆反应速率越快,故a、b、c点对应的大小关系为:,B错误;
C.由题干图像信息可知,c点时反应达到化学平衡,故有每消耗的同时消耗即正、逆反应速率相等,C正确;
D.由反应方程式可知X(g)+3Y(g)2Z(g)正反应是一个气体体积减小的方向,若将容器体积扩大为2倍,即减小容器压强,平衡逆向移动,则c点对应温度下的减小,D错误;
故答案为:C。
8.C
【详解】A.投入活性炭和NO2,随着反应时间的推移,NO2的物质的量减少,CO2和N2的物质的量增加,相同反应时间内CO2增加的量是N2的两倍,因此曲线I表示n(CO2)随t的变化,曲线Ⅱ表示n(N2)随t的变化,曲线Ⅲ表示n(NO2)随t的变化,A项错误;
B.碳是固体,浓度不随着反应时间推移而变化,不能用于表示反应速率,B项错误;
C.反应在此条件下2min后已经达到平衡,3 min时加入催化剂可以同时且同等程度加快正、逆反应的速率,C项正确;
D.3 min时向恒温恒容密闭容器中充入N2,平衡向逆反应方向移动,c(NO2)增大,容器中气体的颜色加深,D项错误;
故选C。
9.C
【详解】A.由图可知,温度升高,H2的平衡浓度增大,说明平衡逆向移动,该反应为放热反应,该反应的平衡常数随温度升高而减小,故A错误;
B.结合方程式可知,的变化量为变化量的,则曲线Y表示随温度的变化关系,故B错误;
C.提高投料比即增大CO2的浓度,平衡正向移动,的平衡转化率增大,故C正确;
D.其他条件不变,与在℃下反应,等效于增大压强,该反应是气体体积减小的反应,平衡正向移动,的浓度减小,当仍然大于与在℃下发生反应时的平衡浓度,故D错误;
故选C。
10.C
【详解】A.由方程式聚集状态知ΔS>0,由图1可知正反应是吸热反应ΔH>0,则根据ΔG=ΔH-TΔS<0知,该反应为高温下的自发反应,故A错误;
B.该反应是气体分子数增大的反应,增大压强平衡向逆反应方向进行,不利于反应向右进行,故B错误;
C.根据图像1,1300℃时该反应的平衡常数K==1,根据图2可知,T1℃是正逆化学平衡常数相等,即此时平衡常数为1,故C正确;
D.A点各组分的浓度之和为5mol/L,在同一容器中,压强之比等于物质的量之比,也等于浓度之比,所以A点对应温度下体系压强为10MPa时,H2O(g)的分压为4MPa,故D错误;
答案为C。
11.C
【详解】A.蓝色的溶液加热后会变为绿色,说明加热平衡正向移动,则反应为吸热反应,A错误;
B.中铜离子形成4个配位键,为对称结构不是正四面体,B错误;
C.为研究对平衡的影响,可向溶液中加入少量固体,增加氯离子浓度,充分搅拌后观察溶液颜色变化,C正确;
D.氯化铜会水解生成氢氧化铜和挥发性盐酸,加热蒸干溶液,得到氢氧化铜,氢氧化铜受热分解,故最终会得到氧化铜固体,D错误;
故选C。
12.B
【详解】A.已知:在低温下主要发生,随着温度升高、依次发生分解反应生成,则最稳定,A正确;
B.由图可知,随着温度升高,发生分解反应生成的量增加,则反应为吸热反应,焓变大于零,B错误;
C.制备的合适温度约为550K,此时含量最高,C正确;
D.与NaOH溶液反应产生,氧元素化合价升高则Xe化合价降低生成Xe单质,反应为,D正确;
故选B。
13.B
【详解】A.N2(g)+3H2(g) 2NH3(g);△H<0;增大压强,平衡正向移动,生成物浓度增大;正反应放热,升高温度,平衡逆向移动,生成物浓度减小,与图1、图3不符;故不选A;
B.2SO3(g) 2SO2(g)+O2(g)正反应吸热,升高温度,平衡正向移动,生成物浓度增大、平均相对分子质量减小;增大压强,平衡逆向移动,生成物浓度减小,平均相对分子质量增大,全部符合上述图象,故选B;
C.4NH3(g)+5O2(g) 4NO(g)+6H2O(g)正反应放热,升高温度,平衡逆向移动,生成物浓度减小,与图1、2不符,故不选C;
D.H2(g)+ CO(g) C(s)+H2O(g),反应前后气体系数和相同,增大压强平衡不移动,与图1、3、4不符,故不选D;
选B。
14.A
【详解】A.由反应Ni(s)+4CO(g)Ni(CO)4(g)正反应是一个熵减的自发反应,故可判断Ni(s)+4CO(g)Ni(CO)4(g)是放热反应,所以升高温度,该反应的平衡常数减小,A正确;
B.该反应达到平衡时,正逆反应速率相等,4v生成[Ni(CO)4]=v生成(CO),B错误;
C.Ni(CO)4的沸点为42.2℃,将粗镍与CO反应转化成气态Ni(CO)4,选择反应温度应选50℃,C错误;
D.Ni(s)+4CO(g)Ni(CO)4(g)的平衡常数K==2×10-5,第二阶段反应为Ni(CO)4(g)Ni(s)+4CO(g),该反应的平衡常数K===5×104,故Ni(CO)4分解率较高,D错误;
故答案为:A。
15.B
【详解】A.由图可知,两个实验只有KSCN的浓度不同,即可研究浓度对化学平衡的影响,A项正确;
B.由装置可知,用乙醇制取乙烯,浓硫酸做催化剂,浓硫酸具有脱水性和强氧化性,所以制得的乙烯中混有二氧化碳、二氧化硫和水蒸气等杂质,二氧化硫具有还原性,也能使溴水褪色,所以不能用溴水检验乙烯,B项错误;
C.用盐酸溶液滴定氢氧化钠溶液,左手旋转活塞,右手拿锥形瓶,C项正确;
D.溴苯中的苯互溶,要除去溴苯中的苯可利用蒸馏的方法分离,D项正确;
答案选B。
16.B
【详解】根据图知,随着反应的进行,X的物质的量增大、Y的物质的量减少,反应达到平衡状态时,X、Y的物质的量变化量分别为△n(X)=(0.6−0)mol=0.6mol,△n(Y)=(1.2−0.3)mol=0.9mol,X、Y的物质的量变化量之比等于其计量数之比=0.6mol:0.9mol=2:3,则X是NH3、Y是H2。
A. 可逆反应达到平衡状态时正逆反应速率相等,没有达到平衡状态时正逆反应速率不等,根据图知,t1min时,NH3和H2的物质的量仍然在变化,没有保持不变,则该反应没有达到平衡状态,所以正逆反应速率不等,A项错误;
B. 根据以上分析知,X曲线表示NH3的物质的量随时间变化的关系,B项正确;
C. 0∼8min,H2的平均反应速率为,C项错误;
D. 10∼12min,NH3的平均反应速,,再根据同一可逆反应中同一时间段内各物质的反应速率之比等于其计量数之比计算氮气反应速率为0.0025mol⋅L−1⋅min−1,D项错误;
答案选B。
【点睛】本题A项是学生们的易错点,学生们错误认为两曲线相交就达到了平衡状态,实际上是没有真正理解t1时曲线相交的含义仅是X和Y的物质的量相同,不能表示平衡状态,平衡状态时应是各物质的量保持不变,不一定相等,比如该题中第7min—10min物质的量保持不变,反应处于平衡状态,第10min时改变条件使反应正向移动,第12min时再次达到平衡状态,物质的量保持不变。
17.D
【分析】由图可知,c点氨气的体积百分数最大,说明反应达到平衡,则c点以前为平衡的形成过程,c点以后为平衡的移动过程。
【详解】A.由分析可知,c点以前均未达到平衡,故A错误;
B.温度越高,反应速率越快,由于a点温度小于b点,且a点c(NH3)低于b点,故a点的逆反应速率比b点的小,故B错误;
C.由分析可知,b点反应未达到平衡,正反应速率大于逆反应速率,故C错误;
D.该反应为放热反应,升高温度,平衡向逆反应方向移动,平衡常数减小,则c点平衡常数大于d点,故D正确;
故选D。
相关试卷
这是一份河南高考化学三年(2021-2023)模拟题汇编-17化学反应速率与化学平衡(2),共34页。试卷主要包含了单选题,原理综合题,工业流程题等内容,欢迎下载使用。
这是一份安徽省高考化学三年(2021-2023)模拟题汇编-17化学反应速率与化学平衡(2),共39页。试卷主要包含了单选题,原理综合题,工业流程题等内容,欢迎下载使用。
这是一份重庆市高考化学三年(2021-2023)模拟题汇编-17化学反应速率与化学平衡(3),共27页。试卷主要包含了单选题,原理综合题,工业流程题等内容,欢迎下载使用。












