







- 《水的电离和溶液的PH》第一课时课件PPT+教学设计 课件 27 次下载
- 《水的电离和溶液的PH》第二课时课件+教学设计 课件 21 次下载
- 《盐类的水解》第一课时课件PPT+教学设计 课件 29 次下载
- 《盐类的水解》第二课时课件PPT+教学设计 课件 20 次下载
- 《盐类的水解》第三课时课件PPT+教学设计 课件 22 次下载
初中化学沪教版 (上海)九年级第一学期第三单元 走进溶液世界3.2 溶液教学课件ppt
展开(人教版高中化学选择性必修1)
《水的电离和溶液的PH 》第三课时 教学设计
课题名 | 《水的电离和溶液的PH 》第三课时 |
教材分析 | 本节课是讲解高中阶段重要的实验:酸碱中和滴定。有关酸碱中和滴定的原理、步骤、数据处理、误差分析,都是重点讲解的内容。在高考中会联合氧化还原滴定,沉淀滴定等综合性的大题考察学生信息迁移的能力。 |
教学目标 | 宏观辨识与微观探析:理解酸碱中和的原理,学会酸碱中和滴定的操作。 证据推理与模型认知:理解酸碱中和滴定误差分析,学会酸碱中和的有关计算。 科学探究与创新意识:通过实验进一步掌握数据分析的方法,体会定量实验在化学研究中的作用。 |
教学重点 | 酸碱中和滴定的操作和误差分析,有关酸碱中和的计算。 |
教学难点 | 酸碱中和滴定的操作和误差分析,有关酸碱中和的计算。 |
教学方法 | 讲解、实验法 |
教学准备 | 教师准备:PPT、实验 学生准备:预习课本 |
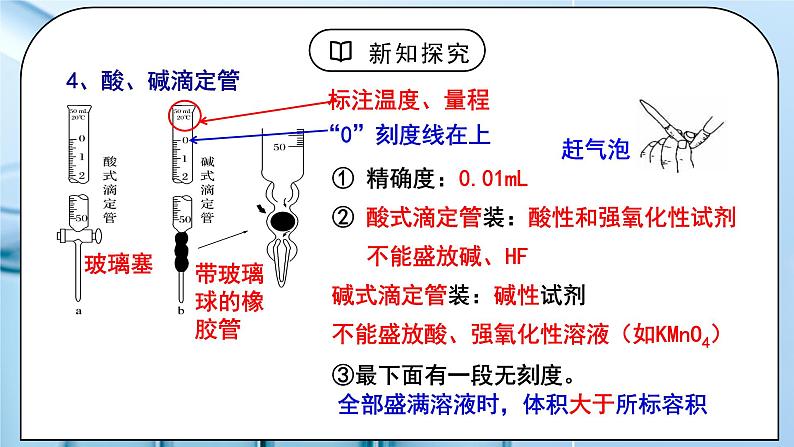
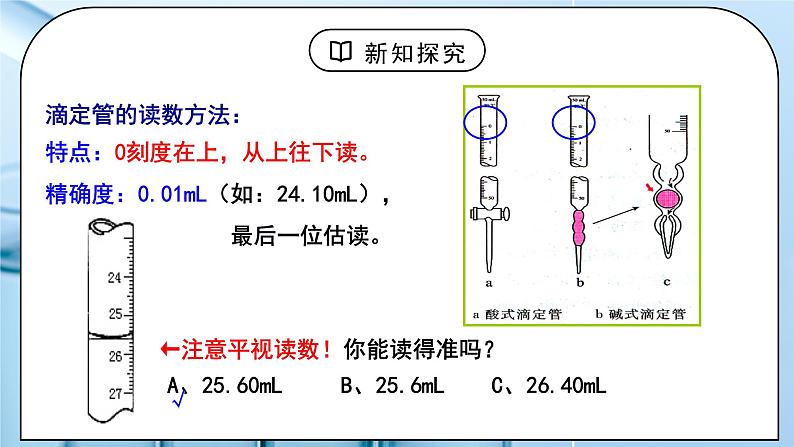
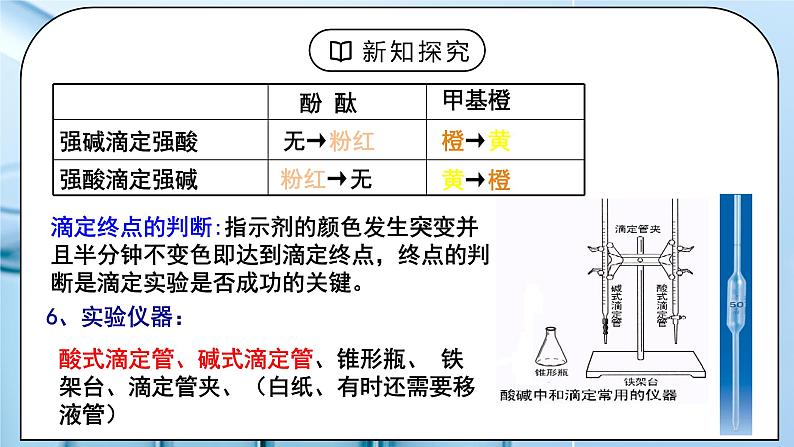
教学过程 | 一、新课导入 1.【思考】有一瓶未知浓度的NaOH溶液,如何准确测出其浓度? 教师:一、酸碱中和滴定 1.定义: 依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸)的方法。 2、原理:当酸碱完全中和时, 即n(H+)=n(OH-) c酸V酸=c碱V碱 (一元酸和一元碱) 学生:思考如何准确测出一瓶未知浓度的NaOH溶液的浓度,依据是什么。 [设计意图]引导学生回忆酸碱中和反应的原理,思考如何准确测出一瓶未知浓度的NaOH溶液的浓度。 二、探究新知 1.一、酸碱中和滴定 教师:3、实验的关键: (1)准确测量V酸 、V碱溶液的体积 (2)准确判断中和反应是否恰好完全反应 4、酸、碱滴定管 ① 精确度:0.01mL ② 酸式滴定管装:酸性和强氧化性试剂,不能盛放碱、HF 碱式滴定管装:碱性试剂,不能盛放酸、强氧化性溶液(如KMnO4) ③最下面有一段无刻度。 全部盛满溶液时,体积大于所标容积 滴定管的读数方法: 特点:0刻度在上,从上往下读。 精确度:0.01mL(如:24.10mL), 最后一位估读。 注意平视读数!你能读得准吗? A、25.60mL B、25.6mL C、26.40mL 使用方法: ①查漏: 使用前先检查滴定管活塞是否漏水 ②洗涤:先用自来水冲洗→再用蒸馏水清洗2~3次 ③润洗: 使用前,先用蒸馏水洗涤,再用待装液润洗2~3遍 ④装液: 将待装液加入相应滴定管中,使凹液面位于“0”刻度线以上2~3cm ⑤赶气泡:使滴定管的尖嘴部分充满溶液且无气泡 酸式滴定管:快速放液 碱式滴定管:橡皮管向上翘起 ⑥调节液面: 使滴定管尖嘴部分充满溶液,并使液面处于“0”刻度或以下某刻度,读数并记录。 5、指示剂的选择原则: ⑴滴定终点时颜色变化要明显,指示剂变色范围要窄(不用石蕊) ⑵指示剂变色范围尽量接近终点时溶液的pH ① 强酸——强碱:选酚酞或甲基橙都可以 ② 强酸——弱碱:滴定终点为酸性,选甲基橙 ③ 弱酸——强碱:滴定终点为碱性,选酚酞 石蕊因没有明显的单一颜色变换,通常不用作指示剂 滴定终点的判断:指示剂的颜色发生突变并且半分钟不变色即达到滴定终点,终点的判断是滴定实验是否成功的关键。 6、实验仪器: 酸式滴定管、碱式滴定管、锥形瓶、 铁架台、滴定管夹、(白纸、有时还需要移液管) 7、实验操作:用0.1000mol/L盐酸标准液测定未知浓度NaOH溶液。 ⑴滴定前准备: ①查漏→②洗涤→③润洗→④装液→⑤赶气泡→⑥调液→⑦取待测液:从碱式滴定管中放出20mL的NaOH溶液于锥形瓶中,并滴2~3滴指示剂(甲基橙或酚酞)。 锥形瓶用水洗干净即可,不能用待测液润洗 标准液润洗酸式滴定管,待测液润洗碱式滴定管或移液管 (2)滴定:左手控制酸式滴定管活塞,右手旋摇锥形瓶, 眼睛注视锥形瓶内溶液颜色变化 (滴定先快后慢,接近终点时,应一滴一摇动) 滴定终点的判断:滴入最后一滴盐酸,溶液恰好由红色变为无色,且半分钟内不变色 (3)读数 (4)复滴:重复上述操作2-3次 (5)数据处理 特别提醒:中和滴定终点是指示剂颜色发生突变的点,但不一定是酸碱恰好中和的点。通常有一定误差(允许误差)。 数据处理:若用浓度为0.1000mol/L的NaOH标准溶液滴定未知浓度的HCl溶液,滴定结果如下表: =0.10×20÷25=0.0800mol/L 8、酸碱中和滴定误差分析 在实际操作中认为C标是已知的,V待是固定的,一切的误差都归结为对V标的影响。c待测的大小取决于V标准的大小。 以已知浓度(标准)盐酸滴定未知浓度的氢氧化钠溶液。 二、中和滴定曲线 PH的计算方法: 当滴入NaOH溶液 19.96mL时(比化学计量点NaOH溶液少1滴): c(H+)=(20.00mL-19.96mL)×0.1000mol/L÷(20.00mL+19.96mL) =1.000×10-4mol/L, pH=-lg(1.000×10-4)=4.0 化学计量点时:溶液呈中性,c(H+)=1.000×10-7mol/L, pH=7.0。 化学计量点后: NaOH过量 当滴入NaOH溶液20.04mL时(比化学计量点NaOH溶液多1滴): c(OH-)=(20.04mL-20.00mL)×0.1000mol/L÷(20.04mL+20.00mL) =1.000×10-4mol/L, pOH=-lg(1.000×10-4)=4.0, pH=14.0-4.0=10.0。 原理:在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。 学生:思考:跟完全反应所需NaOH溶液相差一滴(或多加一滴),对计算盐酸的浓度有没有影响?(通过计算说明。) [设计意图]详细讲解酸碱中和滴定的实验操作,数据处理和误差分析,让学生理解酸碱中和的原理,学会酸碱中和滴定的操作。 |
板书设计 | 一、酸碱中和滴定 1.定义: 2、原理:c酸V酸=c碱V碱 (一元酸和一元碱) 3、实验的关键: 4、酸、碱滴定管 5、指示剂的选择原则: 6、实验仪器: 7、实验操作: ①准备:查漏→洗涤(水洗→润洗滴定管)→ 装标准NaOH溶液和待测溶液HCl →赶气泡→调整液面 →量待测液HCl于锥形瓶中 ②滴定:锥形瓶中加指示剂→滴定(左手、右手、眼睛)→平视读数 → 重复2-3次 ③数据处理: c(H+) · V酸 = c(OH-) · V碱 8、酸碱中和滴定误差分析 二、中和滴定曲线 |
课后作业 |
练习册上相关习题 |
教学反思 | 亮点:本节课详细讲解了酸碱中和滴定的原理、步骤、数据处理、误差分析,绘制了酸碱滴定曲线。 课堂教学建议:本节课是讲解实验,教师可以在实验室上课,让学生实际操作,可以更好地领会酸碱中和滴定实验的要点。 |
初中化学人教版(2024)九年级下册实验活动7 溶液酸碱性的检验教学演示ppt课件: 这是一份初中化学人教版(2024)九年级下册<a href="/hx/tb_c76885_t3/?tag_id=26" target="_blank">实验活动7 溶液酸碱性的检验教学演示ppt课件</a>,共27页。PPT课件主要包含了学习目标,新课引入,新知学习,课堂小结,溶液的酸碱度,pH计,pH试纸,标准比色卡,在常温25℃,pH试纸的使用方法等内容,欢迎下载使用。
沪教版 (上海)九年级第一学期3.2 溶液教学课件ppt: 这是一份沪教版 (上海)九年级第一学期3.2 溶液教学课件ppt,文件包含《水的电离和溶液的PH》第二课时课件pptx、《水的电离和溶液的PH》第二课时教学设计docx等2份课件配套教学资源,其中PPT共21页, 欢迎下载使用。
2023年中考化学总复习课件---水和溶液: 这是一份2023年中考化学总复习课件---水和溶液,共60页。PPT课件主要包含了含有较多,不含或含有较少,肥皂水,浮渣多,产生泡沫,浮渣少,带火星的木条复燃,淡蓝色火焰,正极产生了氧气,负极产生了氢气等内容,欢迎下载使用。














