



高中化学苏教版 (2019)选择性必修2第四单元 分子间作用力 分子晶体精品ppt课件
展开了解范德华力的广泛存在及对物质性质(如熔点、沸点)的影响。了解氢键的形成条件、类型和特点。列举含有氢键的物质,知道氢键对物质性质(熔点、沸点、溶解度)的影响。3. 了解分子晶体的结构与性质。4. 了解氢键对物质物理性质的影响。
一、范德华力: 是分子间普遍存在的,使许多物质聚集在一起且能以一定的凝聚态(固态,液态)存在的一种相互作用力。
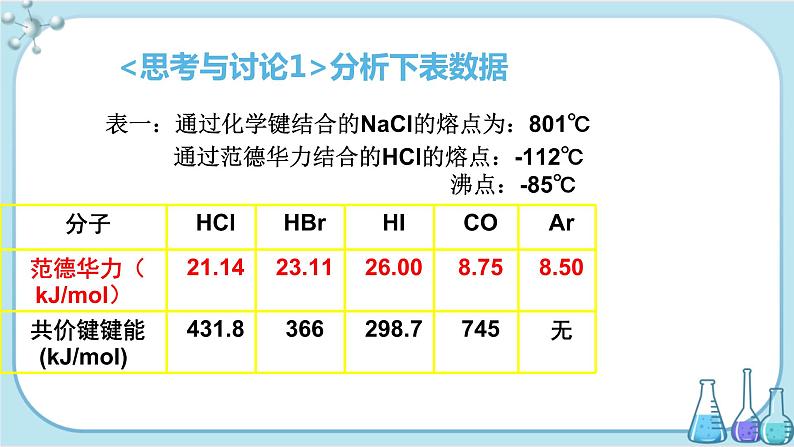
表一:通过化学键结合的NaCl的熔点为:801℃
通过范德华力结合的HCl的熔点:-112℃ 沸点:-85℃
<思考与讨论1>分析下表数据
(一)、范德华力及其影响因素
1、范德华力:分子之间的相互作用力,很弱. 比化学键小得很多, 化学键一般为100-600kJ/ml, 范德华力一般为2-20kJ/ml;只能在很小的范围内存在。不属于化学键。
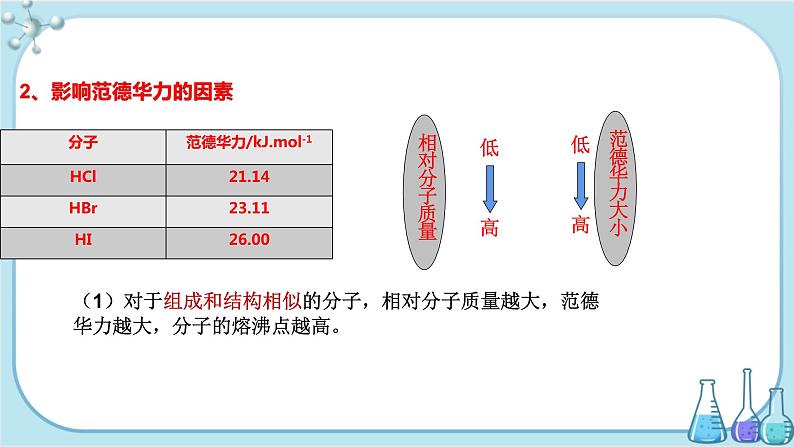
2、影响范德华力的因素
(1)对于组成和结构相似的分子,相对分子质量越大,范德华力越大,分子的熔沸点越高。
2.范德华力的影响因素
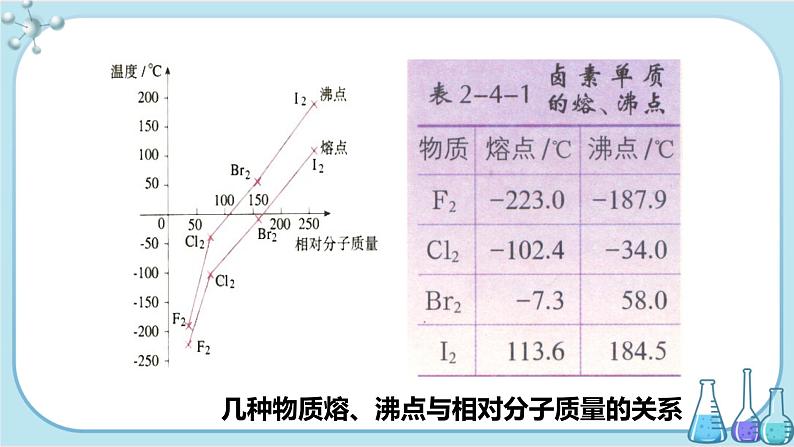
几种物质熔、沸点与相对分子质量的关系
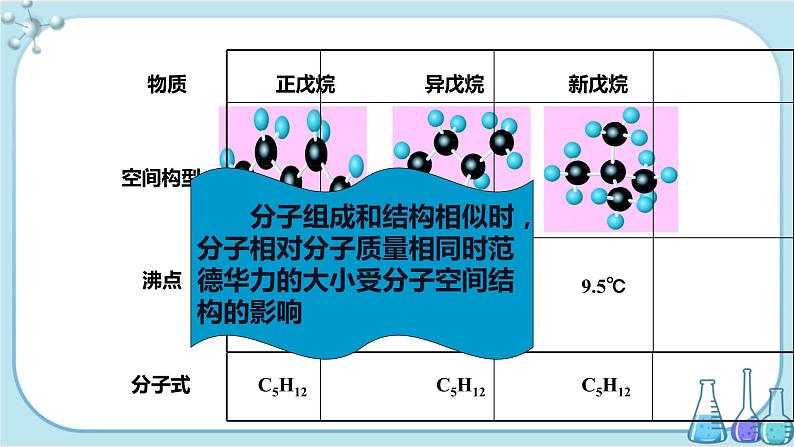
分子组成和结构相似时,分子相对分子质量相同时范德华力的大小受分子空间结构的影响
⑵相对分子质量相同或相近时,分子结构越不对称,分子的极性越大,范德华力就越大,熔沸点越高。
范德华力的大小对由分子构成的物质的物理性质有重要的影响,如熔点、沸点、溶解度等。
3、范德华力对分子构成的物质性质的影响
⑴、分子构成的物质,组成和结构相似,其相对分子质量越大,则范德华力越大,物质的熔沸点越高;相对分子质量相近,分子结构越不对称,分子极性越大,物质的熔沸点越高。
⑵、若溶质分子能与溶剂分子形成较强的范德华力,则溶质在该溶剂中的溶解度较大
(1)将干冰气化,破坏了CO2分子晶 体的 。
(2)将CO2气体溶于水,破坏了CO2 分子 。
(3)解释CCl4(液体)CH4及CF4是气体, CI4是固体的原因。
它们均是正四面体结构,它们的分子间作用力随相对分子质量增大而增大,相对分子质量越大,分子间作用力越大。
分子间作用力大小: CI4> CCl4 >CF4 >CH4
范德华力及其对物质性质的影响
1、范德华力:把分子聚集在一起的作用力。
范德华力很弱,约比化学键能小1-2数量级
(2) 范德华力与相对分子质量的关系
结构相似,相对分子质量越大,范德华力越大
(3)范德华力与分子的极性的关系
相对分子质量相同或相近时,分子的极性越大,范德华力越大
(4)范德华力对物质熔沸点的影响
结构相似的分子,相对分子质量越大,范德华力越大,分子的熔沸点越高。
分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
分子间作用力主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
非金属元素的氢化物在固态时是分子晶体,其熔沸点与其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF、H2O、NH3却出现反常,为什么?
说明在HF、H2O、NH3分子间还存在除分子间作力之外的其他作用.这种作用就是氢键.
氢键是一种特殊的分子间作用力,它是由已经与电负性很强的原子(N、O、F)形成共价键的氢原子与另一分子中电负性很强的原子之间的作用力.
二、氢键及其对物质性质的影响
是一种静电作用,是除范德华力之外的另一种分子间作用力.
注意:只有分子充分接近时,氢键作用才明显,如固体和液体中;而气体中往往忽略
(1)分子中含有半径小、电负性大、带孤电子对的非金属原子(N、O、F)。
(2)分子中必须有一个与N(O或F)直接相连的H原子 。
(1)饱和性:一个X—H只能和一个Y原子结合;(2)方向性:X—H…Y尽可能在一条直线上
(1)氢键键能大小范围
不属于化学键,但也有键长、键能。氢键键能大小介于化学键与范德华力之间,一般不超过40kJ/ml
如F原子得电子能力最强,因而F-H…F是最强的氢键; 原子吸引电子能力不同,所以氢键强弱变化顺序为:
F-H…F > O-H…O > O-H…N > N-H…NC原子吸引电子能力较弱,一般不形成氢键。
与X和Y原子的电负性及半径大小有关, 电负性大,半径小,则氢键强。
(不属于分子间作用力)
某些物质在分子内也可形成氢键,例如当苯酚在邻位上有—CHO、—COOH、—OH和—NO2时,可形成分子内的氢键,组成“螯合环”的特殊结构.
氢键普遍存在于已经与N、O、F形成共价键的氢原子与另外的N、O、F原子之间。 如:HF、H2O、NH3 相互之间 C2H5OH、CH3COOH、H2O相互之间
(2)分子内氢键:
例如 (1)分子间氢键:
2、氢键对物质性质的影响
氢键对物质熔沸点影响:
分子间氢键使物质熔沸点升高分子内氢键使物质熔沸点降低
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,如:NH3 极易溶于水,甲醇、乙醇、甘油、乙酸等能与水混溶,就是因为它们与水形成了分子间氢键的缘故。 而当溶质分子形成分子内氢键时使溶质溶解度减小。
氢键对物质溶解度的影响:
三、分子晶体 1.分子晶体的定义分子间通过分子间作用力结合形成的晶体称为分子晶体。非金属单质、非金属的氧化物和氢化物等无机物以及有机化合物形成的晶体,大都属于分子晶体。2.分子晶体的物理性质(1)分子晶体在熔化时,破坏的只是分子间作用力,所以只需要外界提供较少的能量。因此,分子晶体的熔点通常较低,硬度也较小,有较强的挥发性。(2)对组成和结构相似,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力增强,熔、沸点升高。
3.常见分子晶体的结构(1)碘晶体如下图所示,碘晶体的晶胞是一个长方体,在它的每个顶点上有1个I2分子,每个面上有1个I2分子,每个晶胞从碘晶体中分享到4个I2分子。 (2)干冰晶体如上图所示,干冰晶体是一种面心立方结构,在它的每个顶点和面心上各有1个CO2分子,每个晶胞中有4个CO2分子。干冰晶体中每个CO2分子周围,离该分子最近且距离相等的CO2分子有12个。
(3) 冰晶体如下图所示,冰晶体主要是水分子依靠氢键而形成的。由于氢键具有一定的方向性,中央的水分子与周围四个水分子结合,边缘的四个水分子也按照同样的规律再与其他水分子结合,每个氧原子周围都有四个氢原子。这种排列类似于蜂巢结构,比较松散,因此水由液态变成固态时,密度变小。
例1 氯化硼的熔点为-107 ℃,沸点为12.5 ℃,在其分子中键与键之间的夹角为120°,它能水解。有关叙述正确的是( )A.氯化硼晶体是分子晶体B.氯化硼液态时能导电而固态时不能导电 C.氯化硼分子的中心原子采取sp3杂化D.氯化硼分子属于极性分子,分子空间结构为三角锥形
解析:A对,BCl3的熔点、沸点均较低,说明BCl3晶体是分子晶体。B错,BCl3晶体是分子晶体,在固态和熔融态时均不能发生电离,故均不能导电。C错,BCl3分子中B原子的价电子对数为3+ ×(3-3×1)=3,B原子采取sp2杂化。D错,BCl3分子为平面三角形,正、负电荷中心重合,则BCl3为非极性分子。
例2 已知干冰晶胞属于面心立方晶胞(如图),晶胞中最近的两个相邻CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是( )A.晶胞中一个CO2分子的配位数是8B.晶胞的密度表达式是 g·cm-3C.一个晶胞中平均含6个CO2分子D. CO2分子的空间结构是直线形,中心C原子的杂化类型是sp3杂化
解析:A错,以顶角CO2分子为研究对象,可得晶胞中一个CO2分子的配位数为12。B对,该晶胞中最近的两个相邻CO2分子间距为a pm,即晶胞面心上的CO2分子和其同一面上顶角的CO2之间的距离为a pm,则晶胞棱长= a pm= a×10-10 cm,晶胞体积=( a×10-10 cm)3,该晶胞中CO2分子个数=8× +6× =4,晶胞密度= = g·cm-3= g·cm-3。C错,该晶胞中二氧化碳的分子个数=8× +6× =4。D错,CO2分子中C原子采取sp杂化。
高中化学苏教版 (2019)选择性必修2第四单元 分子间作用力 分子晶体课堂教学ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2第四单元 分子间作用力 分子晶体课堂教学ppt课件,共32页。PPT课件主要包含了内容索引,自主预习新知导学,合作探究释疑解惑,课堂小结,素养阐释,范德华力,问题引领,归纳提升,典型例题等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第四单元 分子间作用力 分子晶体说课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2专题3 微粒间作用力与物质性质第四单元 分子间作用力 分子晶体说课ppt课件,共17页。
苏教版 (2019)第四单元 分子间作用力 分子晶体备课课件ppt: 这是一份苏教版 (2019)第四单元 分子间作用力 分子晶体备课课件ppt,共20页。PPT课件主要包含了依据导电性判断,分子晶体,晶胞计算,晶体密度的计算,1解题程序,面心立方堆积,体心立方堆积等内容,欢迎下载使用。













