






2024届高三化学高考备考一轮复习:化学平衡移动 工业合成氨课件
展开1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,能用相关理论解释其一般规律。 2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
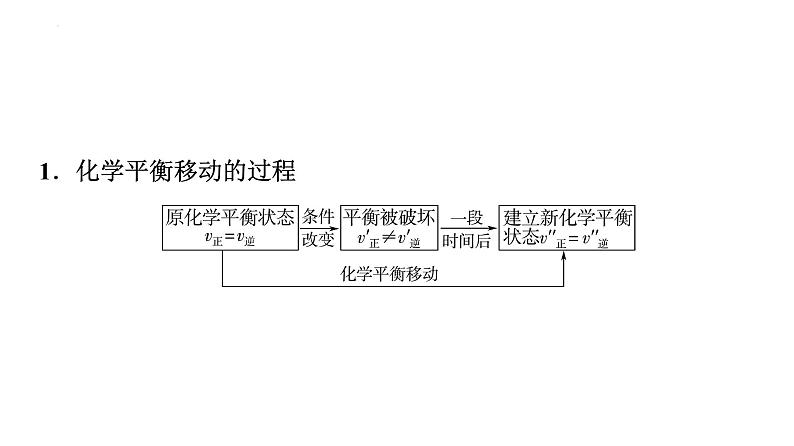
1.化学平衡移动的过程
2.化学平衡移动与化学反应速率的关系(1)v正>v逆:平衡向_______________移动。(2)v正=v逆:反应达到平衡状态,_________平衡移动。(3)v正
①改变压强,对于反应前后气体体积不变的反应,平衡不移动,v正、v逆同倍数改变。②平衡混合物中都是固体或液体时,改变压强,平衡不移动。③恒温恒容条件通“惰性气体”,各组分浓度不变,v正、v逆不变,平衡不移动;恒温恒压通“惰性气体”,各组分浓度同倍数减小(相当于减压),平衡向气体体积增大的方向移动。
(3)温度对平衡的影响其他条件不变时,升高温度,平衡向______方向移动;降低温度,平衡向______方向移动。
①任何可逆反应均有能量变化,改变温度一定发生平衡移动。②催化剂能改变正、逆反应的活化能,同倍数改变v正、v逆,对平衡移动无影响,只能改变到达平衡的时间。
①勒·夏特列原理适用于判断平衡移动方向,不适用于改变条件平衡不发生移动的情况。②化学平衡移动的目的是“减弱”外界条件的改变,而不是“抵消”外界条件的改变。
5.影响化学平衡移动因素的v-t图像分析
A B C D
(1)加催化剂对反应速率影响的图像是___(填字母,下同),平衡___移动。(2)升高温度对反应速率影响的图像是___,平衡向_________方向移动。(3)增大反应容器体积对反应速率影响的图像是___,平衡向_________方向移动。(4)增大O2的浓度对反应速率影响的图像是___,平衡向_________方向移动。
1.判断正误(正确的打“√”,错误的打“×”)(1)改变条件,v正、v逆均变化时平衡一定移动。( )(2)在密闭容器加入任一反应物,平衡一定移动。( )(3)升高温度,平衡向正反应方向移动,v正增大,v逆减小。( )(4)平衡向正反应方向移动,生成的浓度一定增大。( )(5)平衡向正反应方向移动,反应物的转化率一定增大。( )[答案] (1)× (2)× (3)× (4)× (5)×
[答案] ①不移动 不变 不变 ②正向 v正增大,v逆逐渐增大 减小 ③逆向 均增大 减小 ④不移动 均增大 不变 ⑤不移动 不变 不变
化学平衡移动与转化率的判断A.通入一定量O2 B.增大容器容积C.移去部分SO3(g) D.降低体系的温度
(1)若体积不变,仅增加c(A),A的转化率将______(填“增大”“减小”或“不变”,下同),B的转化率将________,达到新平衡时,c(A)将________,c(C)将________。
(2)体积不变,再充入a ml A和b ml B,则平衡______移动,达到新平衡时,c(A)将________,c(C)将________。①若a+b=c+d,则A的转化率将________;②若a+b>c+d,则A的转化率将________;③若a+b
根据平衡移动比较平衡状态
图1 恒压状态 图2 恒容状态请回答:(填>、<或=)(1)图1达平衡,α(SO2):甲________乙,K:K甲________K乙。(2)图2达平衡,α(SO2):丙________丁,c(SO2):丙________丁。(3)甲、丙达平衡,α(SO2):甲________丙,SO2体积分数:甲________丙。
[答案] (1)> > (2)> < (3)> <
(1)构建恒温恒容平衡思维模式新平衡状态可认为是两个原平衡状态简单的叠加并压缩而成,相当于增大压强。
(2)构建恒温恒压平衡思维模式(以气体物质的量增加的反应为例,见图示)新平衡状态可以认为是两个原平衡状态简单的叠加,压强不变,平衡不移动。
1.工业合成氨的条件控制(2)根据反应特点可选择的条件①增大合成氨反应速率的措施有:____________、____________、______________________和_______________。②提高平衡混合气中NH3含量的措施有:__________、__________和______________________。
(3)反应条件的控制①压强:10~30 MPa。压强越大,转化率越大,但对___________的要求高,需要的______也越大。②温度:400~500 ℃。温度要适宜,既要保证反应有较快的速率,又要使反应物的转化率不能太低,并且该反应的催化剂在该温度下______最大。
③催化剂:使用催化剂可提高反应的速率。④浓度:迅速冷却使_________液化,降低c(NH3),平衡向___移动。⑤循环操作:将分离出NH3的原料气循环使用,提高原料的利用率。
2.化学反应调控的一般原则
(1)铜氨液吸收CO适宜的生产条件是________。(2)吸收CO后的铜氨液经过适当处理又可再生,恢复其吸收CO的能力,可供循环使用。铜氨液再生适宜的生产条件是________。[答案] (1)低温、高压 (2)高温、低压
[答案] < 在1.3×104 kPa下,CO的转化率较高,再增大压强CO转化率提高不大,同时生产成本增加,得不偿失
3.“丁烯裂解法”是一种重要的丙烯生产法,在生产过程中会有生成乙烯的副反应发生。反应如下:
测得上述两反应的平衡体系中,各组分的质量分数(w)随温度(T)和压强(p)变化的趋势分别如图甲和图乙所示:
甲 乙
(1)平衡体系中的C3H6(g)和C2H4(g)的质量比是工业生产C3H6(g)时选择反应条件的重要依据之一,从产物的纯度考虑,该数值越高越好,据图甲和图乙判断,反应条件应选择________(填序号)。 A.300 ℃、0.1 MPa B.700 ℃、0.1 MPaC.300 ℃、0.5 MPa D.700 ℃、0.5 MPa(2)有研究者结合图甲数据并综合考虑各种因素,认为450 ℃的反应温度比300 ℃或700 ℃更合适,从反应原理角度分析其理由可能是________________________________________________________。
2024届高三化学一轮复习课件:化学平衡移动: 这是一份2024届高三化学一轮复习课件:化学平衡移动,共3页。PPT课件主要包含了正反应,逆反应,气体分子数目减小,气体分子数目增大,平衡不移动等内容,欢迎下载使用。
2024届高三化学高考备考一轮复习专题:化学平衡状态 化学平衡的移动课件: 这是一份2024届高三化学高考备考一轮复习专题:化学平衡状态 化学平衡的移动课件,共29页。PPT课件主要包含了正反应,逆反应,化学平衡状态,不再改变,3特征,浓度或百分含量,正反应方向,不发生,逆反应方向,勒夏特列原理等内容,欢迎下载使用。
2020版高考化学一轮复习考点备考课件7.2.2化学平衡移动 (含解析): 这是一份2020版高考化学一轮复习考点备考课件7.2.2化学平衡移动 (含解析),共8页。PPT课件主要包含了速查速测,催化剂不影响平衡,典例剖析,反思归纳,试题备选等内容,欢迎下载使用。












