







所属成套资源:新人教版化学选择性必修1课件PPT+教案全册
- 《水的电离和溶液的PH》第二课时课件+教学设计 课件 22 次下载
- 《水的电离和溶液的PH》第三课时课件+教学设计 课件 24 次下载
- 《盐类的水解》第二课时课件PPT+教学设计 课件 23 次下载
- 《盐类的水解》第三课时课件PPT+教学设计 课件 24 次下载
- 《盐类的水解》第四课时课件PPT+教学设计 课件 26 次下载
高中化学第三节 盐类的水解教学ppt课件
展开
这是一份高中化学第三节 盐类的水解教学ppt课件,文件包含《盐类的水解》第一课时课件pptx、《盐类的水解》第一课时教学设计docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
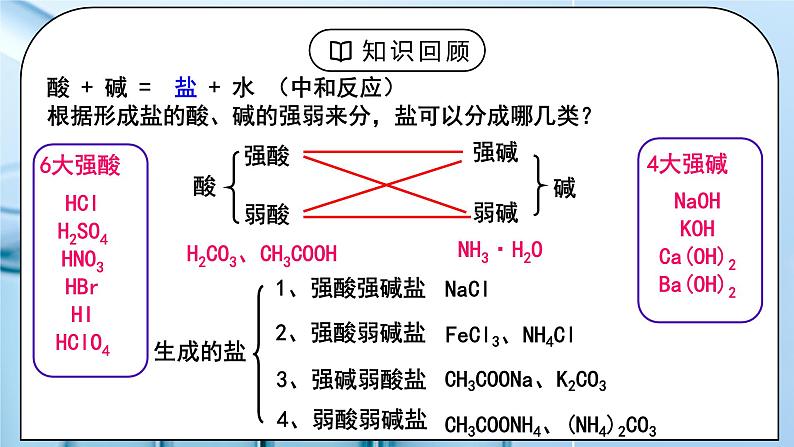
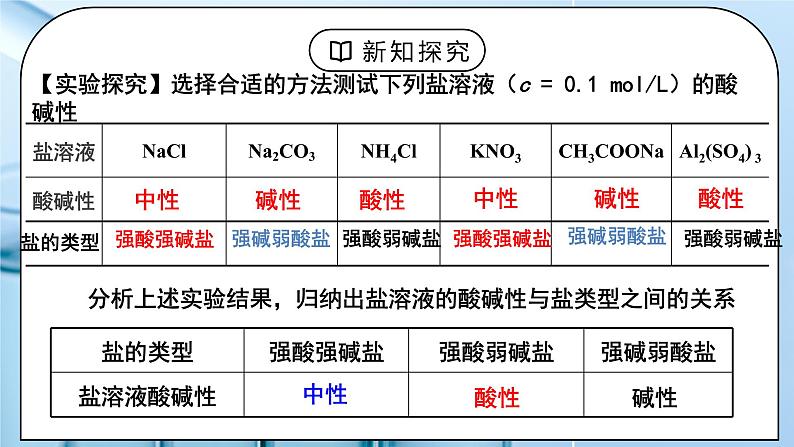
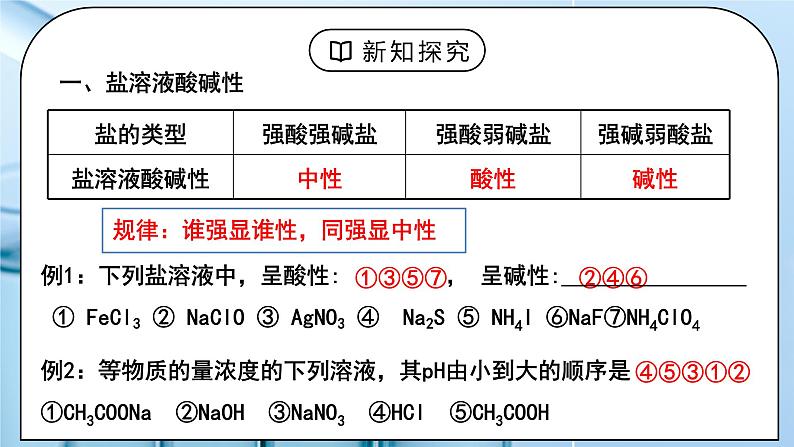
(人教版高中化学选择性必修1)《盐类的水解》第一课时 教学设计课题名《盐类的水解》第一课时教材分析本节课是有关讲解盐溶液呈现不同酸碱性的原因,需要学生理解盐类水解的本质,特点和规律。为后面的影响盐类水解的因素,盐类水解的应用打基础。在高考中盐类水解是考察的重点内容,难度较大。教学目标宏观辨识与微观探析:掌握盐溶液呈现不同酸碱性的原因,理解盐类水解的本质,特点和规律。证据推理与模型认知:掌握盐类水解的离子方程式的书写原则,会书写盐类水解的离子方程式。科学探究与创新意识:能根据盐类水解理论判断盐溶液的酸碱性。科学精神与社会责任:能根据盐类水解理论解释一些生活中的有关问题。教学重点 盐类水解的本质,特点和规律,盐类水解的离子方程式的书写。教学难点 盐类水解的本质,特点和规律。教学方法讲解,实验法教学准备教师准备:PPT、实验学生准备:预习课本教学过程一、新课导入1.思考:Na2CO3是日常生活中常用的盐,俗称纯碱,常在面点加工时用与中和酸并使食物松软或酥脆,也常用于油污的清洗等。为什么Na2CO3可以被当作“碱”使用呢?教师:酸 + 碱 = 盐 + 水 (中和反应)根据形成盐的酸、碱的强弱来分,盐可以分成哪几类?6大强酸:HCl H2SO4 HNO3 HBr HI HClO44大强碱:NaOH KOH Ca(OH)2 Ba(OH)2学生:生成的盐:强酸强碱盐、强酸弱碱盐、强碱弱酸盐、弱酸弱碱盐[设计意图]回顾酸碱中和反应的生成物盐,尝试按照酸碱强弱进行分类。二、探究新知1.一、盐溶液酸碱性教师:【实验探究】选择合适的方法测试下列盐溶液(c = 0.1 mol/L)的酸碱性分析上述实验结果,归纳出盐溶液的酸碱性与盐类型之间的关系规律:谁强显谁性,同强显中性例1:下列盐溶液中,呈酸性: ___________, 呈碱性:________。 ① FeCl3 ② NaClO ③ AgNO3 ④ Na2S ⑤ NH4I ⑥NaF⑦NH4ClO4 例2:等物质的量浓度的下列溶液,其pH由小到大的顺序是①CH3COONa ②NaOH ③NaNO3 ④HCl ⑤CH3COOH盐溶液呈现不同酸碱性的原因:纯水中:H2O H+ + OH–当分别加入NaCl、NH4Cl、CH3COONa形成溶液后,请思考:(1)相关的电离方程式?(2)盐溶液中存在哪些粒子?(3)哪些粒子间可能结合(生成弱电解质)?(4)对水的电离平衡有何影响?(5)相关的化学方程式?往水中加NaCl形成溶液:往水中加NH4Cl形成溶液: 往水中加CH3COONa形成溶液:学生:小结:[设计意图]知道盐溶液有酸碱性,并理解盐溶液呈现不同酸碱性的原因。二、盐类的水解:教师:1.定义:盐溶液中,盐电离出的弱离子与水电离的H+或OH-结合生成弱电解质(弱酸或弱碱)的反应,叫盐类的水解。2.实质: 生成弱电解质,破坏、促进水的电离。3.盐类水解的特点:可逆;吸热;一般微弱4.水解的规律:(1)有弱才水解,谁弱谁水解;(2)越弱越水解,越稀越水解;(3)谁强显谁性,同强显中性。例3:已知 Ka(HF) > Ka(CH3COOH) ,同温度下,等浓度的NaF和CH3COONa溶液,哪一个的pH大?例4:等浓度的三种盐溶液KX,KY, KZ ,若它们的PH依次为 8,9,10, 则 HX, HY, HZ的酸性由强到弱的顺序是啥?5.盐溶液酸碱性的判断①根据”谁强显谁性,同强显中性“判断②弱酸弱碱盐溶液的酸碱性:③酸式盐溶液的酸碱性:(1)强酸的酸式盐溶液显酸性,如NaHSO4,因为强酸的酸式根只电离不水解。NaHSO4 = Na+ + H+ + SO42-(2)弱酸的酸式盐酸碱性:由弱酸酸式根水解程度和电离程度的相对大小决定弱酸酸式盐溶液的酸碱性取决于其电离程度和水解程度的相对大小:若水解程度大于电离程度,则溶液呈碱性。 如:NaHCO3、NaHS、Na2HPO4溶液等。若电离程度大于水解程度,则溶液呈酸性。 如:NaHSO3、KHC2O4、NaH2PO4溶液等。6、盐类水解的离子方程式书写时方程式一般用“ ”符号;通常不用“↓”、“↑”符号,但完全双水解要用“=”,标“↑”、“↓”。① 多元弱酸根离子分步水解,水解程度第一步最大,水解方程式分步书写。② 多元弱碱盐的水解方程式一步完成③完全双水解:即弱酸阴离子与弱碱阳离子水解相互促进,水解程度较大,能反应彻底。能发生完全双水解反应的离子组合: Al3+ 与 AlO2-、CO32-、HCO3- 、 HS-、S2-、SiO32- Fe3+ 与 AlO2-、CO32-、HCO3- NH4+ 与 SiO32-、AlO2-学生:练习1、下列物质分别加入到水中,因水解而使溶液呈酸性的是( )A、硫酸 B、NaOH C、硫酸铝 D. 碳酸钠练习2、在Na2S溶液中,c (Na+) 与 c (S2–) 之比值( )于2。 A、大 B、小 C、等 D、无法确定练习3、① PH均为4的醋酸溶液和氯化铵溶液中,水电离出的OH–分别是多少? ② PH均为9的NaOH溶液和醋酸钠溶液中,水电离出的OH–分别是多少?练习4、Ka(HF) > Ka(CH3COOH) ,等PH的NaF和CH3COONa溶液中Na+的浓度哪个更大?练习5:判断以下水解方程式是否正确练习6、下列水解的离子方程式正确的( ) A.CO32-+2H2O ⇌CO2 ↑+2OH- B.I-+H2O ⇌HI+OH- C.SO32-+2H2O ⇌H2SO3+2OH- D.Fe3++3H2O ⇌Fe(OH)3+3H+ 练习7、写出水解反应的离子方程式。①NH4HCO3 ②Al2(SO4)3 ③NaF④Na2S ⑤Fe3+ 与 AlO2- ⑥Al3+ 与S2-[设计意图]理解盐类水解的定义,特点和规律,能书写盐类水解的离子方程式板书设计一、盐溶液酸碱性规律:谁强显谁性,同强显中性二、盐类的水解:1.定义:2.实质:3.盐类水解的特点:4.水解的规律:有弱才水解,谁弱谁水解;越弱越水解,越稀越水解;谁强显谁性,同强显中性。5.盐溶液酸碱性的判断6.盐类水解的离子方程式课后作业 练习册上相关习题教学反思亮点:本节课详细阐述了盐类有酸碱性的原因,通过实验和列表总结的方法帮助学生理解。课堂教学建议:本节课难度较大,教师应根据学生的学习情况采用边讲解边练习的模式进行学习。
相关课件
这是一份高中化学人教版 (2019)选择性必修1第一节 反应热优质教学ppt课件,文件包含《反应热》第一课时课件pptx、《反应热》第一课时教学设计docx等2份课件配套教学资源,其中PPT共28页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学ppt课件,文件包含《盐类的水解》第四课时课件pptx、《盐类的水解》第四课时教学设计docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第三课时课件pptx、《盐类的水解》第三课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。











