



所属成套资源:全套高中化学学业水平合格性考试复习课件
高中化学学业水平合格性考试复习第一节原子结构课件
展开
这是一份高中化学学业水平合格性考试复习第一节原子结构课件,共38页。PPT课件主要包含了答案B,2置换反应等内容,欢迎下载使用。
第一节 原子结构[备考导航]
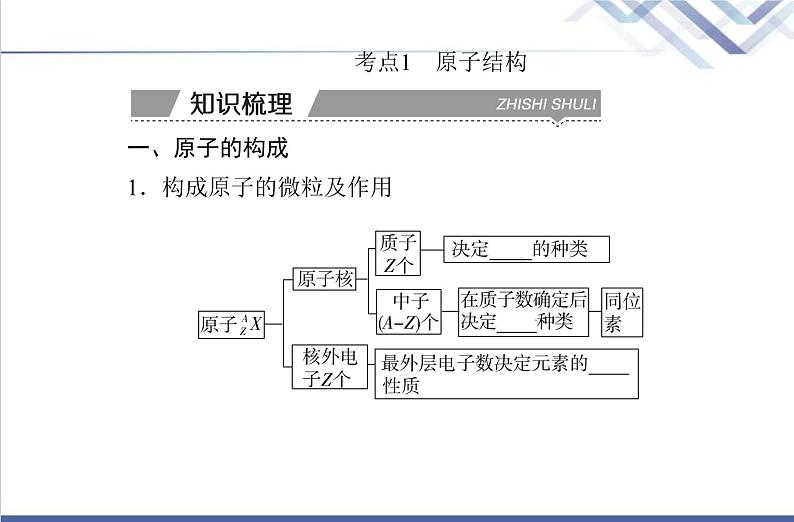
考点1 原子结构 一、原子的构成1.构成原子的微粒及作用
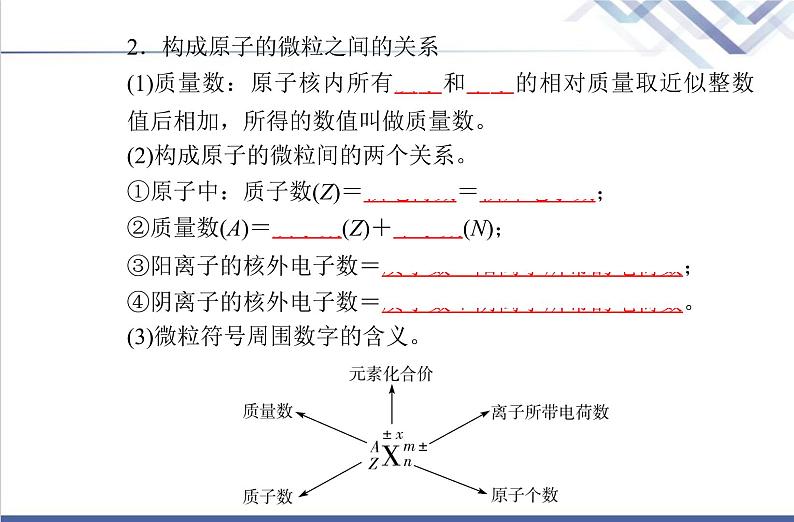
2.构成原子的微粒之间的关系(1)质量数:原子核内所有质子和中子的相对质量取近似整数值后相加,所得的数值叫做质量数。(2)构成原子的微粒间的两个关系。①原子中:质子数(Z)=核电荷数=核外电子数;②质量数(A)=质子数(Z)+中子数(N);③阳离子的核外电子数=质子数-阳离子所带的电荷数;④阴离子的核外电子数=质子数+阴离子所带的电荷数。(3)微粒符号周围数字的含义。
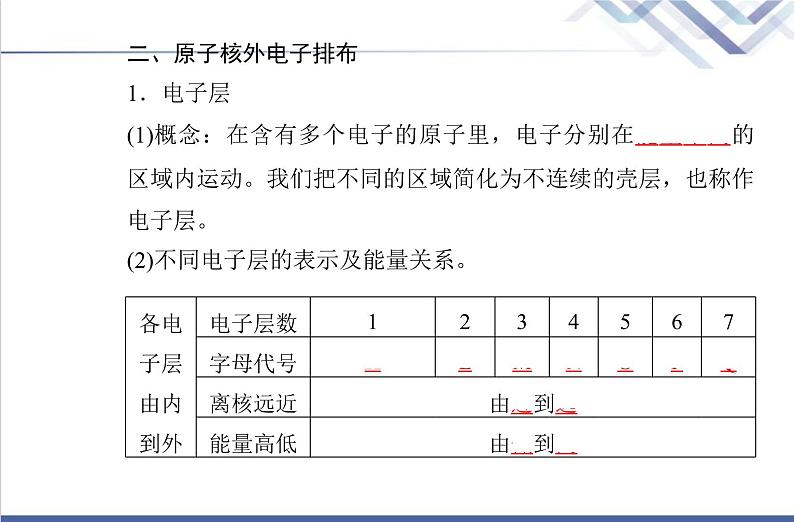
二、原子核外电子排布1.电子层(1)概念:在含有多个电子的原子里,电子分别在能量不同的区域内运动。我们把不同的区域简化为不连续的壳层,也称作电子层。(2)不同电子层的表示及能量关系。
2.原子核外电子的排布规律(1)原子核外第n层最多容纳的电子数为2n2个电子。(2)最外层不超过8个(K层为最外层时不超过2个)电子。(3)次外层不超过18个,倒数第三层不超过32个。3.核外电子排布的表示方法——原子结构示意图
(2021年1月·广东学考)磷(P)是人体必需的元素之一,P的原子结构示意图为( )
解析:每层电子排布要符合2n2个。原子核内要带“+”号。
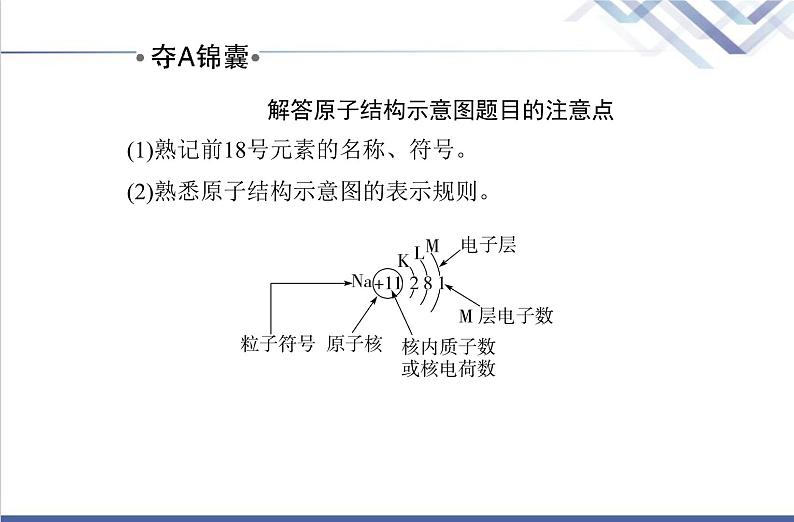
解答原子结构示意图题目的注意点(1)熟记前18号元素的名称、符号。(2)熟悉原子结构示意图的表示规则。
2.三种原子的原子结构可用下图形象地表示。下列叙述正确的是( )
A.①②③质量数相同B.①②③性质完全相同C.①②③互为同位素D.①②③分别代表H、He、Li原子
2.(2019年6月·广东学考)硫的原子结构示意图为( )
3.(2022年7月·广东学考)2021年12月科学家创造出目前最轻的镁同位素18Mg,该同位素衰变过程放射出4个质子。下列关于18Mg的说法正确的是( )A.中子数为6B.核外电子数为2C.衰变后得到16OD.1 ml 18Mg的质量为12 g
考点2 核素 同位素 一、元素1.概念:具有相同质子数(核电荷数)的一类原子的总称。2.决定元素种类的是质子数。二、核素具有一定数目质子和一定数目中子的一种原子。
三、同位素1.概念:质子数相同而中子数不同的同一元素的不同原子互称为同位素(即同一元素的不同核素互称为同位素)。“同位”是指核素的质子数相同,在元素周期表中占有相同的位置。2.氢元素的三种核素互为同位素
3.同位素的特征(1)同一种元素的各种同位素的化学性质几乎相同;物理性质略有差异。(2)在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的比率。(3)常见同位素的用途(请将同位素与用途之间连线)。
元素、核素、同位素的相互关系
2.(2018年6月·广东学考)18O常用作“示踪原子”,下列关于18O的说法正确的是( )A.中子数为8 B.核外电子数为6C.质子数为18 D.与16O互为同位素3.(2021年7月·广东学考)我国化学家通过对H+HD―→H2+D反应的研究,进一步揭示了化学反应的本质。下列关于H与D的说法不正确的是( )A.中子数均为2 B.质子数均为1C.核外电子数均为1 D.两者互为同位素
考点3 原子结构与元素的性质 一、碱金属元素1.碱金属元素的原子结构特点
(1)在周期表中的位置:第ⅠA族。(2)相似性:碱金属元素原子的最外层都有1个电子,很容易失去,因此碱金属元素的最高正价为+1价,最高价氧化物对应的水化物均为强碱(所以称为碱金属),典型的活泼金属元素。(3)递变性:随着原子序数的增加,碱金属元素原子的电子层数逐渐增多,原子半径逐渐增大。2.碱金属的物理性质(1)相似性:碱金属单质都有银白色的金属光泽(铯略带金色光泽)、硬度小、熔点较低,良好的导电性、导热性,有延展性,液态钠可用作核反应堆的传热介质。(2)递变性:在碱金属内,随着元素原子核电荷数的增加,单质的熔点和沸点逐渐降低,密度呈增大趋势(但ρNa>ρK)。
(3)碱金属化学性质的递变性。随着原子核外电子层数的增多,原子半径逐渐增大,原子核对最外层电子的引力逐渐减小,失去电子的能力逐渐增强,单质的还原性增强,元素的金属性增强,最高价氧化物对应的水化物的碱性增强。
二、卤族元素1.卤族元素的原子结构特点
(1)相似性:最外层电子数都是7,容易得到一个电子。(2)递变性:从F到I,核电荷数逐渐增大,电子层数逐渐增多,原子半径逐渐增大。
2.卤素单质的物理性质
(1)相似性:都有颜色,有毒,在水中溶解度不大,易溶有机溶剂。(2)递变性:从F2到I2,颜色逐渐加深,熔、沸点逐渐升高,密度呈增大趋势,在水中的溶解度逐渐减小。
3.卤素单质的化学性质(1)与H2反应。
往碘化钾溶液中先加入氯水,再加入CCl4振荡,静置后出现分层,下层呈( )A.橙红色 B.紫红色C.无色 D.深褐色
解析:碘化钾中加入氯水发生反应:2KI+Cl2===2KCl+I2,加入CCl4后,由于碘易溶于CCl4,CCl4层(下层)呈现紫红色。
与卤素单质相关的颜色(1)Cl2、Br2、I2在水中的溶解能力比较小,但较易溶于有机溶剂(汽油、苯、四氯化碳、酒精)中。
(2)溶液的颜色与溶液的浓稀有关:浓溶液颜色深,稀溶液颜色浅(如饱和溴水为红棕色,而很稀的溴水则为浅黄色)。
1.下列是几种粒子的结构示意图,有关说法不正确的是( )A.①和②属同种元素B.②属于稀有气体元素C.①和③的化学性质相似D.④属于金属元素
2.下列各组的比较不正确的是( )A.锂与水的反应不如钠与水的反应剧烈B.还原性:K>Na>Li,故K可以从NaCl溶液中置换出金属钠C.熔、沸点:Li>Na>KD.碱性:LiOH
相关课件
这是一份高中化学学业水平合格性考试复习第一节自然资源的开发利用课件,共36页。PPT课件主要包含了答案C,续上表,答案B,海水的综合利用,天然气,“三馏”比较等内容,欢迎下载使用。
这是一份高中化学学业水平合格性考试复习第一节物质的分类及转化课件,共35页。PPT课件主要包含了答案D,答案C,碱的主要化学性质,盐的主要化学性质,答案B等内容,欢迎下载使用。
这是一份高中化学学业水平合格性考试复习第一节铁及其化合物课件,共25页。PPT课件主要包含了答案B,续上表等内容,欢迎下载使用。









