





高中化学苏教版 (2019)选择性必修1第一单元 化学反应速率公开课课件ppt
展开1.理解外界条件(浓度、温度、压强、催化剂等)对化学反应速率的影响,认识其一般规律。2.了解催化剂在生产、生活和科学研究领域中的重大作用。3.知道活化能的含义及其对化学反应速率的影响。4.学会比较反应的快慢以及如何通过改变外界条件改变化学反应速率。
一、影响化学反应速率的因素
2.外界因素——次要因素
S2O32-+2H+=SO2↑+S↓+H2O
固体和纯液体的浓度视为常数,改变其物质的量,对反应速率无影响。
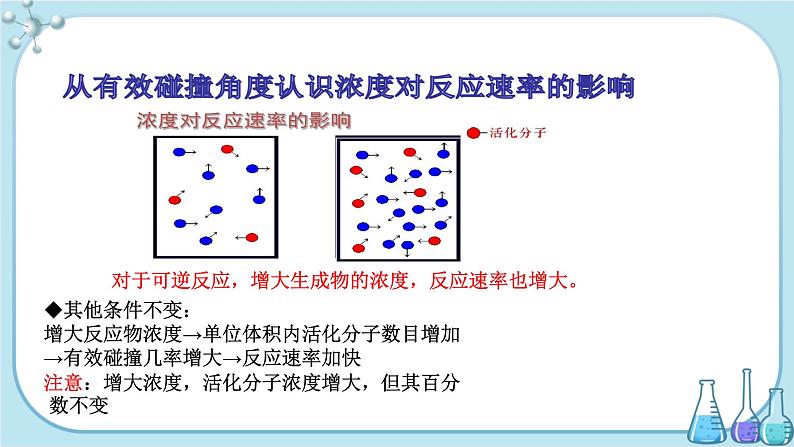
◆其他条件不变:增大反应物浓度→单位体积内活化分子数目增加→有效碰撞几率增大→反应速率加快注意:增大浓度,活化分子浓度增大,但其百分 数不变
对于可逆反应,增大生成物的浓度,反应速率也增大。
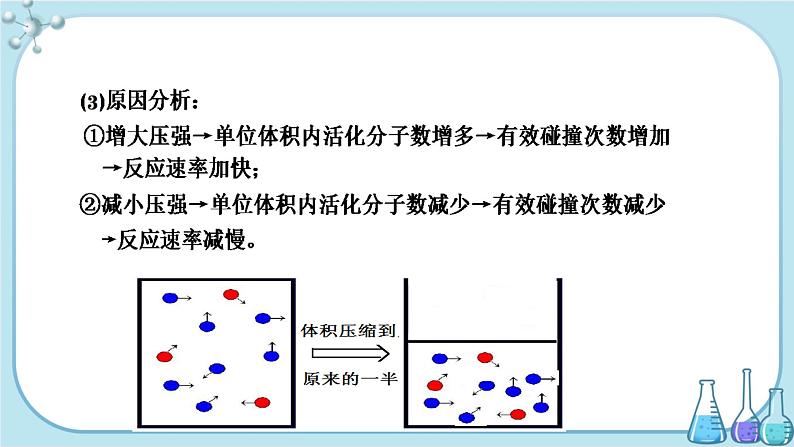
(2)对于有气体参与的化学反应,增大压强(减小容器体积)相当于增大反应物浓度,反应速率增大;减小压强(增大容器体积)相当于减小反应物浓度,反应速率减小。
对于可逆反应,增大压强正逆反应速率均增大,减小压强,正逆反应速率均减小。
对于可逆反应,升高温度正逆反应速率均增大,但增大的倍数不同;降低温度,正逆反应速率均减小,减小的倍数也不同。
有的催化剂能加快化学反应的速率,叫正催化剂;有的催化剂能减慢化学反应速率,叫负催化剂。在实践中,如没有特殊说明,凡说催化剂都是指正催化剂。催化剂只有在一定的温度下才能最大限度的显示其催化作用,不同的催化剂对温度的要求不一样。
注意:1、催化剂参加化学反应,改变反应历程,改变反应的活化能。2、对于可逆反应,催化剂同等程度的改变正逆反应速率。
使用催化剂后,反应的活化能为( )A. E1+E2 B. E1-E2C. E1 D. E2
化学选择性必修1第一单元 化学反应的热效应集体备课课件ppt: 这是一份化学选择性必修1第一单元 化学反应的热效应集体备课课件ppt,共26页。PPT课件主要包含了学习目标,二盖斯定律,三反应热的计算等内容,欢迎下载使用。
高中第一单元 化学反应速率评优课课件ppt: 这是一份高中第一单元 化学反应速率评优课课件ppt,共21页。PPT课件主要包含了∶1∶2,化学计量数之比,物质的量变化量之比,均取正直等内容,欢迎下载使用。
化学选择性必修2第一单元 分子的空间结构课文配套ppt课件: 这是一份化学选择性必修2第一单元 分子的空间结构课文配套ppt课件,共27页。PPT课件主要包含了问题探究一,Sp2杂化,C-C,sp3,sp2,C=C,C≡C,直线形,平面三角形,四面体等内容,欢迎下载使用。













