





高中第三单元 化学平衡的移动获奖ppt课件
展开1.能利用化学平衡常数和浓度商的关系判断化学平衡的移动。2.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,认识其一般规律。3.理解化学平衡移动(勒夏特列)原理的适用范围。
1.定义:在一定条件下,当可逆反应达到平衡状态后,如果改变反应条件,平衡状态被破坏,平衡体系的物质组成也会随着改变,直至达到新的平衡状态。这种由原有的平衡状态达到新的平衡状态的过程叫做化学平衡的移动。
问与答:正逆反应速率的改变和化学平衡移动方向有何联系?①改变条件的瞬间使,υ正>υ逆,平衡向正反应方向移动。②改变条件的瞬间使,υ正<υ逆,平衡向逆反应方向移动。③改变条件的瞬间使,υ正=υ逆,平衡不移动。
【例1】 在一恒容密闭容器中,反应A(g)+B(g) C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是( )A.A的浓度一定比原平衡大B.A的转化率增大C.C的百分含量一定大于原平衡C的百分含量D.B的转化率一定增大
[解析] 本题考查了勒夏特列原理的应用和平衡移动中的转化率的变化。增大A的浓度,尽管平衡右移,但加入的A不可能全部转化,平衡的移动只是一个减弱的过程。平衡时A的浓度一定比原平衡大。增大A的浓度,A的转化率降低,而同为反应物的B的转化率升高。因为A的总量在增大。同理C的百分含量也不一定增大。[答案] AD
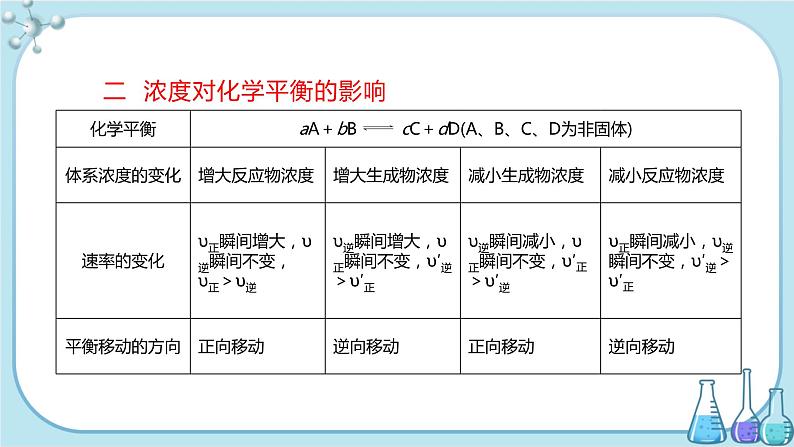
二 浓度对化学平衡的影响
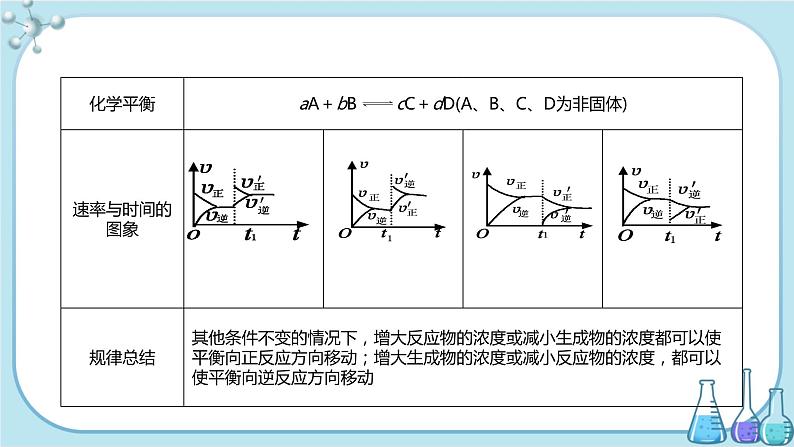
说明:①增加固体或纯液体的量,由于浓度不变,所以平衡不移动。例如,可逆反应:C(s)+H2O(g) CO(g)+H2(g),在某温度反应达到平衡时,增加或移走一部分碳固体,化学平衡不移动。②在溶液中进行的反应,如果稀释溶液,反应物浓度减小,生成物浓度也减小,则υ正减小,υ逆也减小,但减小的程度不同,总的结果是化学平衡向化学方程式中化学计量数之和较大的方向移动。
三 压强对化学平衡的影响
说明:①改变体系的压强相当于改变体系的体积,也就相当于改变气体物质的浓度(如增大体系的压强相当于增大气体物质的浓度),所以压强对化学平衡的影响对应于浓度对化学平衡的影响。②对反应前后气体体积不变的平衡体系,压强改变不会使平衡发生移动。③恒温恒容条件下,向容器中充入稀有气体,平衡不发生移动。因为虽然气体总压强增大了,但各反应物和生成物的浓度都不改变。④恒温恒压条件下,向容器中充入稀有气体,平衡会向气体体积增大的反应方向移动。因为此时容器体积增大了,各反应物和生成物的浓度都降低从而引起平衡移动。
【例2】 某温度下,在固定容积的容器中,可逆反应A(气)+3B(气) 2C(气)达到平衡。测得平衡时物质的量之比为A ∶ B ∶ C=2 ∶ 2∶1。保持温度不变,以2 ∶ 2 ∶ 1的体积比再充入A、B、C,则( )A.平衡向正反应方向移动B.平衡不移动C.C的百分含量增大D.C的百分含量有可能减小
[解析] 此题表面为增大浓度实为增大压强,而解题方法巧妙地应用“过程假设方法”和“等效”二字而使试题难度降低。设题中所给的反应容器的容积为V。由于再充入的气体和平衡时的气体的百分含量相同,因此我们可以认为是在一个比V大的反应容器内,在题设平衡条件下使反应达到平衡。则该平衡状态和容积为V时的平衡状态是等效的。然后把气体压缩到体积为V时,化学平衡向气体体积缩小的方向移动,即向正反应方向移动。故排除选项B、D。[答案] AC
【例3】 反应NH4HS(固)NH3(气)+H2S(气)在一定温度下达到平衡。下列各种情况下,不能使平衡发生移动的是( )A.温度、容积不变时,通入SO2气体B.移走一部分 NH4HS固体C.容积不变,充入氮气D.充入氮气,保持压强不变
[解析] 依据影响平衡的条件,如何分析以上选项?A选项:SO2+2H2S=3S↓+2H2O减小了生成物浓度,故平衡向正向移动;B项:NH4HS为固体,故不能使平衡移动;C选项:由于容积不变,原平衡中各物质的浓度不发生变化,故不发生移动;D选项,充入不参加反应的N2,且恒压,则体积增大,浓度减小,故平衡发生移动,故选BC。[答案] BC
四 温度对化学平衡的影响
说明:①任意的化学反应都伴随着能量的变化(放热或吸热)。在可逆反应里,一个反应为放(吸)热反应,另一个反应必为吸(放)热反应,吸收的热量与放出的热量数值相等,但符号相反。②任意可逆反应的化学平衡状态,都能受到温度的影响而发生移动。
由于催化剂能够同等程度地改变正、逆反应速率,因此它对化学平衡的移动无影响,即催化剂不能改变达到化学平衡状态的反应混合物的组成,但是使用催化剂能改变反应达到平衡所需的时间。如图1所示。使用催化剂对可逆反应影响的速率-时间图象如图2所示。a.曲线表示无催化剂时B%随时间变化;b.曲线表示有催化剂时B%随时间变化。
五 催化剂对化学平衡的影响
【例4】 如图所示,烧瓶A、B中装有相同浓度的NO2和N2O4的混合气体,中间用止水夹K夹紧,烧杯甲中盛放100 mL 6ml·L-1的HCl溶液,烧杯乙中盛放100 mL冷水。现向烧杯甲的溶液中放入25g NaOH固体,同时向烧杯乙中放入25 g NH4NO3固体,搅拌使乙溶解。
(1)A瓶中气体颜色________,理由是________。(2)B瓶中气体颜色________,理由是________。
[答案] (1)变深;甲中NaOH溶解放热,中和HCl也放热,烧瓶A中气体温度升高,2NO2 N2O4(正反应为放热反应)平衡向左移动,NO2浓度增大,颜色加深。(2)变浅;NH4NO3溶解吸热,乙中溶液及B中气体温度降低,使反应2NO2 N2O4(正反应为放热反应)向右移动,NO2浓度减小,颜色变浅。
[解析] NaOH 与盐酸发生中和反应为放热反应,使溶液温度升高,故使平衡2NO2 N2O4(正反应为放热反应)向左移动,气体颜色变深;NH4NO3溶于水要吸热,溶液温度降低,使上述平衡向右移动,气体颜色变浅。
【例5】 对于合成氨反应来说,使用催化剂和采用高压,对这两项作用的叙述正确的是( )A.都能提高反应速率,对平衡无影响B.都不能缩短达到平衡所用的时间,但对平衡有影响C.都能缩短达到平衡所用的时间,只有压强对平衡有影响D.催化剂能缩短达到平衡所用的时间,而压强不能
[解析] 依据反应速率理论和勒夏特列原理对以上四项逐一分析。A项中都能提高反应速率,但压强对平衡移动有影响B项中都能缩短达到平衡的时间,但催化剂对平衡移动无影响C项符合反应速率理论和勒夏特列原理D项中压强增大也能缩短达到平衡所需时间,故应选C。[答案] C
苏教版 (2019)选择性必修1第三单元 化学平衡的移动示范课ppt课件: 这是一份苏教版 (2019)选择性必修1第三单元 化学平衡的移动示范课ppt课件,共31页。PPT课件主要包含了化学平衡的移动,外界条件,正反应,逆反应,条件改变,图示表示,溶液黄色加深,溶液橙色加深,2影响规律,注意事项等内容,欢迎下载使用。
高中第三单元 金属的腐蚀与防护完整版ppt课件: 这是一份高中第三单元 金属的腐蚀与防护完整版ppt课件,共12页。PPT课件主要包含了金属的腐蚀,吸氧腐蚀,正极活泼性较弱金属,正极反应物氧气,中性或弱酸性,正极反应物氢离子,析氢腐蚀,酸性较强等内容,欢迎下载使用。
苏教版 (2019)选择性必修2第三单元 物质结构研究的意义优秀课件ppt: 这是一份苏教版 (2019)选择性必修2第三单元 物质结构研究的意义优秀课件ppt,共8页。PPT课件主要包含了学习目标等内容,欢迎下载使用。













