





化学苏教版 (2019)第一单元 化学反应的热效应课堂教学课件ppt
展开1.认识化学能与热能相互转化的规律。2.能阐释化学能转化成热能的实际意义及其重要应用。3. 能从化学键的角度解释化学反应中能量变化的本质。
一、反应热与焓变1.定义:化学反应过程中所释放或吸收的能量,都可以用热量来表述,叫做反应热,又称为“焓变”,符号用ΔH。说明:①单位为kJ/ml 或kJ·ml-1。②反应热描述的是化学反应前后的热量变化。③反应热描述的是一定温度下的热量变化。④任何化学反应都有反应热。
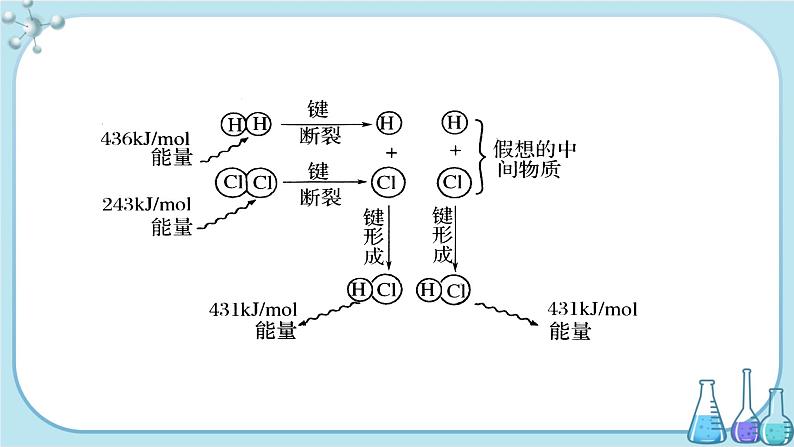
由于在化学反应过程中,当反应物分子间的化学键断裂时,需要克服原子间的相互作用,这需要吸收能量;当原子重新结合成生成物分子,即新化学键形成时,又要释放能量,则生成物分子形成时所释放的总能量与反应物分子断裂时所吸收的总能量的差即为该反应的反应热。 如:当1ml H2与1 ml Cl2在一定条件下反应生成2ml HCl时,1ml H2分子中的化学键断裂时需要吸收436kJ 的能量,1ml Cl2分子中的化学键断裂时需要吸收243kJ 的能量,而2ml HCl分子中的化学键形成时要释放431kJ/ml ×2ml=862kJ的能量,如图所示。
2.反应热产生的原因:
H2(g)+Cl2(g)=2HCl(g)的反应热,应等于生成物分子形成时所释放的总能量(862kJ/ml)与反应物分子断裂时所吸收的总能量(679kJ/ml)的差,即放出183kJ/ml的能量。显然,分析结果与实验测得的该反应的反应热(184.6kJ/ml)很接近(一般用实验数据来表示反应热。)由此可得: 放热反应:生成物释放的总能量大于反应物吸收的总能量,ΔH为“-”或“ΔH<0”。 吸热反应:生成物释放的总能量小于反应物吸收的总能量,ΔH为“+”或“ΔH>0”。
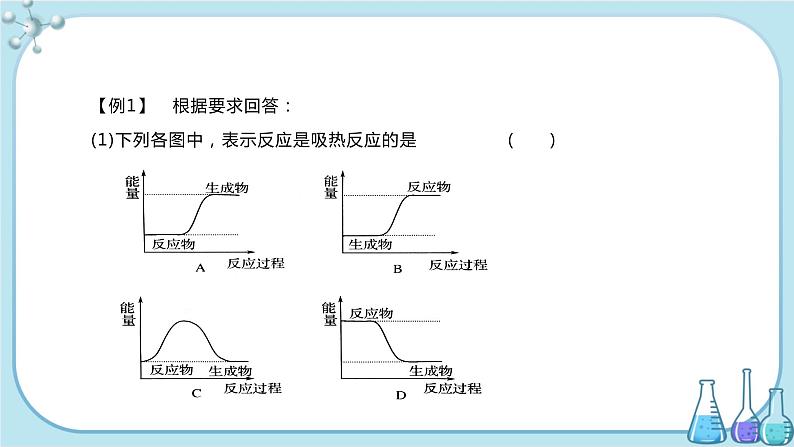
【例1】 根据要求回答:(1)下列各图中,表示反应是吸热反应的是( )
(2)拆开1ml H—H键,1ml N—H键,1ml N≡N键分别需要吸收的能量为436kJ、391kJ、946kJ,求1ml N2生成NH3的焓变(ΔH)。
[解析] (1)反应中的能量变化=生成物总能量-反应物总能量,若大于0,则反应过程为吸热,小于0,则为放热,答案为A。(2)ΔH=反应物的键能之和-生成物的键能之和=(1ml N≡N键键能+3ml H-H键键能)-6ml N-H键键能,代入数据即可得结论。[答案] (1)A (2)ΔH=-92kJ/ml
【例2】 某些化学键的键能如下表(kJ·ml-1)(1)1ml H2在2ml Cl2中燃烧,放出热量________kJ。(2)在一定条件下,1ml H2与足量的Cl2、Br2、I2分别反应,放出热量由多到少的顺序是________。a.Cl2>Br2>I2 b.I2>Br2>Cl2预测1ml H2在足量F2中燃烧比在Cl2中放热________。
[解析] (1)1ml H2在2ml Cl2中燃烧,参加反应的H2和Cl2都是1ml,生成HCl 2ml。则放出热量 :431 kJ·ml-1×2ml-436kJ·ml-1×1ml-247kJ·ml-1×1ml=179kJ。(2)由于键能Cl—Cl键>Br—Br键>I—I键,故H2在Cl2中燃烧放热最多,在I2中燃烧放热最少。推测键能F—F键>Cl—Cl键,故知H2在F2中燃烧放热多。
[答案] (1)179 (2)a (3)多[点拨] 在化学反应中,旧化学键断裂时,需要吸收能量;当原子重新组合,形成新化学键生成新物质时,又要释放能量。断裂1ml 化学键吸收的能量或形成1ml化学键释放出的能量就是该化学键的键能。
拓展:1.常见的放热反应(1)活泼金属与H2O或酸的反应。如:2Al+6HCl=2AlCl3+3H2↑(2)酸碱中和反应。如:2KOH+H2SO4=K2SO4+2H2O(3)燃烧反应。如:(4)大多数化合反应。如:Na2O+H2O=2NaOH CaO+H2O=Ca(OH)2
2.常见的吸热反应(1)大多数分解反应。如:(2)部分特殊反应。如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
(2)部分特殊反应。如:2NH4Cl(s)+Ba(OH)2·8H2O(s)=BaCl2+2NH3↑+10H2O
1.定义:把一个化学反应中物质的变化和反应的焓变同时表示出来的化学方程式。2.表示意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的焓变。例如:H2(g)+ O2(g)=H2O(l) ΔH(298K)=-285.8kJ·ml-1。表示1ml H2(g)与0.5ml O2(g)反应生成了1ml H2O(l),放热285.8kJ。
3.书写热化学方程式应注意的事项(1)要在物质的化学式后面用括号注明各物质的聚集状态。一般用英文字母g、l和s分别表示气态、液态和固态,水溶液中的溶质则用aq 表示。(2)ΔH的单位是kJ·ml-1。(3)根据焓的性质,对于相同物质的反应,当化学计量数不同时,其ΔH也不同。若化学方程式中各物质的计量数加倍,则ΔH的数值也加倍。(4)热化学方程式中不用“↑”“↓”,等号上不用标明反应条件。
(5)ΔH的单位“kJ·ml-1”并不是指每摩具体物质反应时伴随的能量变化是多少千焦,而是指给定形式的具体反应以各物质的化学计量数来计量其物质的量时伴随的能量变化。不论热化学方程式的化学计量数如何改变,其单位都为kJ·ml-1。(6)书写热化学方程式时必须标明ΔH的符号,放热反应中ΔH为“-”,吸热反应中ΔH为“+”,正负号不可丢掉。
热化学方程式往往是接受容易书写难。这种“难”主要体现在书写不完整,且常有如下漏写之处:①漏写反应物或生成物的聚集状态,其根本点是没有认识到反应热与物质的聚集状态有关。②将ΔH的正、负混淆,其关键是没有体会到“+”、“-”分别表示吸收或放出热量后使反应体系本身的能量升高或降低了。
③未注意到:化学计量数不同,其反应热的数值也不相同。例如,H2(g)+Cl2(g)=2HCl(g) ΔH=-184.6kJ·ml-1① =HCl(g) ΔH=-92.3kJ·ml-1②
4.热化学方程式与普通化学方程式的区别
【例1】 已知在25℃、101kPa下,1gC8H18(辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ的热量。表示上述反应的热化学方程式正确的是( )
[解析] 在25℃、101kPa下,1ml C8H18燃烧生成CO2和液态水时放出的热量为 ×114g=5518kJ。在判断热化学方程式时应注明以下几点:①标明各物质的状态,A中H2O的状态标错,A不正确;②标明反应是吸热还是放热,ΔH>0时为吸热反应,ΔH<0时为放热反应,C错;③热量数值要与化学计量数相对应,显然D错。[答案] B
【例2】 根据如图所示图像,写出反应的热化学方程式并回答下列问题:(1)反应过程①的热化学方程式为:______________________。(2)反应过程②的热化学方程式为:______________________。(3)Q与Q1的关系:Q________Q1(填“大于”“小于”或“等于”)。
[解析] 图中已清楚地表明两个反应的反应物、生成物和反应热,按照书写热化学方程式的规则,不难写出相应的热化学方程式。因为两个反应互为逆反应,因此其反应热的数值相等,符号相反。[答案] (1)A2(g)+B2(g)=C(g) ΔH=-Q kJ/ml(2)C(g)=A2(g)+B2(g) ΔH=+Q1 kJ/ml (3)等于
高中苏教版 (2019)第一单元 化学反应的热效应教学课件ppt: 这是一份高中苏教版 (2019)<a href="/hx/tb_c4009310_t3/?tag_id=26" target="_blank">第一单元 化学反应的热效应教学课件ppt</a>,共33页。PPT课件主要包含了反应热与焓变,热化学方程式,从微观角度分析,典型例题,考题体验,标准燃烧热,例题体验,中和热等内容,欢迎下载使用。
高中化学第一单元 化学反应的热效应优秀ppt课件: 这是一份高中化学第一单元 化学反应的热效应优秀ppt课件,共60页。PPT课件主要包含了内容索引,焓变反应热,热化学方程式,课时对点练,化学反应,吸收或释放,kJ·mol-1,正误判断,深度思考,应用体验等内容,欢迎下载使用。
化学选择性必修1第一单元 化学反应的热效应教案配套ppt课件: 这是一份化学选择性必修1第一单元 化学反应的热效应教案配套ppt课件,共60页。PPT课件主要包含了焓变反应热,热化学方程式,课时对点练等内容,欢迎下载使用。













