




化学选择性必修1第二单元 化学能与电能的转化课文课件ppt
展开1. 理解电解池的构成、工作原理及应用。2. 能书写电解池的电极反应和总反应方程式。
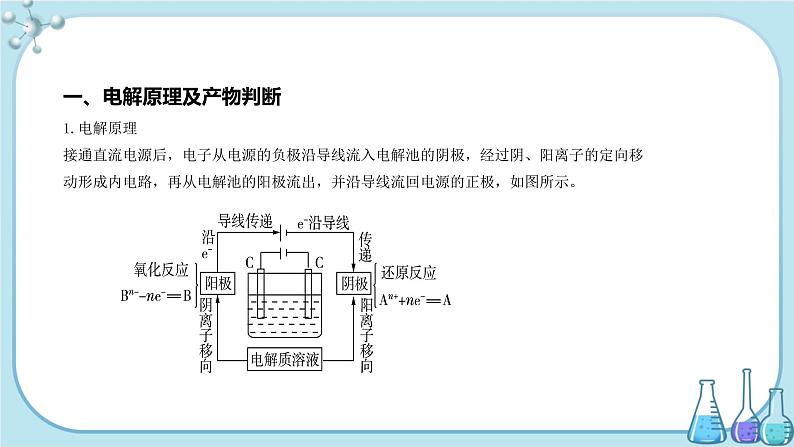
一、电解原理及产物判断1.电解原理接通直流电源后,电子从电源的负极沿导线流入电解池的阴极,经过阴、阳离子的定向移动形成内电路,再从电解池的阳极流出,并沿导线流回电源的正极,如图所示。
2.电极产物的判断(1)基本思路
(2)离子放电顺序①阴离子的放电顺序:S2->I->Br->Cl->OH->含氧酸根>F-。②阳离子放电顺序: Ag+>Hg2+>Fe3+>Cu2+>H+(酸)>Pb2+> Sn2+>Fe2+>Zn2+>H+(水)>Al3+> Mg2+>Na+。
例1 用惰性电极电解稀硫酸、Cu(NO3)2、NaCl的混合液,最初一段时间阴极和阳极上分别析出的物质是( )A. H2和Cl2 B. Cu和Cl2 C. H2和O2 D. Cu和O2解析:由题意知,溶液中存在H+、Cu2+、Na+、SO42-、NO3-、Cl-、OH-。根据离子的放电顺序,阳离子:Cu2+>H+>Na+,阴离子:Cl->OH->SO42-、NO3-,则最初一段时间,阴极:Cu2++2e- Cu,阳极:2Cl--2e- Cl2↑。答案:B
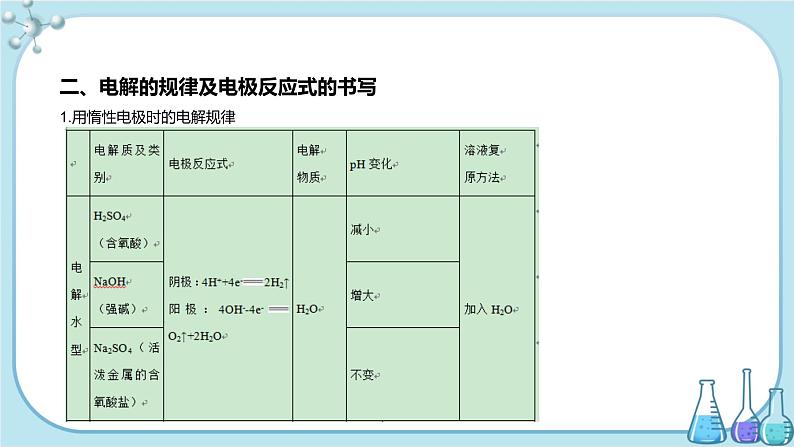
二、电解的规律及电极反应式的书写1.用惰性电极时的电解规律
2.电解池中电极反应式的书写
例2 用惰性电极电解某溶液时,发现两极只有H2和O2生成,则电解一段时间后,下列有关该溶液(与电解前同温度)的说法中正确的是( )①该溶液的pH可能增大;②该溶液的pH可能减小;③该溶液的pH可能不变;④该溶液的浓度可能增大;⑤该溶液的浓度可能不变;⑥该溶液的浓度可能减小A.①②③ B.①②③④C.①②③④⑤ D.全部解析:两极只生成H2和O2相当于电解水,对不饱和电解质溶液来说是浓缩,浓度会增大,但电解的如果是饱和溶液,其溶液的浓度不变;电解NaOH、H2SO4、Na2SO4时的pH分别增大、减小、不变。答案:C
三、有关电解的计算1.计算的原则(1)阳极失去的电子数=阴极得到的电子数。(2)串联电路中通过各电解池的电子总数相等。(3)电源输出的电子总数和电解池中转移的电子总数相等。2.计算的方法(1)根据电子守恒法计算:用于串联电路、阴阳两极产物、正负两极产物、相同电量等类型的计算,其依据是电路中转移的电子数相等。(2)根据总反应式计算:先写出电极反应式,再写出总反应式,最后根据总反应式列比例式计算。(3)根据关系式计算:根据得失电子守恒的关系建立已知量与未知量之间的桥梁,建立计算所需的关系式。电解计算时常用的定量关系为4e-~4H+~4OH-~2H2~O2~2Cu~4Ag。3.计算的步骤首先要正确书写电极反应式(要特别注意阳极材料);其次注意溶液中有多种离子共存时,要根据离子放电顺序确定离子放电的先后;最后根据得失电子守恒进行相关计算。
例3 将含有0.4 ml CuSO4和0.2 ml NaCl的水溶液1 L,用惰性电极电解一段时间后,在一个电极上得到0.3 ml Cu,另一个电极上析出气体在标准状况下的体积为( )4.48 L B. 5.60 L C. 6.72 L D. 13.44 L解析:阴极反应式为Cu2++2e- Cu,反应的n(Cu2+)=0.3 ml,n(Cu2+)总=0.4 ml,说明Cu2+过量,阴极共得到0.6 ml电子;由电子守恒可知,阳极应失去0.6 ml电子。阳极上首先发生反应2Cl--2e- =Cl2↑,只能转移0.2 ml电子生成0.1 ml Cl2,其次发生反应4OH--4e- = 2H2O+O2↑,转移0.4 ml电子生成0.1 ml O2,则阳极共放出气体的体积为(0.1 ml+0.1 ml)×22.4 L/ml=4.48 L(标准状况)。答案:A
苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性多媒体教学ppt课件: 这是一份苏教版 (2019)选择性必修1专题3 水溶液中的离子反应第二单元 溶液的酸碱性多媒体教学ppt课件,共18页。PPT课件主要包含了学习目标等内容,欢迎下载使用。
苏教版 (2019)选择性必修1第二单元 化学能与电能的转化教课课件ppt: 这是一份苏教版 (2019)选择性必修1第二单元 化学能与电能的转化教课课件ppt,共12页。PPT课件主要包含了学习目标,生活中的化学电源,化学电源,失去电子,得电子,二次电池,铅蓄电池,锂离子电池,归纳总结等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第二单元 化学能与电能的转化课前预习ppt课件: 这是一份高中化学苏教版 (2019)选择性必修1专题1 化学反应与能量第二单元 化学能与电能的转化课前预习ppt课件,共14页。PPT课件主要包含了电解质溶液,阴离子,阳离子等内容,欢迎下载使用。













