





高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构评课ppt课件
展开1、写出C原子电子排布图,并由此推测: C原子有没有可能形成四个共价键?怎样才能形成四个共价键?
2、如果C原子就以1个2s轨道和3个2p轨道上的单电子, 分别与四个H原子的1s轨道上的单电子重叠成键,所 形成的四个共价键能否完全相同?这与CH4分子的 实际情况是否吻合?
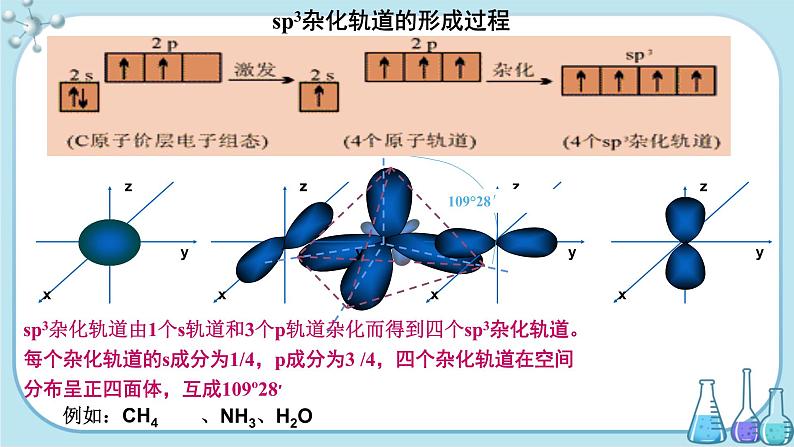
sp3杂化轨道的形成过程
sp3杂化轨道由1个s轨道和3个p轨道杂化而得到四个sp3杂化轨道。每个杂化轨道的s成分为1/4,p成分为3 /4,四个杂化轨道在空间分布呈正四面体,互成109º28′
p轨道稍大于s轨道,但是在同一能级组中,能量接近
杂化轨道的能量处于s与p轨道之间,4个轨道能量相等
杂化:原子内部能量相近的原子轨道,在外界条件影响下重新组合的过程叫原子轨道的杂化杂化轨道:原子轨道组合杂化后形成的一组新轨道杂化轨道类型:sp、sp2、sp3等杂化结果:重新分配能量和空间方向,组成数目相等成键能力更强的原子轨道杂化轨道用于形成σ键和容纳孤对电子
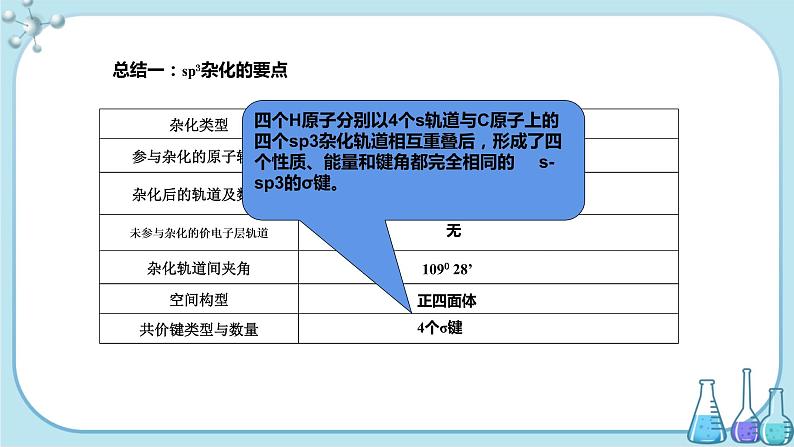
总结一:sp3杂化的要点
问2、通过观察示意图,描述甲烷中共价键的形成过程
四个H原子分别以4个s轨道与C原子上的四个sp3杂化轨道相互重叠后,形成了四个性质、能量和键角都完全相同的 s-sp3的σ键。
问3、四个杂化轨道为什么采取四面体构型,即4个轨道的伸展方向分别指向正四面体的4个顶点?而不是形成平面四边形等构型呢?通过观察示意图回答。
3、杂化后轨道的空间构型为什么是正四面体109.50?
一、甲烷分子的空间构型与杂化轨道理论
sp3杂化轨道的空间取向示意图
为了使四个杂化轨道在空间尽可能远离,使轨道间的排斥最小,体系最稳定,4个杂化轨道的伸展方向分别指向正四面体的四个顶点,轨道间夹角为1090 28’ 。
sp2杂化轨道的形成过程
sp2杂化轨道由1个s轨道和2个p轨道杂化而得到三个sp2杂化轨道。三个杂化轨道在空间分布是在同一平面上,互成120º
问3:乙烯分子中各个键的形成过程及键的类型。
两个碳原子的sp2杂化轨道沿各自对称轴形成sp2-sp2 键,另两个sp2杂化轨道分别与两个氢原子的1s轨道重叠形成两个sp2-s键,两个pz轨道分别从侧面相互重叠,形成P-P键,形成乙烯分子。
注意:在形成共价键时,优先形成“头碰头”式的 键,在此基础上才能形成“肩并肩”式的键。
sp杂化轨道的形成过程
sp杂化轨道由1个s轨道和1个p轨道杂化而得到两个sp杂化轨道。两个杂化轨道在空间分布呈直线型,互成180º
问3:乙炔分子中各个键的形成过程及键的类型。
两个碳原子的sp1杂化轨道沿各自对称轴形成sp1-sp1 键,另2个sp1杂化轨道与2个氢原子的1s轨道重叠形成2个sp1-s键,两个p轨道分别从侧面相互重叠,形成2个P-P键,形成乙炔分子。
杂化轨道只用于形成σ键或者用来容纳孤对电子剩余的p轨道可以形成π键
大π 键 C66H66
基态N的最外层电子构型为 2s22p3,在H影响下,N 的一个2s轨道和三个2p 轨道进行sp3 不等性杂化,形成四个sp3 杂化轨道。其中三个sp3杂化轨道中各有一个未成对电子,另一个sp3 杂化轨道被孤对电子所占据。 N 用三个各含一个未成对电子的sp3 杂化轨道分别与三个H 的1s 轨道重叠,形成三个 键。由于孤对电子的电子云密集在N 的周围,对三个 键的电子云有比较大的排斥作用,使 键之间的键角被压缩到 ,因此NH3 的空间构型为三角锥形。
基态O 的最外层电子构型为2s22p4,在 H 的影响下,O 采用sp3 不等性杂化,形成四个sp3 杂化轨道,其中两个杂化轨道中各有一个未成对电子,另外两个杂化轨道分别被两对孤对电子所占据。O 用两个各含有一个未成对电子的sp3杂化轨道分别与两个H 的 1s 轨道重叠,形成两个 键。由于O的两对孤对电子对两个 键的成键电子有更大的排斥作用,使 键之间的键角被缩到 ,因此 H2O 的空间构型为V型。
根据以下事实总结:如何判断一个化合物的中心原子的杂化类型?
已知:杂化轨道只用于形成σ键或者用来容纳孤对电子
杂化轨道数=中心原子孤对电子对数+中心原子结合的原子数
中心原子上的孤电子对数
a为中心原子的价电子数,对于阳离子来说,a为中心原子的价电子数减去离子的电荷数,其他不变;对于阴离子来说,a为中心原子的价电子数加上 离子的电荷数,其他不变。
x为与中心原子结合的原子数
b为与中心原子结合的原子最多能接受的电子数,即未成对电子数氢为1,其他原子等于“8―价电子数”
结合上述信息完成下表:
用杂化轨道理论分析下列物质的杂化轨道类型和分子的立体构型。(1)BF3 (2)SO3 (3)NH4+(4)H3O+(5)SO32-
1、看中心原子有没有形成双键或叁键,如果有1个叁键,则其中有2个π键,用去了2个p轨道,形成的是sp杂化;如果有1个双键则其中有1个π键,形成的是sp2杂化;如果全部是单键,则形成的是sp3杂化。2、没有填充电子的空轨道一般不参与杂化.
化学选择性必修2第一单元 分子的空间结构课文配套ppt课件: 这是一份化学选择性必修2第一单元 分子的空间结构课文配套ppt课件,共27页。PPT课件主要包含了问题探究一,Sp2杂化,C-C,sp3,sp2,C=C,C≡C,直线形,平面三角形,四面体等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二节 分子的空间结构多媒体教学ppt课件: 这是一份人教版 (2019)选择性必修2第二节 分子的空间结构多媒体教学ppt课件,共60页。PPT课件主要包含了知识点一,°28′,知识点二,平面三角形,正四面体形,三角锥形,随堂练学以致用,sp3,sp2,课后测素养评价等内容,欢迎下载使用。
人教版 (2019)选择性必修2第二章 分子结构与性质第二节 分子的空间结构图片ppt课件: 这是一份人教版 (2019)选择性必修2第二章 分子结构与性质第二节 分子的空间结构图片ppt课件,共27页。PPT课件主要包含了问题探究一,Sp2杂化,C-C,sp3,sp2,C=C,C≡C,直线形,平面三角形,四面体等内容,欢迎下载使用。













