

高中化学鲁科版 (2019)选择性必修2第2节 共价键与分子的空间结构多媒体教学ppt课件
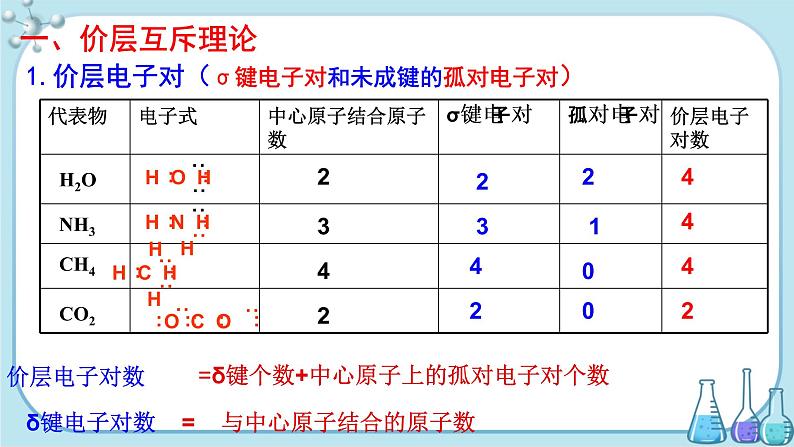
展开1.价层电子对(σ键电子对和未成键的孤对电子对)
=δ键个数+中心原子上的孤对电子对个数
δ键电子对数 = 与中心原子结合的原子数
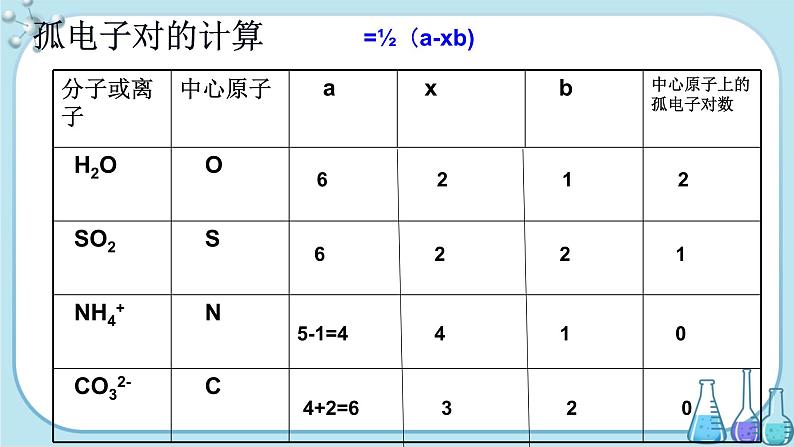
中心原子上的孤电子对数 =½(a-xb)
2.成键σ键电子对和未成键的孤对电子对
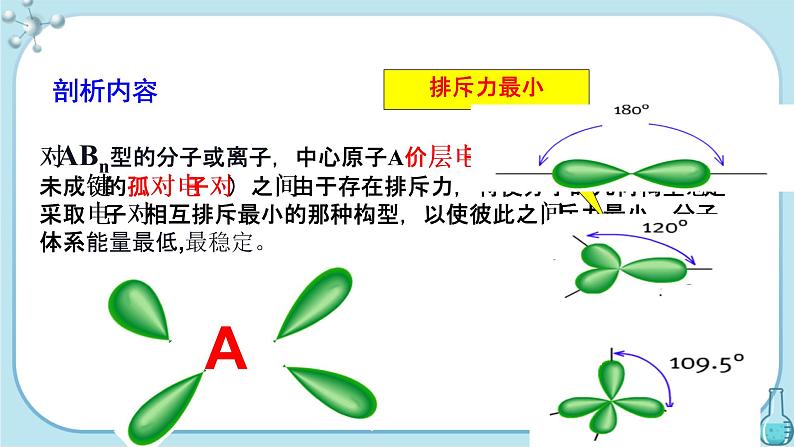
对ABn型的分子或离子,中心原子A价层电子对(包括成键σ键电子对和未成键的孤对电子对)之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使彼此之间斥力最小,分子体系能量最低,最稳定。
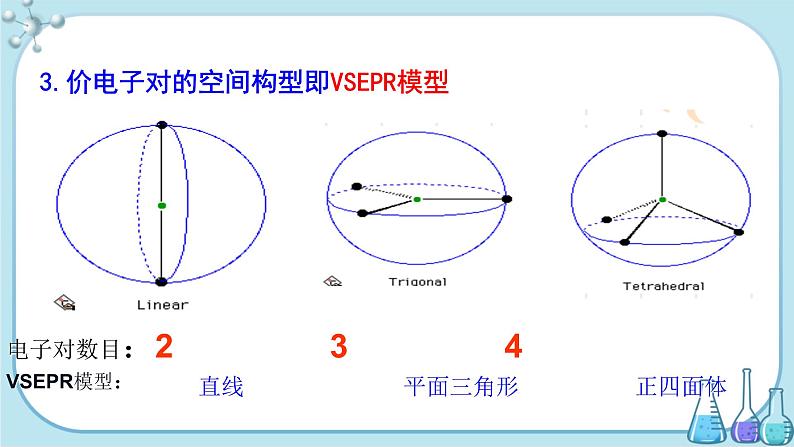
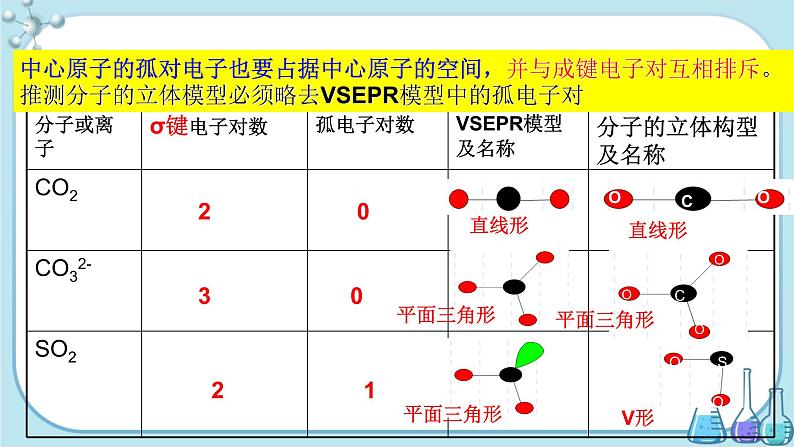
3.价电子对的空间构型即VSEPR模型
电子对数目:2 3 4VSEPR模型:
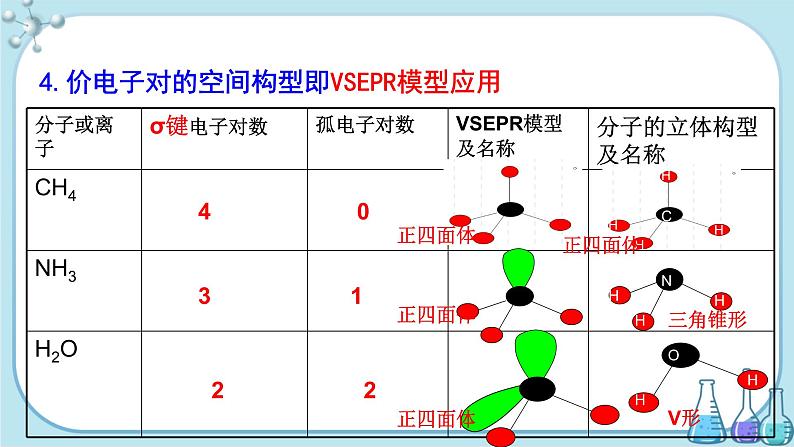
4. VSEPR模型应用——预测分子立体构型
中心原子的孤对电子也要占据中心原子的空间,并与成键电子对互相排斥。推测分子的立体模型必须略去VSEPR模型中的孤电子对
4.价电子对的空间构型即VSEPR模型应用
ABn 型分子的VSEPR模型和立体结构
平面三角形 BF3
4 0 AB4
3 1 AB3
2 2 AB2
二、 等电子原理1. 等电子原理的基本观点化学通式相同且价电子总数相等的分子或离子(即等电子体)具有相同的空间结构和化学键类型等结构特征。2.等电子原理的应用利用等电子原理可以判断一些简单分子或原子团的空间结构。如NH3和H3O+的空间结构相似(三角锥形);SiCl4、SO42-、PO43-都呈正四面体形。3. 常见的等电子体常见的等电子体及空间结构如下表所示:
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构优质ppt课件: 这是一份高中化学人教版 (2019)选择性必修2<a href="/hx/tb_c4002447_t3/?tag_id=26" target="_blank">第二节 分子的空间结构优质ppt课件</a>,共17页。PPT课件主要包含了三原子分子,四原子分子,CO2,H2O,NH3,直线形,三角锥形,CH2O,平面三角形,价层电子对等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教课内容ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第二节 分子的空间结构教课内容ppt课件,共23页。PPT课件主要包含了课前导入,直线形,平面三角形,三角锥形,价层电子对,相互排斥,彼此远离,最稳定,σ键电子对,中心原子上的孤电子对等内容,欢迎下载使用。
高中化学苏教版 (2019)选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构说课ppt课件: 这是一份高中化学苏教版 (2019)选择性必修2专题4 分子空间结构与物质性质第一单元 分子的空间结构说课ppt课件,共18页。PPT课件主要包含了H2O,CO2,HCHO,NH3,形形色色的分子,五原子分子立体结构,最常见的是正四面体,CH4,价层互斥理论,孤电子对的计算等内容,欢迎下载使用。













