




高中化学鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型课前预习课件ppt
展开一、分子晶体 1.分子晶体的定义分子间通过分子间作用力结合形成的晶体称为分子晶体。非金属单质、非金属的氧化物和氢化物等无机物以及有机化合物形成的晶体,大都属于分子晶体。2.分子晶体的物理性质(1)分子晶体在熔化时,破坏的只是分子间作用力,所以只需要外界提供较少的能量。因此,分子晶体的熔点通常较低,硬度也较小,有较强的挥发性。(2)对组成和结构相似,晶体中又不含氢键的物质来说,随着相对分子质量的增大,分子间作用力增强,熔、沸点升高。
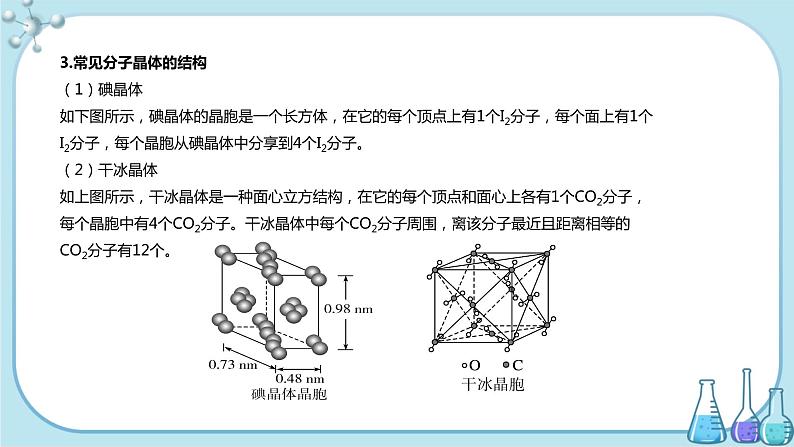
3.常见分子晶体的结构(1)碘晶体如下图所示,碘晶体的晶胞是一个长方体,在它的每个顶点上有1个I2分子,每个面上有1个I2分子,每个晶胞从碘晶体中分享到4个I2分子。 (2)干冰晶体如上图所示,干冰晶体是一种面心立方结构,在它的每个顶点和面心上各有1个CO2分子,每个晶胞中有4个CO2分子。干冰晶体中每个CO2分子周围,离该分子最近且距离相等的CO2分子有12个。
(3) 冰晶体如下图所示,冰晶体主要是水分子依靠氢键而形成的。由于氢键具有一定的方向性,中央的水分子与周围四个水分子结合,边缘的四个水分子也按照同样的规律再与其他水分子结合,每个氧原子周围都有四个氢原子。这种排列类似于蜂巢结构,比较松散,因此水由液态变成固态时,密度变小。
例1 氯化硼的熔点为-107 ℃,沸点为12.5 ℃,在其分子中键与键之间的夹角为120°,它能水解。有关叙述正确的是( )A.氯化硼晶体是分子晶体B.氯化硼液态时能导电而固态时不能导电 C.氯化硼分子的中心原子采取sp3杂化D.氯化硼分子属于极性分子,分子空间结构为三角锥形
解析:A对,BCl3的熔点、沸点均较低,说明BCl3晶体是分子晶体。B错,BCl3晶体是分子晶体,在固态和熔融态时均不能发生电离,故均不能导电。C错,BCl3分子中B原子的价电子对数为3+ ×(3-3×1)=3,B原子采取sp2杂化。D错,BCl3分子为平面三角形,正、负电荷中心重合,则BCl3为非极性分子。
例2 已知干冰晶胞属于面心立方晶胞(如图),晶胞中最近的两个相邻CO2分子间距为a pm,阿伏加德罗常数为NA,下列说法正确的是( )A.晶胞中一个CO2分子的配位数是8B.晶胞的密度表达式是 g·cm-3C.一个晶胞中平均含6个CO2分子D. CO2分子的空间结构是直线形,中心C原子的杂化类型是sp3杂化
解析:A错,以顶角CO2分子为研究对象,可得晶胞中一个CO2分子的配位数为12。B对,该晶胞中最近的两个相邻CO2分子间距为a pm,即晶胞面心上的CO2分子和其同一面上顶角的CO2之间的距离为a pm,则晶胞棱长= a pm= a×10-10 cm,晶胞体积=( a×10-10 cm)3,该晶胞中CO2分子个数=8× +6× =4,晶胞密度= = g·cm-3= g·cm-3。C错,该晶胞中二氧化碳的分子个数=8× +6× =4。D错,CO2分子中C原子采取sp杂化。
二、晶体结构的复杂性石墨的晶体结构如图所示: 1.晶体结构:平面层状结构。2.最小的环:六元环。3.由于每个碳原子为三个六元环所共用,即每个六元环拥有的碳原子数为6× =2。4.碳碳键为两个六元环所共用,每个六元环拥有的碳碳键数为6× =3,键角为120°。5.该晶体介于共价晶体、分子晶体、金属晶体之间,因而具有各种晶体的部分特点。如熔点高、硬度小、能导电。6.碳原子采取sp2杂化。
例3 碳元素的单质有多种形式,如图依次是C60、石墨和金刚石的结构示意图: 回答下列问题:(1)金刚石、石墨烯(指单层石墨)中碳原子的杂化方式分别为 、 。(2)C60属于 晶体,石墨属于 晶体。(3)在金刚石晶体中,碳原子数与化学键数之比为 ;在石墨晶体中,平均每个最小的碳原子环所拥有的化学键数为 ,该晶体中碳原子数与共价键数之比为 。(4)石墨晶体中,层内C—C键的键长为142 pm,而金刚石中C—C键的键长为154 pm。推测金刚石的熔点 (填“>”“<”或“=”)石墨的熔点。
解析:(1)金刚石中碳原子与四个碳原子形成4个共价单键(即C原子采取sp3杂化),构成正四面体,石墨中的碳原子采取sp2杂化,形成平面六元环结构。(2)C60的构成微粒是分子,属于分子晶体;石墨晶体有共价键和范德华力,属于混合型晶体。(3)金刚石晶体中每个碳原子平均拥有的化学键数为4× =2,则碳原子数与化学键数之比为1∶2。石墨晶体中,平均每个最小的碳原子环所拥有的碳原子数和化学键数分别为6× =2和6× =3,其比值为2∶3。(4)石墨中的C—C键比金刚石中的C—C键键长短,键能大,故石墨的熔点高于金刚石。
2.链状硅酸盐的结构一个硅氧四面体有两个顶点被共用而形成各种链状结构结合的长链,链上未饱和的氧离子靠金属阳离子(如Na+、Mg2+、Ca2+等)饱和。 结构如下图所示。根据上图可知,1个硅氧四面体中含1个Si和3个O,其离子化学式为(SiO32-)n。
例4 在硅酸盐中,SiO44-四面体[如下图(a)所示]通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构形式。图(b)为一种无限长层状结构的多硅酸根,其中Si原子的杂化形式为 ,Si与O的原子数之比为 ,化学式为 。 图(a) 图(b)
(Si2O5)n2n-
鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型课文ppt课件: 这是一份鲁科版 (2019)选择性必修2第3章 不同聚集状态的物质与性质第2节 几种简单的晶体结构模型课文ppt课件,共5页。
高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教课内容ppt课件: 这是一份高中化学鲁科版 (2019)选择性必修2第2节 几种简单的晶体结构模型教课内容ppt课件,共11页。
高中第2节 几种简单的晶体结构模型图文课件ppt: 这是一份高中第2节 几种简单的晶体结构模型图文课件ppt,共7页。














