









- 《水的电离和溶液的PH》第三课时课件+教学设计 课件 24 次下载
- 《盐类的水解》第一课时课件PPT+教学设计 课件 33 次下载
- 《盐类的水解》第三课时课件PPT+教学设计 课件 24 次下载
- 《盐类的水解》第四课时课件PPT+教学设计 课件 26 次下载
- 《沉淀溶解平衡》第一课时课件PPT+教学设计 课件 24 次下载
高中化学人教版 (2019)选择性必修1第三章 水溶液中的离子反应与平衡第三节 盐类的水解教学课件ppt
展开1.理解影响盐类水解平衡的因素,能多角度分析外界条件对盐类水解平衡的影响。2.知道水解常数与电离常数之间的关系。重点:能多角度分析外界条件对盐类水解平衡的影响。难点:知道水解常数与电离常数之间的关系,能进行计算。
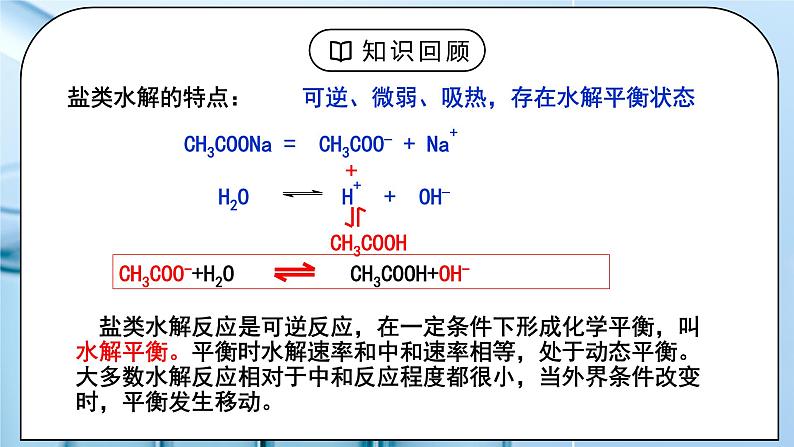
可逆、微弱、吸热,存在水解平衡状态
CH3COONa = CH3COO_ + Na+
CH3COO-+H2O CH3COOH+OH-
盐类水解反应是可逆反应,在一定条件下形成化学平衡,叫水解平衡。平衡时水解速率和中和速率相等,处于动态平衡。大多数水解反应相对于中和反应程度都很小,当外界条件改变时,平衡发生移动。
一、影响盐类水解的因素
例如:强碱弱酸盐(MA)的水解:
MA = A- + M+
A-结合H+的能力越强
强碱弱酸盐水解,生成的弱酸酸性越弱(Ka越小),该盐水解程度越大,该盐碱性越强。 强酸弱碱盐水解,生成的弱碱碱性越弱(Kb越小),该盐水解程度越大,该盐酸性越强。
提出问题问题一:FeCl3溶液呈酸性还是碱性?写出FeCl3发生水解的离子方程式。
实验用品:试管、试管夹、试管架、胶头滴管、pH计、药匙、酒精灯、火柴、0.01 ml/L FeCl3溶液、FeCl3晶体、浓盐酸、浓NaOH溶液
盐类的水解是可逆反应,水解平衡也受温度、浓度等反应条件的影响。
【实验探究】反应条件对FeCl3水解平衡的影响
Fe3+ + 3H2O ⇌ Fe(OH)3 + 3H+
问题二:从反应条件考虑,影响FeCl3水解平衡的因素可能有哪些?
【现象】FeCl3溶液加热后:颜色加深,pH值减小
【结论】温度升高,平衡向FeCl3水解的方向移动,溶液酸性增强
实验探究1:温度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O ⇌ Fe(OH)3 + 3H+ ΔH >0
【现象】增大FeCl3浓度:颜色加深,pH值减小
【结论】增大盐的浓度,平衡向盐的水解方向移动
实验探究2:反应物浓度对FeCl3水解平衡的影响
【操作】向0.1 ml/L FeCl3溶液中加水稀释10倍,pH=?
【结论】加水稀释,促进盐的水解,水解程度增大
【操作】向两支5mL0.1ml/LFeCl3溶液中分别加入1 mL盐酸和蒸馏水
向FeCl3溶液中加盐酸,颜色变浅
【结论】加酸,增大c(H+),FeCl3的水解平衡逆向移动,抑制Fe3+水解
实验探究3:生成物浓度对FeCl3水解平衡的影响
【原理】Fe3+ + 3H2O ⇌ Fe(OH)3 + 3H+
【操作】向5mL0.1ml/LFeCl3溶液中加入5滴浓NaOH溶液
【结论】加碱,减小c(H+),FeCl3的水解平衡正向移动,促进Fe3+水解
温度升高,平衡向FeCl3水解的方向移动
c(Fe3+)增大,平衡向FeCl3水解的方向移动
加入盐酸,c(H+)增大,平衡向FeCl3水解的逆反应方向移动
加入NaOH溶液,c(H+)减小,平衡向FeCl3水解的方向移动
【操作】向5mL0.1ml/LFeCl3溶液中加入少量AlCl3固体
【结论】加入与盐水解性质相反的盐会促进盐的水解, 加入与盐水解性质相同的盐会相互抑制水解。
加入少量NaCl固体呢?
加入少量NaHCO3固体呢?
实验探究4:外加盐对FeCl3水解平衡的影响
在0.01ml/LFeCl3溶液中:
Fe3++3H2O Fe(OH)3+3H+
以CH3COONa为例:
CH3COO- + H2O ⇋ CH3COOH + OH-
思考:如何从Kh角度理解“越弱越水解” ?
——反映水解程度(相当于转化率)大小
组成盐的酸根对应的酸越弱即:A-(+1个H+)的HA酸性越弱,水解程度越大,则碱增,pH越大
组成盐的弱碱阳离子对应的碱即:M+(+n个OH-)的M(OH)n碱性越弱,水解程度越大,则酸增,pH越小
思考:碳酸钠和碳酸氢钠的溶液均显碱性,可用作食用碱或工业用碱。已知:25 ℃时,碳酸的电离常数为Ka1=4.5×10-7,Ka2=4.7×10-11。(1)请写出碳酸钠水解的离子方程式,并写出其水解常数(Kh1、Kh2)表达式。(2)25 ℃时,等浓度的碳酸钠溶液和碳酸氢钠溶液谁的碱性强? 请利用水解常数加以说明。
因此:同浓度的Na2CO3溶液碱性强于NaHCO3溶液
练习2、向三份0.1 ml/L CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )A.减小、增大、减小 B.增大、减小、减小C.减小、增大、增大 D.增大、减小、增大
升高温度,向水解方向移动(盐的水解吸热)
a. 加水稀释,促进水解,水解程度增大
向能水解的盐溶液中加入与水解产物相同的离子,水解被抑制;若水解产物被消耗,则促进水解
b. 加溶质(增大浓度),促进水解,水解程度减小
高中人教版 (2019)第四章 化学反应与电能第二节 电解池一等奖教学课件ppt: 这是一份高中人教版 (2019)第四章 化学反应与电能第二节 电解池一等奖教学课件ppt,文件包含《电解池》第二课时课件pptx、《电解池》第二课时教学设计docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学ppt课件: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学ppt课件,文件包含《盐类的水解》第四课时课件pptx、《盐类的水解》第四课时教学设计docx等2份课件配套教学资源,其中PPT共24页, 欢迎下载使用。
高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt: 这是一份高中化学人教版 (2019)选择性必修1第三节 盐类的水解教学课件ppt,文件包含《盐类的水解》第三课时课件pptx、《盐类的水解》第三课时教学设计docx等2份课件配套教学资源,其中PPT共22页, 欢迎下载使用。














