

所属成套资源:各地区2023年高考化学模拟题汇编
山东省2023年高考化学模拟题汇编-11化学平衡
展开
这是一份山东省2023年高考化学模拟题汇编-11化学平衡,共58页。试卷主要包含了单选题,多选题,原理综合题,工业流程题等内容,欢迎下载使用。
山东省2023年高考化学模拟题汇编-11化学平衡
一、单选题
1.(2023·山东·统考一模)在Fe+催化作用下,C2H6与N2O制备乙醛的反应机理如图所示。下列说法正确的是
A.X为C2H5OH,是中间产物之一
B.过程①~⑥,Fe元素的化合价均发生了变化
C.增加Fe+的量,C2H6平衡转化率不变
D.每消耗1molN2O,可制备0.5molCH3CHO
2.(2023·山东淄博·统考一模)两个均充有H2S的刚性密闭容器,起始压强均为pkPa,以温度、Al2O3催化剂为条件变量,进行实验:2H2S(g)2H2(g)+S2(g),反应相同时间,结果如图所示。下列说法错误的是
A.温度升高,H2S分解的正,逆反应速率均增大
B.900℃,ts后达平衡,H2的平均生成速率为pkPa∙s−1
C.Al2O3催化剂使得正反应的活化能小于逆反应的活化能
D.1100℃,曲线II、III重合,说明Al2O3催化剂失去活性
3.(2023·山东菏泽·统考一模)的配位化合物较稳定且运用广泛。它可与、、、等形成配离子使溶液显色。如:显浅紫色的、红色的、黄色的、无色。某同学按如下步骤完成实验:
已知与、在溶液中存在以下平衡:(红色);(无色)
下列说法不正确的是
A.Ⅰ中溶液呈黄色可能是由水解产物的颜色引起的
B.与的配位能力强于
C.为了能观察到溶液Ⅰ中的颜色,可向该溶液中加入稀盐酸
D.向溶液Ⅲ中加入足量的KSCN固体,溶液可能再次变为红色
4.(2023·山东日照·统考一模)铬与铝性质相似,但活泼性比铝弱、熔点比铝高。下列说法错误的是
A.可用铝热反应制备铬
B.常温下铬在浓硝酸中发生钝化
C.可直接蒸发溶液制备无水
D.已知碱性条件下,Cr(Ⅲ)可被氧化为Cr(Ⅵ),则其氧化产物为
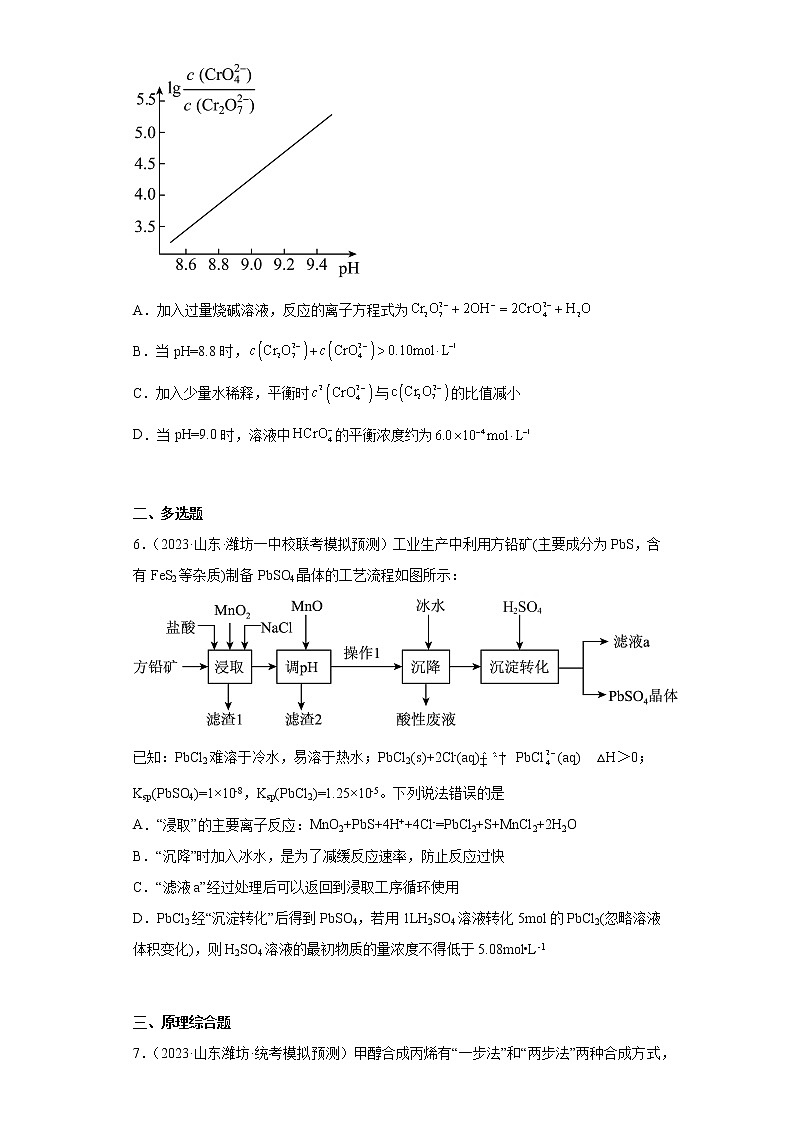
5.(2023·山东·日照一中校联考模拟预测)溶液中存在如下平衡:
(ⅰ)
(ⅱ)
25℃时,溶液中随pH的变化关系如图。下列有关溶液的说法错误的是
A.加入过量烧碱溶液,反应的离子方程式为
B.当pH=8.8时,
C.加入少量水稀释,平衡时与的比值减小
D.当pH=9.0时,溶液中的平衡浓度约为
二、多选题
6.(2023·山东·潍坊一中校联考模拟预测)工业生产中利用方铅矿(主要成分为PbS,含有FeS2等杂质)制备PbSO4晶体的工艺流程如图所示:
已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)PbCl(aq) △H>0;Ksp(PbSO4)=1×10-8,Ksp(PbCl2)=1.25×10-5。下列说法错误的是
A.“浸取”的主要离子反应:MnO2+PbS+4H++4Cl-=PbCl2+S+MnCl2+2H2O
B.“沉降”时加入冰水,是为了减缓反应速率,防止反应过快
C.“滤液a”经过处理后可以返回到浸取工序循环使用
D.PbCl2经“沉淀转化”后得到PbSO4,若用1LH2SO4溶液转化5mol的PbCl2(忽略溶液体积变化),则H2SO4溶液的最初物质的量浓度不得低于5.08mol•L-1
三、原理综合题
7.(2023·山东潍坊·统考模拟预测)甲醇合成丙烯有“一步法”和“两步法”两种合成方式,“一步法”是在催化剂的作用下由甲醇直接合成丙烯;“两步法”则分两步合成,其热化学方程式如下:
反应I:甲醇醚化反应(DME)
反应II:含氧化合物制丙烯反应(OTP)
已知部分键能数据如下:
化学键
C-C
C=C
C-H
H-H
O-H
C=O
C-O
键能/
356
615
413
436
462
745
360
回答下列问题:
(1)“一步法”合成丙烯的热化学方程式为___________。合成丙烯时有乙烯等副产物,若选择作载气时,保持总压不变,调控甲醇和的不同分压,各产物的选择性如下表所示(其他产物略):
分压/MPa
分压/MPa
丙烯选择性/%
乙烯选择性/%
0.10
0
30.9
7.51
0.08
0.02
32.0
7.42
0.04
0.06
34.8
7.03
0.02
0.08
36.7
6.48
0.01
0.09
39.4
5.43
分析表中数据:要合成得到更多的丙烯,应控制甲醇的最佳分压为___________MPa。
(2)已知:。温度为500K时,在密闭反应器中加入2mol ,若只发生反应Ⅰ,达平衡状态时,体系中的物质的量分数为___________(填序号)。A. B. C. D.
(3)“两步法”中,在恒容密闭容器中通入甲醇,初始压强为,反应达到平衡时压强为,则平衡混合体系中,丙烯的体积分数为___________(用含、的式子表示,下同),若平衡时甲醇的转化率为60%,则反应II(OTP)的平衡常数___________。
(4)“两步法”中存在反应Ⅲ: △H,同时也会有芳香烃等副产品,其中丙烯和芳香烃选择性与不同温度下反应I进行的程度的关系如图所示。要提高丙烯的选择性,可采取的措施是___________,当温度高于285℃后,丙烯的选择性降低,其原因是___________。
8.(2023·山东枣庄·统考二模)船舶柴油机发动机工作时,反应产生的尾气是空气主要污染物之一,研究的转化方法和机理具有重要意义。
已知:
(1)氧化脱除NO的总反应是 ________。
(2)该反应过程有两步:,反应中各物质浓度变化如图所示。则速率常数___________(填“>”、“”“”或“<”);c点的K(平衡常数)与Q(浓度商)的等式关系_______(用含、的代数式表示),温度下反应达到平衡,体系压强为p,则_______。
(2)向恒压密闭装置中充入5 mol 和20 mol ,不同温度下同时发生反应Ⅰ和反应Ⅱ,达到平衡时其中两种含碳物质的物质的量与温度T的关系如下图所示
图中缺少_______(填含碳物质的分子式)物质的量与温度的关系变化曲线,随温度升高该物质的变化趋势为_______,800℃时,的产率为_______。
16.(2023·山东菏泽·统考一模)二氧化碳的排放日益受到环境和能源领域的关法,其综合利用是研究的重要课题。回答下列问题:
(1)已知下列热化学方程式:
反应Ⅰ:
反应Ⅱ:
则反应 _______。
(2)①向体积均为V L的恒压密闭容器中通入1 mol 、3 mol ,分别在0.1MPa和1MPa下发生上述反应Ⅰ和反应Ⅱ,分析温度对平衡体系中、CO、的影响,设这三种气体物质的量分数之和为1,其中CO和的物质的量分数与温度变化关系如图所示。下列叙述能判断反应体系达到平衡的是_______(填标号)。
A.的消耗速率和的消耗速率相等
B.混合气体的密度不再发生变化
C.容器内气体压强不再发生变化
②图中表示1MPa时的物质的量分数随温度变化关系的曲线是_______(填字母),理由是_______;550℃、0.1MPa条件下,t min反应达到平衡,平衡时容器的体积为_______L,反应Ⅱ的_______。(以分压表示,分压=总压×物质的量分数)
(3)一种从高炉气回收制储氢物质HCOOH的综合利用示意图如图所示:
①某温度下,当吸收池中溶液的pH=8时,此时该溶液中_______[已知:该温度下,]。
②利用电化学原理控制反应条件能将电催化还原为HCOOH,电解过程中还伴随着析氢反应,若生成HCOOH的电解效率为80%,当电路中转移3 mol 时,阴极室溶液的质量增加_______g[B的电解效率]。
17.(2023·山东济南·统考一模)环氧丙醇(GLD)常用作树脂改性剂。在液相有机体系中,可通过碳酸二甲酯(DMC)和丙三醇(GL)制得,体系中同时存在如下反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
已知:①敞口容器可看成恒压装置,体系压强在反应过程中与大气压(1105Pa)相等;
②反应中产生的物质的量相对于空气中很少,故可忽略不计,空气中的体积分数约为0.04%;
③气体和液体共存于同一体系,如在溶剂E中发生的反应,其平衡常数表达式可表示为(p为气体分压,为液相体系中物质的物质的量分数,)。
回答下列问题:
(1)反应Ⅰ、Ⅱ、Ⅲ的焓变随温度T的变化如图所示。据图判断,表示反应Ⅰ的焓变曲线为_______(填“a”“b”或“c”);反应Ⅱ在_______(填“高温”或“低温”)下可自发进行。
(2)为研究上述反应的平衡关系,向敞口反应容器中加入1.0 mol DMC和1.0 mol GL,控制温度为℃。平衡时,测得液相体系中GLD的物质的量分数,反应Ⅱ的平衡常数Pa,平衡时GLD的产率=_______%,体系放出热量=_______kJ,反应Ⅰ各组分以液相体系中物质的量分数表示的平衡常数_______。同温下,向上述体系中注入惰性四氯化碳稀释,重新达到平衡时,GLD的产率将_______(填“增大”“减小”或“不变"),GLD与物质的量之比_______。
(3)以W表示体系中加入与反应物物质的量的比值。实验测定W不同时,DMC的平衡转化率和GLD的平衡产率随温度的变化关系如下图所示。
其中纵坐标表示GLD平衡产率的是图_______(填“甲”或“乙”);W最大的是_______(填“”“”或“”)。图丙为在不同催化剂下反应相同时间。DMC的转化率随温度变化的关系,图丙上的_______(填字母)点可能是甲、乙两图像所测绘时选取的位置。
18.(2023·山东菏泽·校考一模)为实现“碳达峰”、“碳中和”目标,可将CO2催化加氢制甲醇。该反应体系中涉及以下两个主要反应:
反应I: CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH1=-49kJ/mol
反应II: CO2(g)+H2(g) CO(g)+H2O(g) ΔH2=+41kJ/mol
(1)反应CO(g)+2H2(g) CH3OH(g)的反应热ΔH3=_______。
(2)在密闭容器中,上述反应混合体系建立平衡后,下列说法正确的是_______。
A.增大压强,CO的浓度一定保持不变
B.降低温度,反应II的逆反应速率增大,正反应速率减小
C.增大CH3OH的浓度,反应II的平衡向正反应方向移动
D.恒温恒容下充入氦气,反应I的平衡向正反应方向移动
(3)不同条件下,相同的时间段内CH3OH的选择性和产率随温度的变化如图。
CH3OH的选择性= 100%
①由图可知,合成甲醇的适宜条件为_______ (填标号)
A.CZT催化剂 B.CZ(Zr-1)T 催化剂 C.230°C D.290 °C
②在230°C以上,升高温度,CO2的平衡转化率增大,但甲醇的产率降低,原因是_______。
(4)恒温恒压密闭容器中,加入2molCO2和4molH2,发生反应I和反应II,反应达平衡时,CO2的转化率为50%,气体体积减小10%,则在达到平衡时, CH3OH的选择性=_______,反应II的平衡常数K=_______。
(5)利用电催化可将CO2同时转化为多种燃料,装置如图:
①铜电极上产生HCOOH的电极反应式为_______。
②若铜电极上只生成5.6gCO,则铜极区溶液质量变化了 _______g。
19.(2023·山东·日照一中校联考模拟预测)随着我国碳达峰、碳中和目标的确定,含碳化合物的综合利用备受关注。CO2和H2合成甲醇是CO2资源化利用的重要方法。以CO2、H2为原料合成CH3OH涉及的反应如下:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
回答下列问题:
(1)反应Ⅰ的=_______;已知由实验测得反应Ⅰ的,(、为速率常数,与温度、催化剂有关)。若平衡后升高温度,则_______(填“增大”“不变”或“减小”)。
(2)①下列措施一定能使CO2的平衡转化率提高的是_______(填字母)。
A.增大压强 B.升高温度 C.增大H2与CO2的投料比 D.改用更高效的催化剂
②恒温(200℃)恒压条件下,将1mol CO2和1mol H2充入某密闭容器中,反应达到平衡时,CO2的转化率为a,CH3OH的物质的量为b mol,则此温度下反应Ⅲ的平衡常数Kx =_______[写出含有a、b的计算式;对于反应为物质的量分数。已知CH3OH的沸点为64.7℃]。其他条件不变,H2起始量增加到3 mol,达平衡时,平衡体系中H2的物质的量分数为_______(结果保留两位有效数字)。
(3)反应Ⅲ可能的反应历程如图所示。
注:方框内包含微粒种类及数目、微粒的相对总能量(括号里的数字或字母,单位:eV)。其中,TS表示过渡态、*表示吸附在催化剂上的微粒。
①反应历程中,生成甲醇的决速步骤的反应方程式为_______。
②相对总能量_______eV(计算结果保留2位小数)。(已知:)
20.(2023·山东·济宁一中校联考模拟预测)氢气在工业上具有重要的应用,从炼钢到食品无处不在,未来随着“碳中和”战略的推进,氢气的使用率必将得到进一步的提升。
(1)用H2可以将CO2转化为CH4,该过程中涉及的反应如下。
①CO2(g)+H2(g)CO(g)+H2O(g) △H1=+41kJ•mol-1
②CO2(g)+4H2(g)CH4(g)+2H2O(g) △H2=-205kJ•mol-1
③CO(g)+H2(g)C(s)+H2O(g) △H3=-131kJ•mol-1
④C(s)+2H2O(g)CH4(g)+CO2(g) △H4=-25kJ•mol-1
则反应CO(g)+3H2(g)CH4(g)+H2O(g)的△H=_____,反应③、④的存在会导致甲烷的产率_____(填“增大”“减小”或“不变”)。
(2)微观动力学研究表明,在催化剂作用下,反应CO(g)+3H2(g)CH4(g)+H2O(g)的能量变化如图所示(吸附在催化剂表面的物质用“*”标注)。
在该反应历程中,最大的能垒E正=_____eV,请写出该步骤反应的化学方程式:_____。
(3)在一定条件下,向某2L恒容密闭容器中充入2molCO2、4molH2,发生反应②,测得反应10min时,不同温度下氢气的转化率如图所示。
①a、b、c三点对应的v(CH4)逆由大到小的顺序为_____(用a、b、c表示),请解释原因:_____;T2温度下,若起始时容器内的压强为3MPa,前10min内v(H2)=_____MPa•min-1,该温度下反应的Kp=_____(MPa)-2(保留一位小数,Kp为以分压表示的平衡常数,分压=总压×物质的量的分数)。
②已知速率方程v正=k正•p4(H2)•p(CO2)、v逆=k逆•p2(H2O)•p(CH4),k正、k逆只与温度有关。若T2时,k逆=2(MPa)-2•min-1,则该温度下k正=_____(MPa)-4•min-1。
(4)科学家一直研究开发氢能源,我国科学家研发的循环制氢和贮氢的新工艺如图。下列有关说法正确的是_____(填字母)。
A.ZnFe2O4中Fe为+6价
B.ZnFe2O4降低了H2O分解的活化能
C.反应2中需要不断地补充ZnO、Fe3O4
D.反应3通入氩气作为保护气是因为氩气的化学性质稳定
E.贮氢过程可表示为3H2+2Mg2Cu=3MgH2+MgCu2
21.(2023·山东·潍坊一中校联考模拟预测)环戊烯()无色液体,主要用作共聚单体、溶剂,也可用于有机合成。在催化剂作用下,可通过环戊二烯()选择性氧化制得,体系中同时存在如下反应:
反应I:(g)+H2(g)(g) △H1=-100.3kJ•mol-1
(g)反应II:(g)+H2(g)(g) △H2=-109.4kJ•mol-1
反应III:(g)+(g)2(g) △H3
已知:选择性=×100%
回答下列问题:
(1)反应III_____(“是”或者“不是”)自发反应。
(2)为研究上述反应的平衡关系,在T℃下,向某密闭容器中加入amol环戊二烯和4molH2,测得平衡时,容器中环戊二烯和环戊烷()的物质的量相等,环戊烯的选择性为80%,此时H2的转化率为_____%,反应III以物质的量分数表示的平衡常数Kx3=_____。
(3)为研究不同温度下催化剂的反应活性,保持其他条件不变,测得在相同时间内,上述反应的转化率和选择性与温度的关系如图所示。环戊二烯氢化制环戊烯的最佳温度为_____;30℃以上时,环戊烯的选择性降低的可能原因是_____(填字母)。
A.催化剂活性降低 B.平衡常数变大 C.反应活化能减小
(4)实际生产中采用双环戊二烯()解聚成环戊二烯:(g)2(g) △H>0。若将3mol双环戊二烯通入恒容密闭容器中,分别在T1和T2温度下进行反应。曲线A表示T2温度下n(双环戊二烯)的变化,曲线B表示T1温度下n(环戊二烯)的变化,T2温度下反应到a点恰好达到平衡。
①曲线B在T1温度下恰好达到平衡时的点的坐标为(m,n),则m_____(填“>”、“<”或“=”)2,由图像计算n的取值范围是_____。
②T2温度下,若某时刻容器内气体的压强为起始时的1.5倍,则此时v(正)_____(填“>”、“<”或“=”)v(逆)。
四、工业流程题
22.(2023·山东菏泽·统考一模)五氧化二钒广泛用于冶金、化工等行业,用作合金添加剂、石油精炼用的催化剂等。科研人员研制了一种从废钒催化剂中(含有、、、、等)回收钒的工艺,其主要流程如下:
回答下列问题:
(1)滤渣1的主要成分是_______(填化学式)。
(2)已知有机萃取剂萃取的能力比萃取的能力强。滤液2中的含钒离子为_______(填化学式);实验室进行萃取操作时,需要不时打开分液漏斗活塞放气,正确的放气图示_______(填标号)。
A. B. C.
(3)“酸浸”时,发生反应的离子方程式为_______;“反应”时,加入的不宜过量,其原因是_______。
(4)已知溶液中与可相互转化:,且为沉淀,“沉钒”时通入氨气的作用是_______。
(5)该工艺流程中,可以循环使用的物质有_______。
23.(2023·山东日照·统考一模)一种从含银、铼的废催化剂(含、MgO、、和等)中回收银和铼的工艺流程如下:
已知:高铼酸()是白色片状结晶、微溶于冷水、溶于热水的一元强酸。回答下列问题:
(1)“操作I”和“操作II”均需要用到的玻璃仪器有_______;“操作x”选用_______结晶(填“蒸发”或“降温”)。
(2)“氧化浸出”时,铼(Re)发生反应的离子方程式为_______;将浸出温度控制在70℃,其目的除加快反应速率和减少反应物的分解、挥发外,还有_______。
(3)用石墨电极进行“电沉积银”,所得沉积液可循环到_______中使用(填操作单元名称)。
(4)“氧化浸出”时有AgCl生成,“还原”时,与AgCl反应生成和一种无毒气体,该反应的化学方程式为_______。若生成的AgCl用溶解,则100mL 6 最多能溶解AgCl_______g(保留两位有效数字)。已知:)的平衡常数称为稳定平衡常数,;AgCl的。
24.(2023·山东临沂·统考一模)钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10-38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为_____;滤渣I的主要成分是_____(填化学式)。
(2)“氧化”时加入足量H2O2的目的是______;氧化后溶液中Fe3+浓度为0.001mol•L-1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为______(忽略调pH前后溶液的体积变化)。
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4Sc2(C2O4)3↓+6H+,该反应的平衡常数K=______(用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热分解时,随温度变化如图所示。已知:M[Sc2(C2O4)3·6H2O]=462g·mol-1。
250℃时固体的主要成分是_____(填化学式);550~850℃时反应的化学方程式为______。
25.(2023·山东·日照一中校联考模拟预测)我国冶铅工艺迅猛发展,底吹炉烟灰中除含有主金属铅外,还含有锌、镉(Cd)等有价金属元素,一种对该烟灰中有价金属综合回收工艺研究如下:
已知:Ⅰ.
底吹炉含镉烟灰的主要化学成分
质量分数/%
37.40
15.88
2.51
0.15
0.28
0.15
①As元素以砷酸盐()形式存在;
②Pb元素主要以PbO和PbSO4形式存在,不溶于水;
③Cd元素主要以CdSO4形式存在,CdSO4易溶于水。
Ⅱ.水浸液初始pH=2~3;滤渣①返回冶铅系统;滤渣②主要成分为FeAsO4。
回答下列问题:
(1)为提高“水浸”效率,可以采取的措施有_______(任写一条)。
(2)为提高铅和镉的回收率,需综合分析浸出率、渣含金属、渣率。
温度/℃
浸出率/%
渣含金属
渣率/℃
25
86.06
65.48
55.48
3.27
1.28
67.69
45
84.19
63.95
54.63
3.69
1.33
68.04
65
85.51
62.45
55.63
3.37
1.38
68.30
85
84.15
65.08
54.70
3.82
1.33
65.90
液固比
浸出率/%
渣含金属
渣率/℃
1:1
75.22
54.65
51.26
5.29
1.53
74.39
2:1
80.59
58.62
53.98
4.28
1.47
70.66
3:1
85.51
62.45
55.63
3.37
1.38
68.30
4:1
86.82
65.02
57.06
3.14
1.32
66.52
根据以上实验数据选择合适的液固比和温度:_______,理由:_______。
(3)“中和除砷”阶段主要反应的离子方程式为_______。该工序最终需加入试剂①调节溶液pH=5,下列最合适的是_______(填序号)。
A.NaOH B.NH3·H2O C.Zn2O D.H2SO4
(4)“电解”过程中阴极的电极反应式为_______。
26.(2023·山东菏泽·校考一模)钪是一种稀土金属元素,在国防、航天、核能等领域具有重要应用。工业上利用固体废料“赤泥”(含FeO、Fe2O3、SiO2、Sc2O3、TiO2等)回收Sc2O3的工艺流程如图。
已知:TiO2难溶于盐酸;Ksp[Fe(OH)3]=1.0×10−38。
回答下列问题:
(1)为提高“酸浸”速率,对“赤泥”的处理方式为___________;滤渣I的主要成分是___________(填化学式)。
(2)“氧化”时加入足量H2O2的目的是___________;氧化后溶液中Fe3+浓度为0.001 mol∙L−1,常温下“调pH”时,若控制pH=3,则Fe3+的去除率为___________(忽略调pH前后溶液的体积变化)。
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c。“沉钪”时,发生反应:2Sc3++3H2C2O4Sc2(C2O4)3↓+6H+,该反应的平衡常数K=___________(用含a、b、c的代数式表示)。
(4)Sc2(C2O4)3·6H2O在空气中加热至550℃时生成Sc2O3、CO2和H2O,写出反应的化学方程式___________。
参考答案:
1.C
【分析】根据反应机理图示,是反应物,是生成物,其余为中间产物。
【详解】A.根据反应③,X为,是生成物,A错误;
B.根据反应③④,涉及的中间产物中Fe元素化合价相同,B错误;
C.是催化剂,增加的量时,实质是增加的量,催化剂只改变反应速率,不改变反应物的平衡转化率,C正确;
D.反应③显示其是制备过程的副反应,会生成X(乙醇),因此每消耗1molN2O,制备不了0.5molCH3CHO,D错误;
故选C。
2.C
【详解】A.温度升高,反应速率均增大即H2S分解的正,逆反应速率均增大,故A正确;
B.900℃,ts后达平衡,硫化氢的转化率为50%,则氢气的压强为0.5pkPa,则H2的平均生成速率为,故B正确;
C.根据图中曲线分析,升高温度,硫化氢的转化率增大,因此该反应是吸热反应,则正反应的活化能大于逆反应的活化能,而加入Al2O3催化剂使正反应和逆反应活化能都降低,但正反应的活化能仍大于逆反应的活化能,故C错误;
D.催化剂需要适宜温度,在1100℃,曲线II、III重合,说明Al2O3催化剂可能几乎失去活性,故D正确。
综上所述,答案为C。
3.C
【分析】步骤①加水溶解溶液含Fe3+,步骤②Fe3+与结合生成,步骤③发生平衡转化为;
【详解】A.为浅紫色,但溶液I却呈黄色,原因可能是Fe3+发生水解生成红褐色Fe(OH)3,与浅紫色形成混合体系,使溶液呈黄色,A正确;
B.加入NaF后溶液II由红色变为无色,说明转变为,反应更易生成,说明与的配位能力强于,B正确;
C.为了观察到浅紫色,需要除去红褐色,即抑制铁离子的水解,所以可向溶液中加稀硝酸,加稀盐酸会生成黄色的,C错误;
D.向溶液III中加入足量的KSCN固体,可使平衡的Q>,平衡正向移动,溶液可能再次变为红色,D正确;
故选C。
4.C
【详解】A.由题干信息可知,铬与铝性质相似,但活泼性比铝弱,故可用铝热反应制备铬,原理为:2Al+Cr2O3Al2O3+2Cr,A正确;
B.由题干信息可知,铬与铝性质相似,已知常温下铝在浓硝酸、浓硫酸中发生钝化,故常温下铬在浓硝酸中发生钝化,B正确;
C.由题干信息可知,铬与铝性质相似,故蒸发CrCl3溶液时由于CrCl3水解得到Cr(OH)3和HCl,HCl易挥发,促进水解正向进行,故直接蒸发CrCl3溶液不能制备无水CrCl3,C错误;
D.已知碱性条件下,Cr(Ⅲ)可被氧化为Cr(Ⅵ),由+H2O2+2H+可知,则其氧化产物为,D正确;
故答案为:C。
5.C
【详解】A.加入的NaOH与反应(ⅱ)电离产生的发生反应,促使两个平衡不断右移,最终生成,反应的离子方程式为,A正确;
B.当溶液pH=8.8时,,经计算可知,
溶液中,Cr原子总浓度为,根据Cr原子守恒得
,转化可得,B正确;
C.根据题给信息可知溶液显酸性,,温度一定时均为定值,稀释溶液时减小,增大,C错误;
D.由图可知,当溶液pH=9.0时,,因此可忽略溶液中的,即,
反应(ⅱ)的平衡常数,联立两个方程可
得,D正确;
故选C。
6.AB
【分析】方铅矿(主要成分为PbS,含有FeS2等杂质)和MnO2中加入盐酸浸取,盐酸与MnO2、PbS反应生成PbCl2和S,MnO2被还原为Mn2+,加入的NaCl可促进反应PbCl2(s)+2Cl-(aq)(aq)平衡正向移动,使更多的Pb元素存在于溶液中,加入MnO调节溶液pH,使铁离子转化成氢氧化铁沉淀除去,然后过滤得到滤渣2为氢氧化铁沉淀,PbCl2难溶于冷水,将滤液冷水沉降过滤得到PbCl2晶体,之后加入稀硫酸发生沉淀转化,生成硫酸铅晶体,滤液a中主要成分为HCl。
【详解】A.浸取时盐酸与MnO2、PbS反应生成PbCl2和S,MnO2被还原为Mn2+,加入的NaCl可促进反应PbCl2(s)+2Cl-(aq)(aq)平衡正向移动,使更多的Pb元素存在于溶液中,离子方程式为MnO2+PbS+4H++4Cl-=+S+Mn2++2H2O,A错误;
B.PbCl2(s)+2Cl-(aq) (aq)ΔH>0,加入冰水温度降低,化学平衡逆向移动,有利于PbCl2沉淀更完全,B错误;
C.滤液a中主要成分为HCl,经处理后可返回浸取工艺循环利用,C正确;
D.沉淀转化的方程式为PbCl2(s)+(aq)PbSO4(s)+2Cl-(aq),该反应的平衡常数K=,沉淀转化后c(Cl-)=10mol/L,则沉淀转化后溶液中c()为0.08mol/L,反应生成的PbSO4为5mol,则初始的H2SO4的物质的量至少为5.08mol,浓度不得低于5.08mol/L,D正确;
故答案选AB。
7.(1) 0.01
(2)B
(3)
(4) 升高温度 反应III为吸热反应,升高温度,平衡正向移动,副产物增多,丙烯的选择性降低
【详解】(1)已知:
反应I:
反应II:
由盖斯定律可知,I+II得:,反应的焓变等于反应物的键能和减去生成物的键能和,由图表数据可知,;
分析表中数据:要合成得到更多的丙烯,应控制甲醇的最佳分压为0.01MPa,此时丙烯的选择性最高,而副产物乙烯的选择性最低;
(2)温度为500K时,在密闭反应器中加入2mol ,若只发生反应Ⅰ,由于反应为可逆反应不可能进行完全,则体系中的物质的量分数小于;已知:,温度为500K时,,;假设某一时刻,甲醇、甲醚、水的物质的量相等,此时体系中的物质的量分数为,则,反应正向移动,故平衡是体系中的物质的量分数大于;故选B;
(3)在恒容密闭容器中通入甲醇,初始压强为,反应达到平衡时压强为;“两步法”中,反应I为气体分子数不变的反应,反应II为气体分子数增加1的反应,则总压强的变化是由反应II引起的,根据化学方程式II体现的关系可知,平衡混合体系中,丙烯的分液为,体积分数为;若平衡时甲醇的转化率为60%,则反应甲醇0.6、平衡是甲醇0.4;平衡时丙烯;则反应II生成水2、消耗甲醚,反应I消耗甲醇[0.6-]=(0.8-0.5)、生成甲醚(0.8-0.5)、水(0.8-0.5),故平衡时甲醚为(0.8-0.5)-=(1.8-1.5)、水为2+(0.8-0.5)=(1.5-1.2),故反应II(OTP)的平衡常数;
(4)要提高丙烯的选择性,可采取的措施是适当升高温度;当温度高于285℃后,丙烯的选择性降低,其原因是反应III为吸热反应,升高温度,平衡正向移动,副产物增多,丙烯的选择性降低。
8.(1)
(2) > 含量先增大后减少
(3) 。
(3)①活化能越小,反应速率越快,则反应I与反应II的活化能:1.5,当容器内气体的压强为起始时的1.5倍时,反应正向进行,即v(正)>v(逆);故答案为:>。
22.(1)SiO2
(2) C
(3) 过量的将氧化,影响萃取,造成损失
(4)使正向移动,将转化为,同时增大浓度,使逆向移动使NH4VO3尽可能沉淀析出
(5)有机物(有机萃取剂)、NH3和H2O
【分析】从废钒催化剂中回收,由流程可知,“酸浸”时转化为,转成VO2+,FeSO4可使转化为VO2+,氧化铁、氧化铝均转化为金属阳离子,只有SiO2不溶,则过滤得到的滤渣1为SiO2,滤液中加过氧化氢将Fe2+氧化,再加KOH时,铁离子、铝离子转化为Fe(OH)3、Al(OH)3沉淀,同时中和硫酸,过滤得到的滤渣2为Fe(OH)3、Al(OH)3,滤液2萃取、分液,水相中蒸发结晶分离出硫酸钾,有机相1反萃取分离出有机萃取剂,水相含VO2+,氧化时发生3H2O+ClO+6VO2+=6+Cl−+6H+,溶液中与可相互转化:+H2O+2H+,“沉钒”得到偏钒酸铵(NH4VO3)沉淀,“煅烧”时分解生成V2O5,以此来解答。
【详解】(1)据分析可知,渣1的主要成分是SiO2,故答案为SiO2。
(2)已知有机萃取剂萃取的能力比萃取的能力强,且根据流程分析可知,滤液2中的含钒离子为;分液漏斗活塞放气时从下口放弃,所以正确的放气图示为C,故答案为;C。
(3)“酸浸”时转成VO2+,发生反应的离子反应为;“反应”时,加入的不宜过量,过量的将氧化,影响萃取,造成损失;故答案为;过量的将氧化,影响萃取,造成损失。
(4)溶液中存在平衡,通入氨气,使溶液中OH−浓度增大,消耗了H+,该平衡正移,从而使尽可能都转化为,另外溶液中存在平衡,通入氨气,使溶液中浓度增大,该平衡逆移,从而使NH4VO3尽可能沉淀析出,则目的为使正向移动,将转化为,故答案为使正向移动,将转化为,同时增大浓度,使逆向移动使NH4VO3尽可能沉淀析出。
(5)NH3和H2O可循环使用,“萃取”和“反萃取”时,有机萃取剂也可循环使用,可以循环使用的物质有有机物(有机萃取剂)、NH3和H2O,故答案为有机物(有机萃取剂)、NH3和H2O。
【点睛】本题考查物质的分离提纯实验,为高频考点,把握制备流程、发生的反应、物质的性质为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度中等。
23.(1) 分液漏斗和烧杯 降温
(2) 2Re+7H2O2=2ReO+6H2O+2H+ 溶解高铼酸
(3)酸溶
(4) 4AgC1+5=4Ag↓+N2↑+4+5H2O 7.18g
【分析】含银、铼的废催化剂(含、MgO、、和等),稀盐酸条件下双氧水溶解废催化剂中的铼生成高铼酸,、、MgO和Fe2O3也被溶解转化为对应价态的金属阳离子进入浸液,用树脂进行萃取分液分离金属离子和高铼酸,再用氨水萃取获得高铼酸铵。Ag和SiO2为浸渣,加入还原获得银,酸溶后分离二氧化硅,再经过电沉积后获得Ag,副产物中含有稀硝酸,可重复使用。
【详解】(1)“操作I”和“操作II”是萃取分液,需用到的玻璃仪器是分液漏斗和烧杯;铵盐受热容易分解,故“操作x”选用降温结晶;
(2)“氧化浸出”时,铼(Re)被双氧水氧化生成高铼酸,发生反应的离子方程式为2Re+7H2O2=2ReO+6H2O+2H+;高铼酸()是白色片状结晶、微溶于冷水、溶于热水的一元强酸。将浸出温度控制在70℃,其目的除加快反应速率和减少反应物的分解、挥发外,还有使高铼酸溶解的目的;
(3)滤液主要含硝酸银,通过电解得纯银,副产物中含有稀硝酸,可重复使用到酸溶过程;
(4)“还原”时,与AgCl反应生成和一种无毒气体氮气,该反应的化学方程式为4AgC1+5=4Ag↓+N2↑+4+5H2O;
已知:①) ;
②AgCl(s)Ag+(aq)+Cl-(aq) ;
①+②可得AgCl(s)+2NH3(aq)[Ag(NH3)2]+(aq)+Cl-(aq) 。设100mL 6 最多能溶解AgCl的物质的量为nmol;
n(AgCl)=0.05mol,m(AgCl)=0.05mol143.5g/mol7.18g。
24.(1) 将“赤泥”粉碎 SiO2、TiO2
(2) 将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+ 99%
(3)
(4) Sc2(C2O4)3·H2O 2Sc2(C2O4)3+3O22Sc2O3+12CO2
【分析】本工艺流程题是从固体废料“赤泥”里回收Sc2O3,由题干流程图结合题干已知信息可知,“熔炼” 时主要是将Fe2O3、SiO2分别还原为Fe和Si,并将大部分Fe和Si转化为熔融物分离出来,则固体为Sc2O3、TiO2和少量的Fe、S等,加入盐酸后将Fe转化为 Fe2+、Sc2O3转化为Sc3+、过滤的滤渣主要成分为TiO2、S和C,滤液中加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+,过滤得固体沉淀物为Fe(OH)3沉淀,向滤液中加入草酸,得到草酸钪晶体,过滤洗涤干燥后,在空气中加热可得Sc2O3固体,据此分析解题。
【详解】(1)将“赤泥”粉碎,可增大其与酸的接触面积,加快化学反应速率,故“酸浸”前对“赤泥”的处理方式为将“赤泥”粉碎;“赤泥”含有Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,故滤渣1的主要成分为SiO2、TiO2;
(2)由分析可知,氧化时,加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;当pH=3时,溶液中氢氧根离子的浓度=10-11mol/L,此时三价铁的浓度=,则Fe3+的去除率=;
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c,则反应2Sc3++3H2C2O4=Sc2(C2O4)3+6H+的平衡常数K=;
(4)设有1mol草酸钪晶体(462g)在空气中受热,250℃时,剩余固体质量为462g´80.5%=371.91g,失水重量为462g-371.91g=90.09g≈90g,即250℃时,1mol晶体失去5mol水,则此时晶体的主要成分是Sc2(C2O4)3·H2O;550℃时,剩余固体质量为462g´76.6%=353.89g,相比于250℃时的剩余固体质量,250~550℃,失水重量为371.91g-353.89g=18.02g≈18g,则250~550℃,1mol Sc2(C2O4)3·H2O失去1mol水变为1mol Sc2(C2O4)3;850℃时,剩余固体质量为462g´29.8%=137.68g≈138g,由于M(Sc2O3)=138g/mol,故可知550~850℃,1mol Sc2(C2O4)3分解产生1mol Sc2O3,反应的化学方程式为2Sc2(C2O4)3+3O22Sc2O3+12CO2。
25.(1)适当提高温度,搅拌
(2) 3:1、25 ℃ 液固比为3:1时镉的浸出率比较高,同时渣率较高、且渣含金属中铅的含量较高;温度变化对回收率影响不大,常温浸出有利于节约能源
(3) C
(4)=
【分析】由已知I可知,氧化锌烟灰经水浸、过滤,滤渣是PbO和PbSO4,滤液中含锌、铜、镉、砷元素;经过中和除砷,,砷元素转化为沉淀除去,同时也将铜元素转化为氢氧化铜沉淀除去;过滤后加入锌粉还原,可将镉元素分别转化为高品位海绵镉和低品位海绵镉,滤液主要含有 ,电解可生成高纯度锌。
【详解】(1)可以通过适当提高温度、搅拌等操作提高“水浸”效率。
(2)渣含金属与渣率的乘积即为渣中所含金属的量,据信息Ⅱ可知铅元素以滤渣的形式回收,即铅的浸出率要低,渣含金属与渣率的乘积要高,据流程中物质流向分析,镉要进入溶液,故其浸出率要高。温度变化对二者回收率影响不大,考虑能源节约,选择常温(25 ℃);由几组液固比对比可知液固比由3:1改为4:1,Cd的浸出率增加很小,Pd的渣含金属与渣率的乘积相差也很小,故选液固比3:1。
(3)由信息Ⅱ知,滤渣②的主要成分为FeAsO4,“中和除砷”阶段溶液显酸性,反应的离子方程式为,为不引入杂质选择试剂ZnO来调节溶液pH。
(4)“电解”制锌时,锌离子得电子生成Zn,故阴极的电极反应式:=。
26.(1) 将“赤泥”粉碎 SiO2、TiO2
(2) 将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+ 99%
(3)
(4)2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O
【分析】“赤泥”含有FeO、Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,FeO、Fe2O3、Sc2O3与盐酸反应生成 Fe2+、Fe3+、Sc3+,过滤的滤渣主要成分为SiO2、TiO2,滤液中加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+,加氨水调节pH值沉淀铁离子,过滤得固体沉淀物为Fe(OH)3沉淀,向滤液中加入草酸,得到草酸钪晶体,过滤洗涤干燥后,在空气中加热可得Sc2O3固体。
【详解】(1)将“赤泥”粉碎,可增大其与酸的接触面积,加快化学反应速率,故“酸浸”前对“赤泥”的处理方式为将“赤泥”粉碎;“赤泥”含有FeO、Fe2O3、SiO2、Sc2O3、TiO2等,用盐酸酸浸时,SiO2、TiO2难溶于盐酸,故滤渣1的主要成分为SiO2、TiO2;故答案为:将“赤泥”粉碎;SiO2、TiO2。
(2)由分析可知,氧化时,加入H2O2将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;当pH=3时,溶液中氢氧根离子的浓度c(OH-)=10−11 mol∙L−1,此时三价铁的浓度为,则Fe3+的去除率为;故答案为:将Fe2+氧化为Fe3+便于后续调节pH来除去Fe3+;99%。
(3)已知25℃时,Kh1(C2O)=a,Kh2(C2O)=b,Ksp[Sc2(C2O4)3]=c,则反应2Sc3++3H2C2O4=Sc2(C2O4)3+6H+的平衡常数;故答案为:。
(4)Sc2(C2O4)3·6H2O在空气中加热至550℃时生成Sc2O3、CO2和H2O,草酸根被氧化为二氧化碳,说明氧气参与反应,则反应的化学方程式2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O;故答案为:2Sc2(C2O4)3·6H2O+3O22Sc2O3+12CO2+12H2O。
相关试卷
这是一份近年(22-23)北京高考化学模拟题-化学平衡汇编,共11页。
这是一份新疆高考化学三年(2021-2023)模拟题汇编-11化学反应速率与化学平衡,共34页。试卷主要包含了单选题,原理综合题,工业流程题,实验题等内容,欢迎下载使用。
这是一份吉林高考化学三年(2021-2023)模拟题汇编-11化学反应速率与化学平衡,共48页。试卷主要包含了单选题,原理综合题,工业流程题,填空题等内容,欢迎下载使用。









